|
Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
ГЛАВА 12
Использование рекомбинантных
микроорганизмов для получения
коммерческих продуктов
До настоящего времени основной целью исследований в области молекулярной биотехнологии было получение различных белков. Однако технологию рекомбинантных ДНК можно использовать также для крупномасштабного производства многих ценных низкомолекулярных соединений — витаминов, аминокислот, антибиотиков и т. д.
При наличии эффективной системы экспрессии получение белка — продукта специфического гена - не составляет особого труда. Белок может представлять собой либо тот конечный продукт, который хотят получить (например, рестрицирующую эндонуклеазу), либо фермент, катализирующий определенную химическую реакцию (например, одну из реакций биосинтеза антибиотиков). Иногда в результате генетических манипуляций микроорганизм приобретает способность к синтезу нового фермента и может использоваться для получения in vivo низкомолекулярных соединений — витаминов, аминокислот, красителей, антибиотиков, предшественников различных биополимеров и т. д. Такой микроорганизм становится «фабрикой» по производству полезных метаболитов.
Эндонуклеазы рестрикции
Развитие технологии рекомбинантных ДНК было бы невозможно, если бы в распоряжении исследователей не было нужных эндонуклеаз рестрикции (рестриктаз). В настоящее время в продаже имеется более 300 различных рестриктаз. Эти ферменты синтезируются самыми разными микроорганизмами: аэробными, анаэробными, фотосинтезирующими, диазотрофными, мезотрофными, термофильными, психрофильными, медленно- и быстрорастущими. Для культивирования каждого из них необходимо подобрать оптимальные условия ферментации температуру, pH, состав среды, концентрацию кислорода — с тем чтобы максимизировать выход необходимого фермента. Чтобы не пришлось выращивать большое число разных микроорганизмов, готовить многокомпонентные среды, разрабатывать разные ферментеры и тратить время на подбор оптимальных условий роста для многочисленных организмов, часто клонируют гены эндонуклеаз рестрикции в Escherichiacoli. Это позволяет стандартизовать условия получения необходимых продуктов. Кроме того, культура клеток Е. coliбыстро достигает высокой плотности и может быть приспособлена для сверхпродукции необходимого фермента.
Технология выделения и экспрессии чужеродных генов в E. coli и в некоторых других микроорганизмах достаточно хорошо отработана, однако не стоит забывать, что синтез гетерологичного белка в организме-хозяине может оказывать на него негативное влияние. Например, сверхпродукция такого белка может привести к истощению метаболических ресурсов хозяйского организма и отрицательно повлиять на его рост. Присутствие гетерологичного белка может оказаться даже губительным для клетки-хозяина. Так, сайты рестрикции имеются во всех молекулах ДНК, и если продуктом клонированного гена является эндонуклеаза рестрикции, то в отсутствие специальных зашитных механизмов хозяйская ДНК будет расщепляться ею.
248 ГЛАВА 12
Микроорганизмы, синтезирующие эндонуклеазы рестрикции, выработали систему самозащиты: они метилируют одно или несколько оснований рестриктазного сайта, и расщепление ДНК в этом сайте гомологичной эндонуклеазой рестрикции блокируется. Грамотрицательные микроорганизмы имеют еще один механизм защиты: эндонуклеазы рестрикции у них локализованы в периплазматическом пространстве. Благодаря такой компартментализации происходит физическое разделение рестриктаз и ДНК и при этом обеспечивается свободный доступ метилирующего (модифицирующего) фермента к хромосомной ДНК. Кроме того, это защищает клетку от проникновения в нее любой чужеродной ДНК, например вирусной.
Один из подходов к решению проблемы деградации хозяйской ДНК гетерологичными эндонуклеазами рестрикции состоит в клонировании и экспрессии в реципиентном организме как гена фермента рестрикции, так и гена соответствующего модифицирующего фермента. Однако клонирование обоих этих генов в одном микроорганизме технически затруднено, если они расположены на хромосоме донорного организма далеко друг от друга. Кроме того, чтобы не допустить расщепления хозяйской ДНК эндонуклеазами рестрикции, метилирующий фермент после трансформации должен синтезироваться еще до начала синтеза рестриктазы.
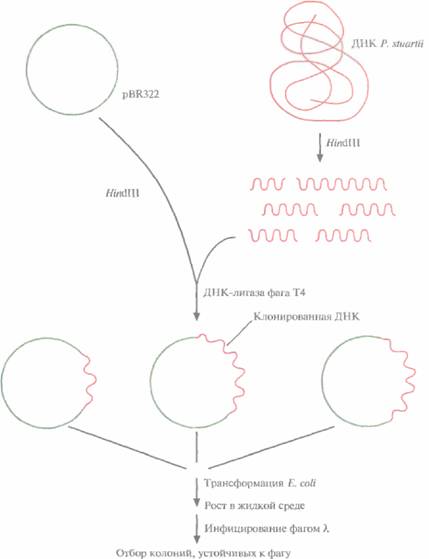
На рис. 12.1 представлена стратегия выделения и клонирования в Е. coliгена рестриктазы Pstl грамотрицательной бактерии Providencia stuartii
1. ДНК P, stuartii расщепляют с помощью HindIIIи встраивают фрагменты в HindIII-сайт плазмиды pBR322.
2. Рекомбинантными плазмидами трансформируют клетки E. соli НВ101 и выращивают их в жидкой среде, а затем инфицируют бактериофагом λ. Если в хозяйской клетке экспрессируется ген фермента рестрикции, то она оказывается устойчивой к литическому действию фагов типа λ, ДНК которых активно расщепляется синтезируемой рестриктазой.
3. Трансформированные клетки, устойчивые к фагу λ, подвергают осмотическому шоку, чтобы высвободить периплазматические белки. Определяют активность рестриктазы PstI в белковом экстракте.
4. Положительные клоны тестируют на наличие PstI-метилирующей активности.
Один положительный клон, выявленный в этом эксперименте, содержал встроенный фрагмент ДНК длиной 4 т. п. н. с интактным опероном рестриктазы и метилазы Art и промотором P. stuartiiВ клоне, несущем эту генетическую конструкцию, соблюдался естественный временной порядок синтеза: вначале синтезировался метилирующий фермент, затем эндонуклеаза рестрикции. Уровень экспрессии гена рестриктазы PsAв Е. coltбыл примерно в 10 раз выше, чем в P. stuartii. Как и предполагалось, рестриктаза находилась в периплазматическом пространстве, а метилаза — в цитоплазме. Метод получения PstI клонированием соответствующего гена в Е. соliгораздо более эффективен, чем выделение этого фермента из P. stuartii.
Для выделения генов, кодирующих ферменты рестрикции и модификации (метилирования), можно использовать также другой подход, который состоит в следующем,
1. Создают банк клонов ДНК организма-донора, продуцирующего известную эндонуклеазу рестрикции. Используемый при этом плазмидный вектор должен содержать по крайней мере один сайт узнавания для этой рестриктазы.
2. Трансформируют Е. coltгибридными плазмидами.
3. Из трансформированных клеток, выросших в жидкой селективной среде (т. е. из клеток, содержащих плазмиду), выделяют плазмиднуюДНК.
4. Обрабатывают ее интересующей исследователя эндонуклеазой рестрикции,
5. Трансформируют Е. coliплазмидными ДНК, обработанными эндонуклеазой рестрикции.
Ключевым моментом этого метода является то, что плазмидная ДНК клонов, несущих и экспрессирующих ген фермента модификации, оказывается устойчивой к расщеплению соответствующей эндонуклеазой рестрикции, поскольку сайты узнавания в ней метилированы.
Использование рекомбинантных микроорганизмов для получения коммерческих продуктов 249
Рис. 12.1. Клонирование гена рестриктазы PstI и отбор несущих его трансформированных бактериальных клеток. Хромосомную ДНК P.stuartii расщепляют HindIIIи встраивают фрагменты в плазмиду pBR322. Трансформируют рекомбинантной плазмидой Е. coli, выращивают клетки в жидкой среде и инфицируют фагом λ. Отбирают трансформанты, устойчивые к фагу; именно они несут и э кспрессируют клонированный ген PstI.
|
|
Рассмотрим следующий пример. В плазмиду pBR322 встраивали HindIII-фрагменты ДНК Desulfovibriodesulfuricansи трансформировали ею клетки Е. coli. Выделенную из трансформированных клеток плазмидную ДНК обрабатывали рестриктазой DdeI. Плазмиды, несущие и экспрессирующие ген метилирующего фермента, не расщеплялись, поскольку все восемь сайтов узнавания DdeIв pBR322 были метилированы. Смесь плазмид, обработанных Ddel, использовали для трансформации E. coli. Образование трансформантов, несущих ген функционального модифицирующего фермента DdeI, обеспечивали только целые кольцевые молекулы плазмидных ДНК. Остальные плазмиды были расщеплены эндонуклеазой рестрикции. Для того чтобы определить, какие клоны содержат и ген фермента модификации, и ген эндонуклеазы рестрикции, трансформанты тестировали на наличие в них активной рестриктазы DdeI. Описанный подход можно с успехом использовать для выделения гена любой рестриктазы, лишь бы он находился достаточно близко к гену соответствующего модифицирующего фермента и
250 ГЛАВА 12
был встроен в плазмидный вектор, имеющий по меньшей мере один сайт узнавания для данного фермента.
|
|
|
 Скачать 9.74 Mb.
Скачать 9.74 Mb.
