Конспект лекций Навои-07. Гоу впо Уральский государственный технический университет упи С. Д. Ващенко, О. А. Антропова
 Скачать 490.5 Kb. Скачать 490.5 Kb.
|
5.4. Диссоциация воды. Водородный показательВода является слабым электролитом. Уравнение диссоциации воды упрощенно записывают следующим образом: H2O H+ + OH. Константа диссоциации воды: 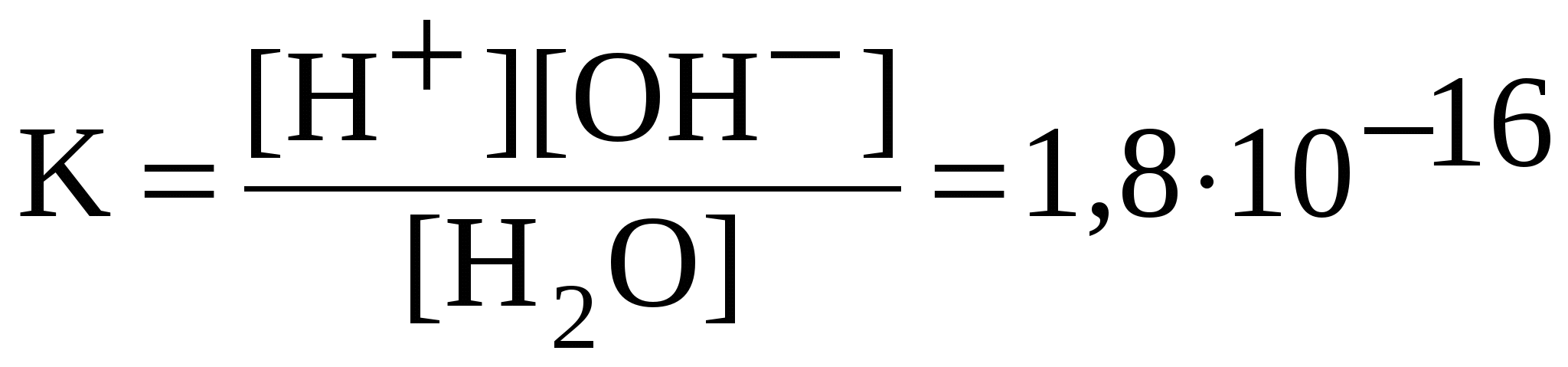 . .
Ионное произведение воды при постоянной температуре постоянно не только для воды, но и для водных растворов. Зная концентрацию ионов H+, можно рассчитать концентрацию OH, и наоборот. Понятия кислая, нейтральная и щелочная среда можно оценить количественно по концентрации ионов H+ или OH. Более удобно для характеристики среды пользоваться водородным показателем:
5.5. Гидролиз солей
Гидролиз солей происходит в тех случаях, когда ионы, образующиеся в результате диссоциации соли, способны образовать с ионами воды малодиссоциирующие частицы. Гидролиз чаще всего является обратимым процессом, так как продукты реакции взаимодействуют между собой с образованием исходных веществ. Соли, образованные сильной кислотой и сильным основанием, например NaCl, KNO3, CaCl2 и др., гидролизу не подвергаются, их растворы нейтральны.
слабыми кислотами и сильными основаниями (Na3PO4, K2SO3, Na2S и др.); слабыми основаниями и сильными кислотами (NH4Cl, AlCl3, ZnSO4 и др.); слабыми кислотами и слабыми основаниями (NH4CH3COO, NH4CN и др.).
Гидролиз NaNO2.Диссоциация соли: NaNO2 = Na+ + NO2— краткое ионное уравнение: NO2— + HOH HNO2 + OH— (среда щелочная, рН>7); молекулярное уравнение: NaNO2 + H2O HNO2 + NaOH. Гидролиз K2CO3 (гидролиз солей многоосновных кислот преимущественно происходит по первой ступени). Диссоциация соли: K2CO3 = 2K+ + CO32 — краткое ионное уравнение: CO32 — + HOH HCO3 + OH— (среда щелочная, рН>7); молекулярное уравнение: K2CO3 + H2O KHCO3 + KOH. По второй ступени гидролиз практически не идет.
Гидролиз NH4Cl. Диссоциация соли: NH4Cl = NH4+ + Cl краткое ионное уравнение: NH4+ + HOH NH4OH + H+ (среда кислая, рН<7); молекулярное уравнение: NH4Cl + H2O NH4OH + HСl. Гидролиз AlCl3 (гидролиз солей многокислотных оснований преимущественно происходит по первой ступени): AlCl3 = Al3+ + 3Cl— Al3+ + HOH AlOH2+ + H+ (среда кислая, рН<7); молекулярное уравнение: AlCl3 + H2O AlOHCl2 + HСl. По следующим ступеням гидролиз практически не идет.
В этом случае, если соль растворима, в реакции одновременно участвуют и катион, и анион соли, связывающие ионы OH— и H+ из воды, равновесие сильно смещается вправо, гидролиз усиливается. Значение рН раствора зависит от относительной силы кислоты и основания, образующих соль.Гидролиз CH3COONH4: CH3COONH4 = NH4+ + CH3COO— NH4+ + CH3COO — + HOH NH4OH + CH3COOH CH3COONH4 + H2O NH4OH + CH3COOH Константы диссоциации уксусной кислоты и гидроксида аммония равны: Растворимые соли, образованные многоосновными слабыми кислотами и многокислотными слабыми основаниями гидролизованы в растворе практически полностью с образованием кислоты и основания: Сr2S3 + 6H2O = 2Cr(OH)3 + 3H2S. Такие соли в водных растворах существовать не могут. В таблице растворимости им соответствует прочерк.
Если в растворе одновременно присутствуют две соли, одна из которых содержит катион слабого основания (Al3+, Fe3+, Cr3+, NH4+), а другая - анион слабой кислоты (СO32—, SO32—, S2—, SiO32—), то гидролиз необратим, идёт с образованием кислоты и основания. Пример реакции совместного гидролиза солей:2AlCl3 + 3Na2CO3 + 6H2O = 2Al(OH)3 + 3H2CO3 + 6NaCl 2Al3+ + 3CO32— + 3H2O = 2Al(OH)3 + 3H2CO3. 6. ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 6.1. Основные понятия Окислительно-восстановительными (ОВР) называют реакции, проходящие с изменением степени окисления элементов за счет перехода электронов от одних частиц к другим. Степень окисления атома – его условный заряд, который вычисляют, исходя из предположения, что молекулы состоят только из ионов. Степень окисления атомов элементов в простых веществах равна нулю, кислорода в большинстве соединений - (–2) , водорода и щелочных металлов - (+1). Высшая степень окисления элемента, как правило, равна номеру группы, в которой расположен элемент в Периодической системе Д.И.Менделеева. Низшая степень окисления для атомов металлов равна нулю, для атомов неметаллов – суммарному заряду электронов, необходимых для достройки последнего энергетического подуровня. В формулах степень окисления при необходимости показывают арабской цифрой над символом элемента, например Пример. Определить степень окисления марганца в соединениях: MnO2, K2MnO4 , KMnO4 . Решение. Составляем простейшие алгебраические уравнения, обозначив степень окисления марганца за
|
