Конспект лекций Навои-07. Гоу впо Уральский государственный технический университет упи С. Д. Ващенко, О. А. Антропова
 Скачать 490.5 Kb. Скачать 490.5 Kb.
|
3.4. ЭнтропияЭнтропия (S) – количественная мера беспорядка в системе. Размерность - Процессы и реакции, сопровождающиеся увеличением беспорядка в системе: нагревание, расширение, кипение, плавление, растворение, увеличение количества газообразных веществ, - приводят к увеличению энтропии. Процессы, связанные с уменьшением беспорядка в системе, приводят к уменьшению энтропии: охлаждение, конденсация, сжатие, кристаллизация, реакции, сопровождающиеся уменьшением количества газообразных веществ. Например, оценим изменение энтропии системы в химической реакции: С(ГРАФИТ) + СО2(Г) = 2СО(Г). В результате реакции возрастает количество газа, т.е. беспорядок возрастает, и энтропия должна увеличиваться.
Расчет подтвердил, что энтропия системы возрастает. 3.5. Возможность самопроизвольного прохожденияхимических реакций. Энергия ГиббсаВопрос о возможности самопроизвольного прохождения реакций относится к числу наиболее важных в химии. Опыт показывает, что при низких температурах самопроизвольно проходят преимущественно экзотермические реакции, но наблюдаются и самопроизвольные эндотермические процессы, например растворение большинства солей в воде. При повышенных температурах чаще реализуются эндотермические процессы, сопровождающиеся увеличением энтропии системы. Таким образом, наблюдаются две противоположные тенденции: 1) стремление системы перейти в состояние с наименьшей внутренней энергией (с выделением её части), характеризуется изменением энтальпии системы; 2) стремление к беспорядку, характеризуется изменением энтропии системы. Сопоставление этих двух противоположных тенденций дает возможность определить направление самопроизвольного прохождения процесса при заданных условиях. Величины в котором В системах, находящихся при постоянной температуре и давлении, самопроизвольно могут протекать процессы, сопровождающиеся уменьшением энергии Гиббса. Изменение энергии Гиббса, таким образом, характеризует направление самопроизвольного протекания процессов, в том числе химических реакций.
если G0, самопроизвольно не может идти прямая реакция; если G = 0, система находится в состоянии химического равновесия.
Решение. Рассчитываем стандартную энергию Гиббса химической реакции Оценим влияние температуры на возможность прохождения данной реакции. Если пренебречь зависимостями величин Уравнению Сравним с уравнением прямой Найдём точку пересечения прямой с осью абсцисс, т.е. температуру, при которой Построим график, из которого видно, что в интервале температур 0 – 980 К 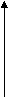 G, кДж/моль G, кДж/моль 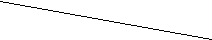 86 86 -90 980 T, K 4. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ 4.1. Скорость химических реакций Скорости и механизмы химических процессов, а также факторы, влияющие на них, изучает химическая кинетика. Существуют гомогенные (однофазные) и гетерогенные (многофазные) системы, соответственно называют и реакции, происходящие в таких системах.
Скорость химических реакций зависит от многих факторов: природы реагирующих веществ, концентрации, давления, степени дисперсности (измельчения) твёрдых веществ, температуры, присутствия катализатора.
Для немногочисленных реакций – элементарных, т.е. идущих в одну стадию, зависимость скорости элементарных химических реакций от концентрации подчиняется закону действующих масс:
Например, элементарной реакции 2NO + O2 = 2NO2 cоответствует кинетическое уравнение Если в реакции участвуют газы, то вместо концентраций можно использовать их парциальные давления. Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа:
Математически правило выражают следующим образом: 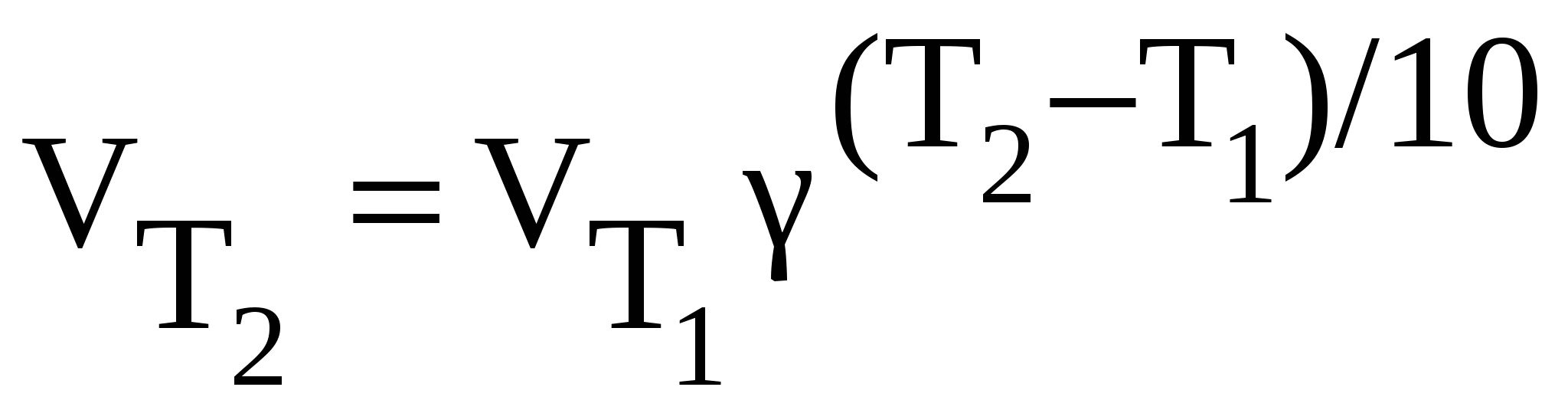 , ,где - температурный коэффициент скорости, принимающий для разных реакций значения от двух до четырех. 4.2. Химическое равновесие В природе существуют реакции практически необратимые (идущие в одном направлении) и обратимые реакции (идущие в прямом и обратном направлениях). Пример необратимой реакции: 2KClO3 = 2KCl + 3O2, обратимой реакции: 2SO2 + O2 2SO3. Большинство реакций обратимы, в уравнениях таких реакций ставят знак обратимости (стрелки в двух направлениях ). Если в какой-либо замкнутой системе может идти обратимая реакция, то наступит такой момент, когда скорости прямой и обратной реакций станут одинаковыми.
Химическое равновесие имеет динамический характер. Это означает, что количество любого вещества, расходующегося в ходе прямой реакции, равно его количеству, образующемуся в результате обратной реакции. В условиях химического равновесия концентрации всех веществ в системе не изменяются со временем, их называют равновесными концентрациями. Равновесные концентрации обозначают символом вещества в квадратных скобках: Рассмотрим состояние химического равновесия в системе H2 + I2 2HI при 450 0С, когда иод находится в парообразном состоянии. Реакцию, идущую слева направо, называют прямой, а справа налево - обратной. При химическом равновесии скорость прямой реакции равна скорости обратной реакции: После преобразования получим: 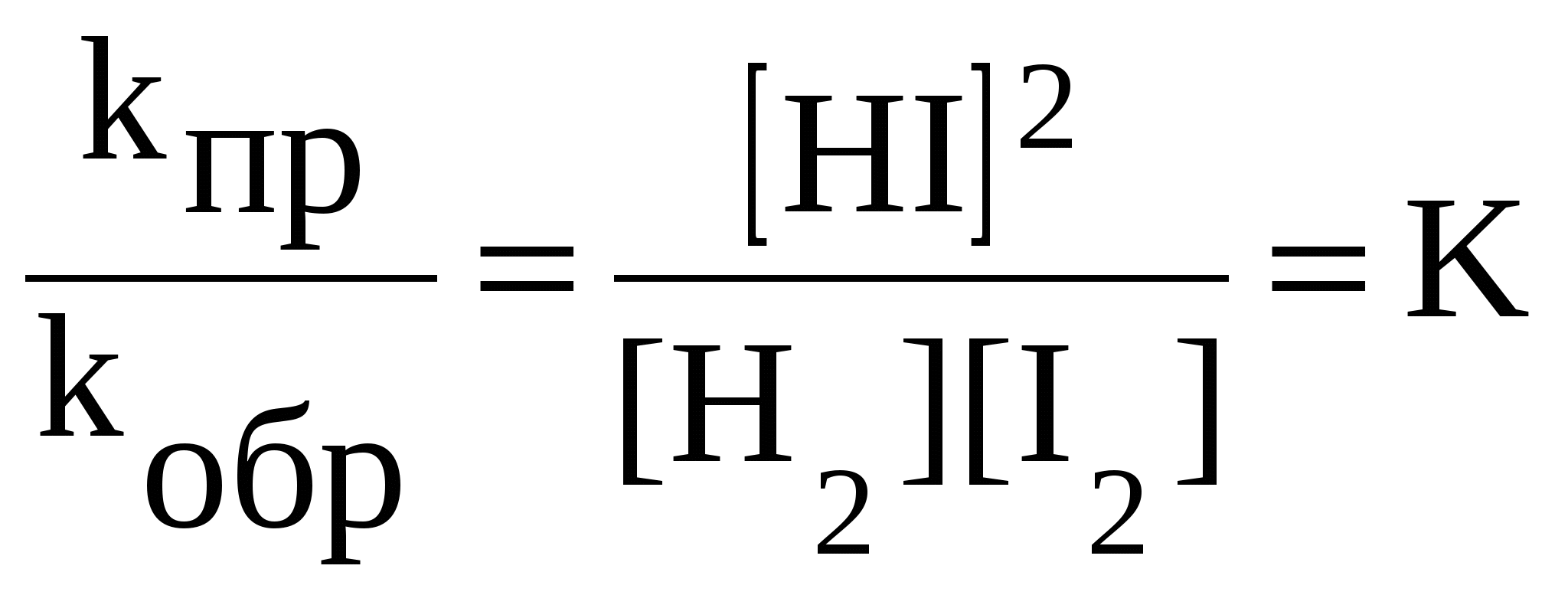 . .Постоянную величину aA + bB cC + dD |
