Конспект лекций Навои-07. Гоу впо Уральский государственный технический университет упи С. Д. Ващенко, О. А. Антропова
 Скачать 490.5 Kb. Скачать 490.5 Kb.
|
5.2. Растворы электролитов. Электролитическая диссоциация
Согласно теории электролитической диссоциации Аррениуса, в водных растворах электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы - катионы и анионы. Для количественной характеристики силы электролита используют понятие степени электролитической диссоциации (). Степень диссоциации равна отношению числа продиссоциировавших молекул (n) к общему числу растворённых молекул (N): По степени диссоциации электролиты условно делят на сильные и слабые. Принято считать сильными электролиты, для которых > 30 %, остальные можно считать слабыми.
почти все соли; некоторые неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI, HMnO4, HClO4 и другие; основания – гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
многие неорганические и большинство органических кислот – H2CO3, H2SiO3, HNO2, H3PO4, H2SO3, H2S, HF, HCN, CH3COOH и другие; основания (кроме гидроксидов щелочных и щелочноземельных металлов) и амфотерные гидроксиды. Гидроксид аммония NH4OH – также слабый электролит. Сильные электролиты в водном растворе диссоциируют практически полностью, поэтому в уравнениях диссоциации этих электролитов ставят знак равенства (=):
Слабые электролиты диссоциированы частично, уравнения диссоциации слабых электролитов пишут со знаком обратимости (). Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации – К. Значения констант диссоциации слабых электролитов при 298 К приведены в справочниках. Чем меньше константа диссоциации, тем слабее электролит: NH4OH NH4+ + OH— ; 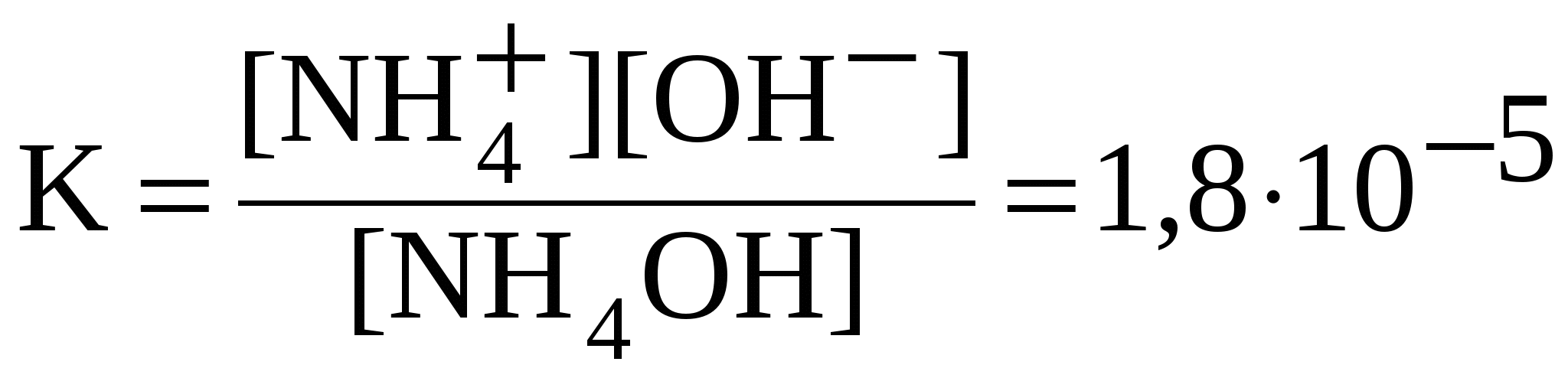 . .Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Каждую ступень равновесного состояния характеризует своя константа диссоциации. Например, при диссоциации H2CO3: 1-я ступень: H2CO3 H+ + HCO3—; 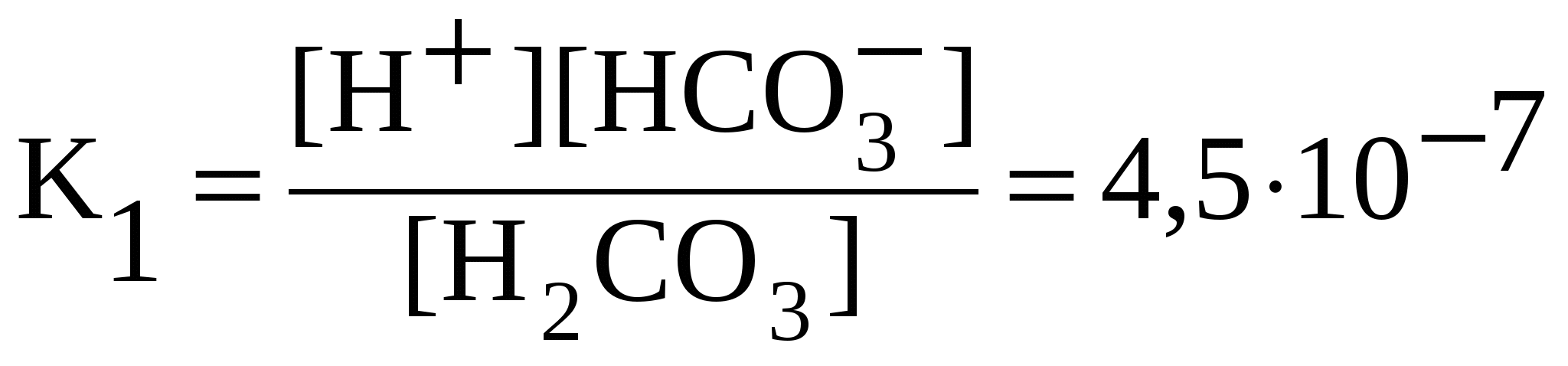 ; ;2-я ступень: HCO3 H+ + CO32—; 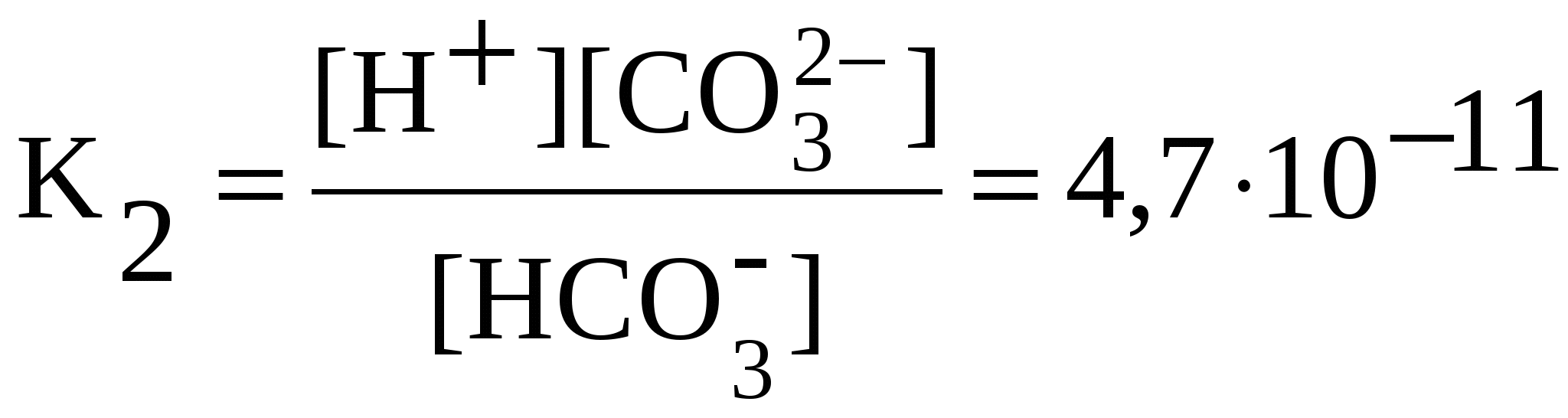 . .Диссоциация Fe(OH)2: 1-я ступень: Fe(OH)2 FeOH+ + OH —, 2-я ступень: FeOH + Fe 2+ + OH —, 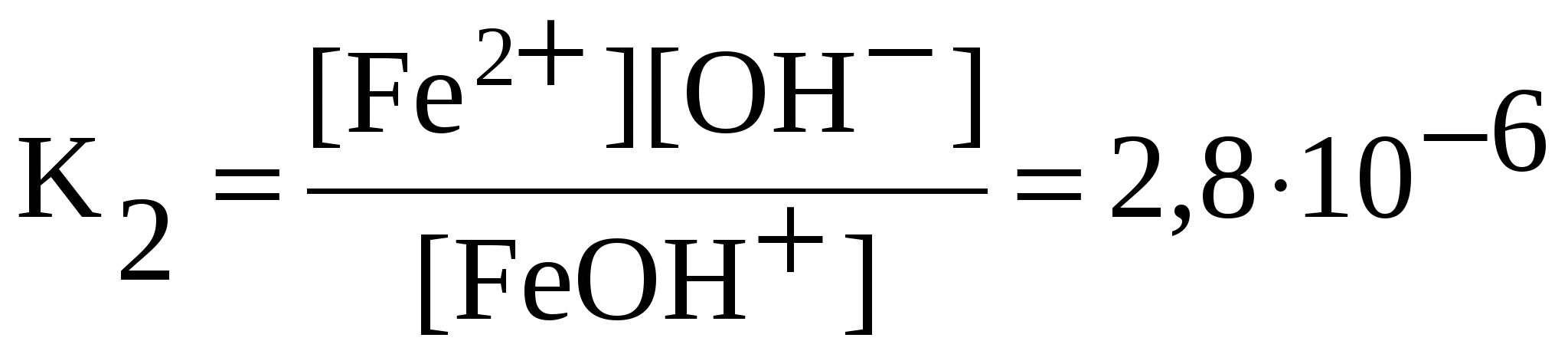 . .Амфотерные гидроксиды проявляют свойства слабых оснований и слабых кислот. Диссоциацию гидроксида Pb(OH)2 = H2PbO2 по основному типу характеризуют уравнениями Pb(OH)2 PbOH + + OH —, PbOH + Pb 2+ + OH —; по кислотному типу – уравнениями H2PbO2 H + + HPbO2 —, HPbO2— H+ + PbO22 —. 5.3. Ионные реакции в растворах электролитов Ионными реакциями (реакциями обмена) называют реакции в растворах электролитов, не сопровождающиеся изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ. Для выявления сущности процессов, происходящих при ионных реакциях, кроме молекулярных, составляют ионные уравнения реакций.
Примеры реакций обмена: с образованием малорастворимых соединений: Pb(NO3)2 + 2KI = PbI2 + 2KNO3 Pb2+ + 2NO3— + 2K+ + 2I— = PbI2 + 2K+ + 2NO3— Pb2+ + 2I— = PbI2 с образованием слабых электролитов: NaNO2 + HCl = NaCl + HNO2 Na+ + NO2— + H+ + Cl— = Na+ + Cl— + HNO2 H+ + NO2 = HNO2 H2SO4 + 2NaOH = Na2SO4 + 2H2O 2H+ + SO42— + 2Na+ + 2OH— = 2Na+ + SO42— + 2H2O H+ + OH— = H2O HCl + NH4OH = NH4Cl + H2O H+ + Cl— + NH4OH = NH4+ + Cl— + H2O H+ + NH4OH = NH4+ + H2O с образованием газообразных веществ: Na2CO3 + 2HCl = 2NaCl + СO2 + H2O 2Na+ + CO32— + 2H+ + Cl— = 2Na+ + Cl— + CO2 + H2O CO32— + 2H+ = CO2 + H2O |
