Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
РИСУНОК 1ГРАФИКИ РАСТВОРИМОСТИ СОЛЕЙ 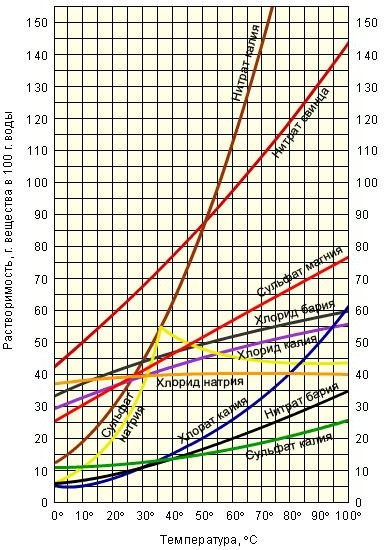 РИСУНОК 2 ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ  РИСУНОК 3 РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ НЕМЕТАЛЛОВ   1. ω(Na) = 42%, ω(P) = 19%, ω(O) = 39%; ω(K) = 56,5%, ω(C) = 8,7%, ω(O) = 34,8%; ω(Ag) = = 64%, ω(N) = 8%, ω(O) = 28%. 2. ω(K) = 15%, ω(Al) = 10%, ω(S) = 25%, ω(O) = 50%; ω(Fe) = = 32%, ω(S) = 27%, ω(O) = 41%; ω(Na) = 17%, ω(Cr) = 40%, ω(O) = 43%. 3. 30%; 82%; 30%; 15%. 4. 50%; 35%; 33%. 5. Na3PO4. 6. KMnO4. 7. HIO3. 8. 4,48 л. 9. 11,2 л; 0,7 л; 0,86 л. 10. 714 г. 11. 0,63 г; 1,58 г; 0,98 г. 12. 28 г/моль. 13. 38 г/моль. 14. 36,54 г/моль. 15. 28 г/моль. 16. 222 г/моль. 17. а) 192 г; б) 2,8 г; в) 10,95; г) 19,2 г. 18. 0,5 моль; 0,1 моль; 1,5 моль; 2 моль. 19. 18,06 · 1023 атомов; 6,02 · 1023 атомов; 1,204 · 1023 атомов; 21,07 · 1023 атомов. 20. 0,35 · 1023 молекул; 0,13 · 1023 молекул; 0,22 · 1023 молекул; 0,22 · 1023 атомов. 21. 292,5 г. 22. 53,5 г. 23. 9,2 г. 24. 1,27 г. 25. 14,49 г. 26. 17,12 г. 27. ē(Fe) = 26, n(Fe) = 30; ē(F) =9, n(F) = 10; ē(P) = 15, n(P) = 16. 28. p(Ag) = 47, n(Ag) = 61, ē(Ag) = 47; p(Au) = 79, n(Au) = 118, ē(Au) = 79; p(Pt) = 78, n(Pt) = 117, ē(Pt) = 78. 29. Ar(S) = 32. 30. Ar(Mo) = 96. 31. Mo – 5, Zr – 5, Cs – 6, Mg – 3. 32. 19K – 1 подуровеь, 41Nb – 3 подуровня, 74W – 4 подуровня. 33. Li – 2, N – 2, P – 3, K – 4. 34. 6C 1s22s22p2; 17Cl 1s22s22p63s23p5; 24Cr 1s22s22p63s23p64s13d5. 35. 16S 1s22s22p63s23p4; 30Zn 1s22s22p63s23p64s23d10; 35Br 1s22s22p63s23p64s23d104p5. 36. 25Mn 1s22s22p63s23p64s23d5. 37. 33As 1s22s22p63s23p64s23d104p3. 38. Ca + 2HCl = CaCl2 + H2↑; Ca + 2H2O = Ca(OH)2 + H2↑; Ca + H2SO4(р) = CaSO4 + H2↑; CuO + H2SO4 = CuSO4 + H2O; CuO + 2HCl = CuCl2 + H2O; CuO + H2O = Cu(OH)2. 39. 2Na + 2H2O = 2NaOH + H2↑; 2Na + ZnSO4 = Na2SO4 + Zn; 2Na + H2SO4(р) = = Na2SO4 + H2↑. 40. 2Al + 3ZnSO4 = Al2(SO4)3 + 3Zn; Fe + H2SO4(р) = FeSO4 + H2↑; 3Mg + Al2(SO4)3 = = 3MgSO4 + 2Al; Cu + HCl = нет реакции; Fe + CuSO4 = FeSO4 + Cu; Ag + CuSO4 = нет реакции; Cu + FeSO4 = нет реакции; Al + H2SO4(р) = Al2(SO4)3 + H2↑. 41. 2Ca + O2 = 2CaO; CaO + H2O = Ca(OH)2; Ca(OH)2 + CO2 = CaCO3 +H2O; CaCO3 (t) = CaO + CO2↑. 42. 4Cr + 3O2 = = 2Cr2O3; Cr2O3 + 6HCl = 2CrCl3 + 3H2O; CrCl3 + 3NaOH = Cr(OH)3↓ + 3NaCl; Cr(OH)3 + 3KOH = = K3CrO3 + 3H2O. 43. m(NaCl) = 30 г, m(H2O) = 470 г. 44. m(HCl) = 45 г, m(H2O) = 205 г. 45. 12,5%. 46. 14,9%. 47. 3%. 48. 6%. 49. 26,4%. 50. 60%. 51. 1167 г. 52. 7 кг. 53. 2Ag+ + 4 4 3 2 2 + 2Cl– = 2AgCl↓; Fe3+ + 3OH– = Fe(OH)3↓; Ba2+ + SO 2– = BaSO ↓; CO 2– + 2H+ = H O + CO ↑. 54. FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl; HCl + NaOH = NaCl + H2O; 2HCl + Na2CO3 = 2NaCl + + H2CO3; BaCl2 + H2SO4 + BaSO4 + 2HCl. 55. NO2– + H2O = HNO2 + OH–, pH>7, среда щелочная. KBr гидролизу не подвергается. S2– + H2O = HS– + OH–. pH>7, среда щелочная. 3 3 4 56. MgSO4 гидролизу не подвергается. SO32– + H2O = HSO3– + OH–. pH>7, среда щелочная. NH4+ + H2O = NH4OH + H+–. pH<7, среда кислая. 57. а) MnO2 – окислительно- восстановительные свойства, KMnO4 – окислительные свойства, P2O5 – окислительные свойства, Na2S – восстановительные свойства; б) K2SO3 – окислительно-восстановительные свойства, HNO3 – окислительные свойства, H2S – восстановительные свойства, NO2 – окислительно-восстановительные свойства; в) Cr – восстановительные свойства, Na2CrO4 – окислительные свойства, K3CrO3 – окислительно-восстановительные свойства, K2Cr2O7 – окислительные свойства; г) NH3 –восстановительные свойства, KClO2 – окислительно- восстановительные свойства, N2 – окислительно-восстановительные свойства, KNO3 – окислительные свойства, K2MnO4 – окислительно-восстановительные свойства. 58. а) NH3 – 3ē→ N0 – окисление, NO −+ 8ē → NH – восстановление, S2– – 2ē→ → S0 – окисление, SO 2− + + 6ē → S0 – восстановление; б) Mn2+ – 4ē → MnO42− – окисление, MnO 2− – 1ē → MnO − – 4 4 4 2 окисление, MnO − + 7ē → Mn0 – восстановление, Mn0 – 4ē → MnO – окисление; 4 4 в) Cr2O72− + 3ē → Cr3+ – восстановление, Cr3+ + 3ē → Cr0 – восстановление; Cl0 – 7ē → → ClO − – окисление, ClO − + 6ē → ClO− – восстановление, ClO− + 2ē → Cl− – восстановление, Cl− – 1ē → 3 →Cl0 – окисление. 59. а) 5Na2SO3 + 2KIO3 + H2SO4 = 5Na2SO4 + I2 + K2SO4 + H2O, IO – – окислитель, SO 2– – восстановитель; б) 2CrCl + 3H O + 10NaOH = 2Na CrO + 6NaCl + + 8H O, 3 3 2 2 2 4 2 Cr3+ – восстановитель, H2O2 – окислитель; в) 2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 2PbSO4 + + 3Pb(NO3)2 + 2H2O, Mn2+ – восстановитель, PbO2 – окислитель; г) K2Cr2O7 + 3K2S + 7H2SO4 = = 4K2SO4 + Cr2(SO4)3 + 3S + 7H2O, Cr2O72– – окислитель, S2– – восстановитель. 60. v = = k[H2][Cl2]; а) увеличится в 2 раза; б) уменьшится в 3 раза; в) увеличится в 4 раза. 61. v = = k[CH4][O2]2; а) увеличится в 2 раза; б) увеличится в 4 раза; в) уменьшится в 8 раз. 62. В 100 раз. 63. В 105 раз. 64. γ = 4,13. 65. а) Кр = ([H2O]2) / ([H2]2[O2]); б) Кр = ([SO3]2) / ([SO2]2[O2]); в) Кр = = ([NO]2[O2]) / ([NO2]2). 66. а) Кр = [CO]2 / [CO2]; б) Кр = [H2]4 / [H2O]4); в) Кр = [CH4] / [H2]2. а) равновесие системы сместится вправо; б) равновесие системы сместится вправо. а) равновесие системы сместится влево; б) равновесие системы сместится влево. а) равновесие системы сместится вправо; б) равновесие системы сместится влево; в) равновесие системы сместится вправо. 70. а) равновесие системы сместится вправо; б) равновесие системы сместится вправо; в) равновесие системы не смещается. 71. 9281 кДж; 4641 кДж. 72. 2156 кДж и 1643 кДж; 3450 кДж и 1190 кДж.  § 1. Вещества, превращения, закономерности, элементы – предмет изучения химии. § 2. Твёрдый, жидкий, газообразный. § 3. Магний. § 4. 1. Вещества. 2. Элемент. 3. Ион. 4. Молекула. Ответ: Атом. § 5. 1. Вольфрам. 2. Магний. 3. Калий. 4. Селен. 5. Никель. 6. Кремний. 7. Натрий. Серебро. 9. Сурьма. 10. Ртуть. 11. Кальций. Ответ:Валентность. § 6. 1. Бор. 2. Марганец. 3. Углерод. 4. Кальций. 5. Гелий. 6. Алюминий. 7. Литий. 8. Сурьма. Фосфор. Ответ: Берцелиус. § 7. По горизонтали: 1. Относительная. 2. Молекулярная. 3. Атом. 4. Атомная. По вертикали: 5. Молекула. 6. Молярная. § 8. 40. § 9. Сумма атомов каждого элемента до реакции должна равняться сумме атомов каждого элемента после реакции. § 10. По горизонтали: 1. Символ. 2. Порядковый. 3. Период. 4. Группа. 5. Ряд. 6. Атомная масса. По вертикали: 7. Главная. 8. Система. 9. Побочная. 10. Название. Ответ: Подгруппа. § 11. По горизонтали: 1. Атом. 2. Спин. 3. Ковалентная. 4. Протон. 5. Главная. 6. Анион. По вертикали: 1. Изотопы. 2. Металлическая. 3. Ионная. 4. Орбиталь. 5. Катион. § 12. Путь по лабиринту: Да, да, да, да, нет, да, нет, да. § 13. а) K, Na, Li, Rb, Ag, Cs, Fr, H, Au. б) Al, Cl, Na, Mg, S, Si, P, Ar. в) Al, K, Na, Mg, Li, Rb, Cs, Fr, H, Ca, Zn. § 14. Сера, селен, сурьма, скандий, самарий, стронций, олово, кремний; неон, никель, натрий, ниобий, неодим, нобелий, нептуний, азот. § 15. Валентность – это число неспаренных электронов атома в устойчивом или возбуждённом состоянии, которые принимают участие в образовании общих электронных пар с электронами других атомов. § 16. 1. Да. 2. Нет. 3. Да. 4. Да. 5. Да. 6. Нет. 7. Нет. 8. Да. 9. Нет. 10. Да. 11. Да. 12. Нет. 13. Да. 14. Да. § 17. Ребус: Оксид железа (III). § 18. 1. Кадмий. 2. Вольфрам. 3. Ртуть. 4. Ванадий. 5.Магний. 6. Кальций. 7. Бериллий. 8. Никель. 9. Стронций. 10. Цинк. Ответ: Двухвалентные. § 19. Кислоты – это сложные соединения, которые состоят из атомов водовода и кислотного остатка. § 20. По горизонтали: 1. Фосфаты. 2. Сульфиды. 3. Карбонаты. 4. Бромиды. 5. Сульфиты. По вертикали: 6. Нитраты. 7. Хлориды. 8. Сульфаты. 9. Нитриты. § 21.Оксиды: H2O, K2O, N2O3, MgO, CO2. Кислоты: H3PO4, HNO3, H2SO4, H2CO3. § 22. Растворимость – это способность вещества растворяться в растворителях. § 23. 1. Иодиды. 2. Сульфиды. 3. Нитраты. 4. Карбонаты. 5. Фосфаты. 6. Нитриты. 7. Бромиды. § 24. 1. Продукты. 2. Физические. 3. Реагенты. 4. Индексы. 5. Коэффициент. 6. Химические. 7. Химия. Ответ: Реакция. § 25. 1. Экзотермические. 2. Эндотермические. 3. Дельта-аш. 4. Эффект. 5. Разница. 6. Килоджоуль. 7. Энергия. Ответ: Реакция. § 26. 1. Свинец. 2. Гелий. 3. Золото. 4. Мышьяк. 5. Цинк. 6. Натрий. Ответ: Элемент. § 27. 1. Разложения. 2. Замещения. 3. Обмена. 4. Эндотермические. 5. Необратимые. 6. Соединения. Ответ: Ломоносов. § 28. По горизонтали: 1. Напряжение. 2. Ток. По вертикали: 1. Фарадей. 2. Электролиз. 3. Коррозия. § 29. 1. Кислород. 2. Золото. 3. Бронза. 4. Олово. 5. Железо. 6. Ингибитор. 7. Химия. Ответ: Коррозия. § 30. 1. Нет; 2. Да; 3. Нет; 4. Нет; 5. Да; 6. Да; 7. Да; 8. Нет; 9. Да; 10. Нет. § 31. 1. Неорганическая. 2. Аналитическая. 3. Биологическая. 4. Органическая. 5. Космическая. 6. Физическая. § 32. Воронка, штатив, пипетка. |
