|
|
Л 7-8_ ХИМИЯ НЕФТИ И ГАЗА. Химия нефти и газа л. 78 Методы разделения и концентрирования компонентов нефти
Л. 8 Методы разделения и концентрирования компонентов нефти. Абсорбция, адсорбция и экстракция. Термодиффузия и диффузия через мембраны. Методы разделения нефти по группам веществ. Химические методы выделения веществ.
Явление диффузии и его использование в нефтяном анализе.
Диффузия – перенос вещества, как результат выравнивания его концентрации в первоначально неоднородных системах. Диффузия происходит вследствие теплового движения атомов и молекул. В результате диффузии происходит самопроизвольное взаимное проникновение друг в друга соприкасающихся веществ.
Мерой оценки величины (интенсивности) диффузии является диффузионный поток.
Количество вещества, переходящее в единицу времени через единицу площади поверхности, перпендикулярной направлению переноса, называется диффузионным потоком.
Если в системе имеется градиент концентрации некоторого вещества в направлении х
dc/dx ,
то диффузионный поток I определяется соотношением, называемым первым законом Фика:
I = -Ddc/dx ,
где D – коэффициент диффузии. Минус указывает на направление потока от больших концентраций к меньшим. Величина коэффициета D зависит от массы и размера диффундирующих молекул, от состава системы, от температуры и давления и практически не зависит от концентрации.
Если в системе происходит выравнивание концентраций n-компонентов, диффузионный поток каждого зависит от градиента концентраций всех остальных компонентов.
Наиболее интенсивна диффузия в газах (D
10-4 м2\с). В жидкостях D
10-9 м2\с, в твердых телах D
10-12 м2\с диффузия гораздо слабее.
Явление диффузии эффективно используется при разделении компонентов нефти или газа.
Наиболее развита техника разделения диффузией через мембраны и термодиффузия.
Диффузия через мембраны.
Мембраны – непористые полимерные перегородки, через которые УВ способны диффундировать.
Разделение на мембранах основано на различии форм и размеров разделяющихся молекул, а также на их растворимости в материале мембраны.
Перенос вещества через непористые мембраны включает стадии сорбции, диффузии и десорбции с противоположной стороны мембраны.
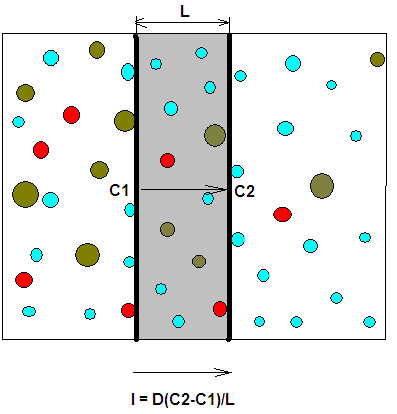
Скорость переноса определяется самой медленной стадией процесса – диффузией и выражается первым законом Фика (см рис.), где С1 и С2 – концентрации компонента на граничных поверхностях мембраны.
Обычно диффузией через мембраны разделяют газовые смеси. Для газовых смесей закон Фика принимает немного другую форму, так как для газов выполняется закон Генри С = σP :
I = Dσ(P2 – P1)/L, ,
где, σ – коэффициент растворимости газа в материале мембраны
Высокой проницаемостью через мембраны обладают молекулы с малым поперечным сечением и хорошо растворимые в материале мембраны.
Мембранные процессы применяют для:
- выделения водорода из водородсодержащих газов
- для удаления H2S, СО2 из горючих газов
Основное препятствие для широкого использования мембран – малый срок службы в агрессивных средах и низкая селективность процесса разделения. Имеющиеся на сегодня полимеры способны концентрировать вещества, но полного отделения пока не удается достичь. Перспективы в этой области зависят от синтеза полимеров для более высокоселективных и стабильных мембран.
Термодиффузия.
Явление термодиффузии было открыто Людвигом К. в 1856 г. и состоит в том, что если к смеси, состоящей из нескольких компонентов, приложить температурный градиент, возникает градиент концентраций.
Полноценной теории термодиффузионного процесса не существует. Эмпирически (из эксперимента) установлено, вблизи холодной стенки сосуда концентрируются: 1)углеводороды более высокомолекулярные и более высококипящие; 2) с наименьшим молярным объемом, то есть более компактные молекулы.
Термодиффузионный аппарат представляет собой два цилиндра, вставленных друг в друга с зазором между ними 0,25-3,0 мм. Разделяемая смесь помещается в пространство между цилиндрами, один из которых нагревают, другой – охлаждают.
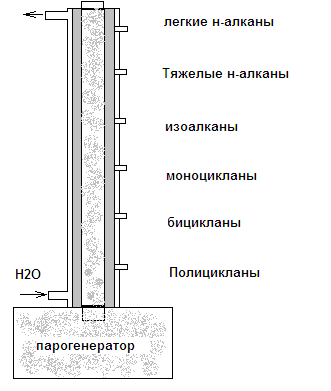
Молекулы одних веществ перемещаются к холодной стенке и в результате конвекции опускаются вниз, а молекулы других направляются к горячей стенке и концентрируются в верхней части колонки.
Термодиффузия не отделяет насыщенные УВ от ароматических, нет деления также по молекулярной массе. Основной фактор деления – это плотность молекул и молекулярный объем.
Существенное влияние на термодиффузионное разделение оказывает вязкость компонентов. Чем менее вязкий образец, тем легче дифференцируются вещества, быстрее устанавливается равновесие.
На эффективность разделения влияют также 1. параметры процесса и 2. конструкция аппарата:
температурный градиент, длительность процесса, концентрация компонентов
зазор, длина рабочего пространства
Раньше термодиффузионные планировалось использовать в промышленности для разделения алканов и циклоалканов, но из-за малой производительности колонн в настоящее время практически не используются.
В ИХН в Томске имеется и используется для исследовательских целей при изучении смолистых компонентов нефти и тяжелых углеводородов.
Сорбционные процессы разделения компонентов нефти.
Для разделения сложных смесей веществ по групповому признаку применяют ряд методов селективных к группам веществ, такие как экстракция и адсорбция.
Общим для этих методов является то, что используются селективные растворители или твердые вещества, у которых энергия взаимодействия с разделяемыми веществами различна.
Как происходит процесс сорбции в статических условиях?
Предположим, что в замкнутом сосуде находится некоторое количество сорбента и растворитель. Если внести в систему растворимый в растворителе сорбат, так чтобы концентрация была С0, то начнется уменьшение этой концентрации за счет поглощения сорбата из раствора сорбентом. Через некоторое время изменение концентрации прекратится и установится сорбционное равновесие концентрации сорбата в растворе С и концентрации его на сорбенте Сс. В области малых концентраций (абсолютные растворы) это соотношение имеет линейный вид и описывается законом Генри:
Сс = КС
Концентрации С и Сс при этом выражают в мг/см3 или мкмоль/см3. Тогда коэффициент Генри (коэффициент распределения) безразмерная величина и зависит от природы сорбента, сорбата, растворителя и температуры.
Закон Генри выполняется только для истинных растворов. При высоких концентрациях молекулы сорбата начинают взаимодействовать не только с растворителем и адсорбентом, но и друг с другом. И уравнение Сс = КС принимает нелинейную форму Сс = f(С), вид которой устанавливают из специальных экспериментов.
Процесс адсорбции – это всегда динамический процесс. Когда мы говорим, что установилось сорбционное равновесие, это не значит, что часть молекул всегда находится в газовой или жидкой фазе, а часть в сорбированном состоянии. На деле между сорбированными и «свободными» молекулами все время происходит обмен. То есть молекулы часть времени ta находятся в сорбированном, а часть td – в свободном состоянии. Чем больше ta, тем сильнее сорбция. Отношение этих величин пропорционально концентрации сорбата в объеме системы:
ta/td = Масса сорбата на сорбенте в 1 см3 слоя\Масса сорбата в растворе в 1 см3 слоя
Здеси именно количество вещества в 1 см3 слоя, а не равновесные концентрации Сс и С.
Это отношение есть частный коэффициент Генри, который индивидуален для каждого вещества и позволяет оценить его сорбционную активность.
Сорбция – поглощение газов, паров или растворенных веществ твердыми или жидкими поглотителями. Поглощаемые вещества - сорбаты, а поглотители – сорбенты.
Если сорбат поглощается всем объемом сорбента, то процесс называется абсорбцией, а поглотитель – абсорбент. Если сорбат концентрируется на поверхности поглотителя, то процесс называется адсорбцией, а поглотитель – адсорбент.
Адсорбенты чаще всего твердые тела – силикагели, алюмогели, молекулярные сита (цеолиты), активные угли, пористые полимеры.
Абсорбенты – жидкости или газы.
Рассмотрим природу сорбционных сил.
Силы взаимодействия между сорбатом и сорбентом можно назвать физическими или ван-дер-ваальсовыми. Это те же силы, которые проявляются в жидкостях, удерживая их молекулы друг возле друга или в некоторых твердых, так называемых молекулярных кристаллах, например твердой углекислоте.
Силы взаимодействия в сорбции сводятся к:
- ориентационным
- индукционным
- дисперсионным и
- специфическим.
Ориентационное взаимодействие.
Атомы – электронейтральные частицы и не обладают дипольным моментом, так как центры их положительных и отрицательных зарядов совпадают. В некоторых молекулах, составленых из разных атомов всегда имеется постоянный дипольный момент, то есть центры их положительных и отрицательных зарядов смещены друг относительно друга, хотя в целом молекула электронейтральна. Такие молекулы называют полярными.

При растворении полярных сорбатов в полярных абсорбентах противоположно заряженные концы диполей ориентируются за счет электростатических сил друг относительно друга, что и является ориентационным взаимодействием.

Рассматривая ориетационное взаимодействие становится понятным классическое правило химии подобное растворяется в подобном.
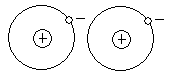
Некоторые адсорбенты несут на поверхности локально сконцентрированный заряд. Взаимодействие такого локально сконцентрированного заряда с одним из концов диполя также приводит к ориентационному эффекту (см. рис.).
Индукционное взаимодействие.
Некоторые неполярные молекулы под влиянием дипольных моментов абсорбента или локальных зарядов адсорбента способны деформироваться с образованием наведенного дипольного момента. Взаимодействие наведенного диполя с полярной молекулой называют индукционным. Оно составляет 5-7 % от общей энергии взаимодействия и вносит определенный вклад в адсорбционное (хроматографическое) разделение.
Дисперсионное взаимодействие наиболее универсальное. Оно проявляется как между полярными так и неполярными молекулами.
 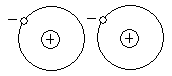
При вращении электрона вокруг атома, в в какойто момент времени положение электрона оказывается смещенным по отношению к протону и весь атом приобретает мгновенный дипольный момент. При сближении атомов возникает синхронизация в движении электронов и мгновенные диполи начинают взаимодействовать.
Дисперсионное взаимодействие является главным при растворении или адсорбции неполярных веществ на неполярных сорбентах (углеродные сорбенты).
Специфические взаимодействия.
К специфическим относят донорно-акцепторные (координационные) взаимодействия и как частный случай таких взаимодействий - водородную связь.
Такое взаимодействие возникает когда электронная пара с полностью заполненной орбитали атома-донора передается на вакантную орбиталь атома акцептора. При этом образуется общая связывающая молекулярная орбиталь.
Образующаяся координационная связь очень похожа на ковалентную, отличие только в том, что в ковалентная связь образуется из неспаренных электронов обоих атомов, а в координационной – электронная пара поставляется одним атомом – лигандом.
Например, если водород образует химическую связь с электроотрицательными атомами фтора, кислорода, азота, то электроны оттягиваются от водорода так сильно, что его орбитали практически пустеют, а он становится сильно электроположительным. Если молекула, имеющая такие атомы водорода, сближается с молекулой, имеющей атом с неподеленной электронной парой, то между ними устанавливается водородная связь.
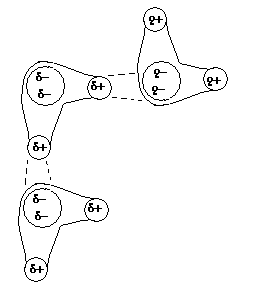
Водородные связи способны образовывать молекулы воды, органических кислот, спиртов, аминов. Из адсорбентов водородные связи могут образовывать кремнеземы (силикагель, диатомиты, пористые стекла).
Специфические взаимодействия могут происходить между полярными и неполярными молекулами. Главное, чтобы имелись подвижные электронные пары и свободные электронные орбитали. Например ароматические углеводороды способны специфически взаимодействовать с адсорбентами, имеющими на поверхности локализованные электрические заряды.
Статические сорбционные процессы сравнительно слабо применяются в исследовании нефтей. Но можно решить ряд сложных задач разделения и концентрирования некоторых групп веществ.
Например на сорбентах неоднородной пористости можно сконцентрировать полярные вещества нефти – арены и гетероатомные компоненты. К таким адсорбентам относятся оксиды кремния SiO2, а также оксиды щелочных и щелочноземельных элементов (наиболее широко используются Al2O3 , Fe2O3 или их смеси). Главное их свойство - поверхность у них имеет заряд, адсорбция идет по принципу ориентационного взаимодействия. Фильтрация молекул через такие сорбенты не идет, то есть они неоднородной пористости (встречаются поры мелкие и крупные), главное, чтобы была достаточно развита поверхность адсорбции. И нужная полярность, которую регулируют добавляя к адсорбенту воду.
Силикагели – гель кремниевой кислоты. Это основной сорбент для жидкостно-адсорбционной хроматографии и лучший для разделения смесей нефтяных углеводородов и нефтяных смолистых веществ. Выпускаются крупнопористые и мелкопористые силикагели различных марок АСКГ, КСМГ, КСКГ (2,8-7,0 мм), МСМК (0,25-2,0 мм) . Для колоночной хроматографии нефтей подходят силикагели с размером частиц 100-250 мкм.
На поверхности силикагелей имеются силанольные и силоксановые группы, и три слоя сорбированной воды за счет которых и обеспечивается его разнообразная адсорбционная активность.
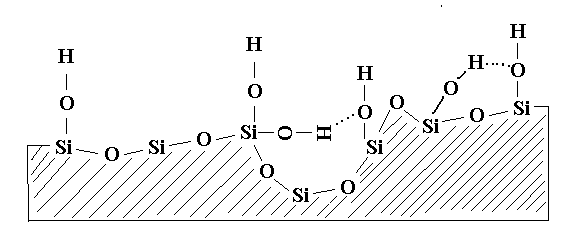
Состояние водных слоев на поверхности силикагеля:
Верхний слой слабо сорбированной воды, удаляется при 18-700С сухим растворителем.
Средний слой слабо сорбированной воды, удаляется при 100-1200С сухим растворителем.
Нижний слой сильно сорбированной воды, удаляется прокаливанием при 200-6500С.
Контролируя количество воды на поверхности сорбента можно контролировать его адсорбционную активность.
Оксид алюминия. Тоже часто применяемый адсорбент для разделения нефтяных веществ. Причем хорошо разделяет как полярные молекулы, так и неполярные. Это свойство оксида алюминия объясняется его амфотерным характером. Так жк как у силикагелей активность оксида алюминия зависит от его влагосодержания. Наиболее активная форма – безводная, увлажняя разнам количеством воды можно получить набор адсорбентов с разной емкостью. Для разделения нефтей подходит дезактивированная 10% воды.
В зависимости от содержания воды различают 6 степеней активности оксида алюминия:
Наивысшая I-я по Брокману – 2-3 % воды
II-я по Брокману – 5-7,5 % воды и т.д.

Неполярные вещества нефти – алканы, циклоалканы, изоалканы – разделяют с помощью неполярных сорбентов, например, активированных углей.
Активированные угли – это неполярные сорбенты. Удельная поверхность составляет 1000-1700 м2/г, поэтому силы взаимодействия углей с молекулами разделяемых веществ очень велики. Область их применения ограничивается разделением газов.
Есть и селективные адсорбенты с помощью которых можно выделить из нефти молекулы строго определенного размера – это цеолиты.
Молекулярные сита. К молекулярным ситам относят обычно цеолиты – пористые кристаллы природных или синтетических алюмосиликатов кальция, натрия и некоторых др. металлов. Поры их кристалов имеют размеры, близкие к размерам молекул жидких или газообразных веществ. Те вещества, которые могут проникнуть в поры цеолитов, сорбируются в кристаллах цеолитов, более крупные молекулы не сорбируются. Так как цеолиты выпускаются с разным размером пор, есть возможность очень четкого разделения разных веществ.
Особенностью молекулярных сит, отличающей их от других типов сорбентов, является строгая однородность структуры и размеров пор.
Механизм прохождения молекул через окна пор цеолитов сложный много фазный процесс. Здесь одновременно проявляются силы притяжения и отталкивания молекул, значительно влияет строение молекул. Так молекулярные сита с расмером «окон» около 5 А хорошо сорбируют парафиновые УВ нормального строения, а разветвленные молекулы не сорбируются.
Недостатком цеолитов как адсорбентов является их высокая влагоемкость и способность взаимодействовать с кислотами с потерей адсорбционной способности. Некоторые вещества сорбируются в порах безвозвратно. Поэтому область их применения ограничена.
Также известны эти методы как методы удаления нефтяных компонентов из природных смесей веществ. Например, при техногенном нефтяном загрязнении экосистем метод статической адсорбции углеводородов может быть применен для связывания, изолирования и удаления нефтяного загрязнения. |
|
|
 Скачать 399 Kb.
Скачать 399 Kb.