I. Общая характеристика биоэлементов Классификация и топография элементов
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
Раздел IV. Биогенные элементы s-семействаТема I . s–Элементы I и II групп: литий, натрий, калий, магний, кальций, стронций, барий 1. Биологическая роль s-элементов I и II групп По содержанию в организме человека Na, K, Mg, Ca относятся к макроэлементам, Li – к микроэлементам. Литий. По содержанию в организме человека (10-4%) литий относится к микроэлементам. Он концентрируется в лимфоузлах, легких, печени, головном мозге, в мышцах. Биологическая роль лития выяснена недостаточно. Имеются сведения, что литий способствует высвобождению ионов магния и тормозит передачу нервных импульсов, снижая этим возбудимость центральной нервной системы. Установлено, что литий влияет на нейроэндокринные процессы, жировой и углеводный обмен. Синергистом лития является натрий. Натрий. В организме человека содержится около 60 г (0,08%) натрия. Из этого количества 44% приходится во внеклеточной жидкости и 9% – во внутриклеточной. Остальное – в костной ткани, в сыворотке крови, спинно-мозговой, глазной жидкостях, пищеварительных соках, желчи, почках, легких, мозге. Ионы натрия играют важную роль в обеспечении постоянства внутренней среды организма, участвуют в поддержании постоянного осмотического давления биожидкостей (осмотический гомеостаз). Фосфатная буферная система (Nа2НРО4–NaH2PO4) обеспечивает кислотно-основное равновесие. Ионы Nа+ участвуют в регуляции водного обмена и влияют на работу ферментов. Вместе с ионами К+, Mg2+и Са2+ ионы Na+ участвуют в передаче нервных импульсов через мембраны нервных клеток и поддерживают нормальную возбудимость мышечных клеток. NаС1 – основной источник соляной кислоты для желудочного сока. В организме натрий поступает в основном в виде поваренной соли, ежедневная потребность – 1 г, хотя среднее потребление достигает 4-7 г. Избыточное потребление NаС1 способствует появлению гипертонии. Концентрация ионов Nа+ внутри клетки в 15 раз меньше, чем во внеклеточной жидкости, а концентрация ионов К+ в 35 раз выше внутри клетки, чем вне её. Чтобы поддержать такое распределение, ионы Nа+ и К+ должны непрерывно перемещаться, что обеспечивается работой натрий-калиевых насосов. Эти насосы, обеспечивающие перенос ионов через плазматическую мембрану против градиента концентрации, требуют большой затраты энергии. Поэтому перенос ионов Nа+ и К+ через клеточные мембраны сопряжен с экзоэргонической реакцией гидролиза АТФ. Натрий-калиевый градиент обусловливает возникновение разности потенциалов на клеточной мембране. 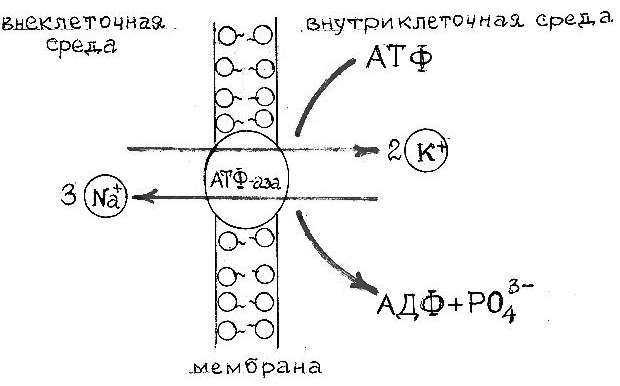 Рис. 1. Схема действия ионов Na+, K+ – АТФ-азы и возникновения разности потенциалов на клеточных мембранах За счет энергии гидролиза одной молекулы АТФ три иона Nа+ выводятся из клетки, а два иона К+ поступают внутрь клетки (рисунок 2). Такой дисбаланс электрических зарядов и служит причиной возникновения разности потенциалов на мембране, в частности, нервных волокнах. Калий. В организме человека содержится 160 г (0,23%) калия. Калий –основной внутриклеточный катион (2/3 от общего количества активных клеточных катионов). Из общего количества калия – 98% находится внутри клеток; 2%– во внеклеточной жидкости. Его топография – печень, почки, сердце, костная ткань, мышцы, кровь, мозг и т.д. Ионы К+ играют важную роль в физиологических процессах, сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, обменных реакциях. Ионы калия – важные активаторы ферментов, находящихся внутри клеток. Ионы Nа+ и К+ принимают участие в биокатализе, образуя смешанные комплексы типа фермент–катион–субстрат. Калий образует комплексы с ферментами и субстратами, что играет важную роль в транспорте ионов. Как уже отмечалось, антибиотик валиномицин избирательно взаимодействует с ионом К+, образуя прочный комплекс (с ионами натрия в очень незначительной степени). В связи с этим, валиномицин можно рассматривать как биологическую модель переносчика ионов К+ через плазматические мембраны в клетку. С пищей обычно потребляется 2-3 г калия в сутки. При калиевом истощении применяют КСl. Магний. В организме человека содержится около 20 г (0,027%) магния. В наибольшей степени магний концентрируется в дентине и эмали зубов, костной ткани, поджелудочной железе, скелетных мышцах, почках, мозге, печени и сердце. Концентрация ионов Мg2+ внутри клеток в 2,5-3 раза выше, чем во внеклеточных жидкостях. Имея меньший радиус иона и, соответственно, больший ионный потенциал, ион Мg2+ образует более прочные связи с биолигандами, чем ион Са2+, поэтому является более активным катализатором ферментативных процессов. Ион Мg2+ входит в состав различных ферментативных систем, являясь активатором и незаменимым компонентом (в карбоксипептидазу, холинэстеразу и др.) Только избыток ионов Мg2+ может обеспечить гидролиз АТФ, сопряженный с рядом ферментативных реакций, образует гидрофостфат-ион HPO42- с выделением большого количества энергии. Кальций. Общее содержание кальция в организме 1,4%. Основная масса кальция находится в костной и зубной тканях. Ионы Са2+ принимают участие в передаче нервных импульсов, сокращении мышц и регулировании работы сердечной мышцы. Кальций практически не используется внутри клетки, он выступает в качестве строительного материала в организме. В костях и зубах он находится в виде нерастворимого гидроксоапатита – Са5(РО4)3(ОН). Минеральную основу зубных тканей (дентина) составляют также фтор-апатит Са5(РО4)3F и хлорапатит Са5(РО4)3Cl. Стронций. Общее содержание стронция в организме человека 10-3%. Находится он главным образом в костной ткани, частично замещая кальций. Играет важную роль в процессах остеогенеза. Барий. По содержанию в организме человека (10-5%) относится к примесным элементам. Он накапливается преимущественно в сетчатке глаза. Барий является токсичным для организма. Он оказывает нейротоксическое, кардиотоксическое и гемотоксическое действие. Механизм токсического действия ионов бария заключается в том, что они, имея одинаковый радиус с ионами калия, конкурируют с ними в биохимических процессах и замещают их, что приводит к гипокалиемии. 2. Лечебное действие неорганических соединений s-элементов I и II групп. Применение неорганических соединений s-элементов I и II групп в медицине и фармации Litii сarbonas (лития карбонат) Li2CO3. Соли лития предложены давно для лечения подагры и растворения почечных камней. Установлено, что препараты лития обладают способностью купировать острое маниакальное возбуждение у психически больных. Дозы Li2CO3 устанавливаются индивидуально, постоянно проводя лабораторные исследования содержания лития в сыворотке крови. Во время лечения карбонатом лития возможно временное увеличение массы тела и формирование зоба, возможны нарушения функции почек, увеличение концентрации лития в крови. Выпускают Li2CO3 в форме таблеток, покрытых оболочкой по 0,3 г. Natrii chloridum (натрия хлорид) NaCl. Натрия хлорид содержится в крови и в тканях, жидкостях организма. В крови массовая доля NaCl равна 0,5%, его содержанием обеспечивается постоянство осмотического давления крови. Изотонический (физиологический) раствор для инъекций – Solutio Natrii сhloridum isotonica pro injectionibus – водный раствор натрия хлорида 0,9%. Его вводят под кожу, внутривенно при больших потерях жидкостей и при интоксикациях. Условное название «физиологический» – он получил в связи с тем, что его раствор изотоничен плазме крови человека. Его применяют для растворения различных лекарственных препаратов и для капельных вливаний. Гипертонические растворы натрия хлорида (3-5-10%) – применяют наружно в виде компрессов и примочек при лечении гнойных ран. Введение этих растворов под кожу не допускается, т.к. вызывает некроз тканей. Kalii chloridum (калия хлорид) KCl. Применяется как источник ионов калия при гипокалиемии и как антиаритмическое средство, оказывает умеренное диуретическое действие. Внутрь назначают по 1 г, или внутривенно 4% растворы. Magnesii_peroxydum'>Magnesii oxydum (магния окись) MgO. Применяется как антацидное средство, нейтрализует соляную кислоту желудочного сока: MgO + 2HC1 ® MgCl2 + H2O В отличие от NaHCO3 антацидное действие MgO не сопровождается вторичной гиперсекрецией. Образующийся MgCl2, переходя в кишечник, оказывает послабляющий эффект. Магния окись (MgO) входит в состав комбинированного препарата альмагель. Magnesii sulfas (магния сульфат) MgSO4∙7Н2О. Магния сульфат при парентеральном применении оказывает успокаивающее действие на центральную нервную систему. В зависимости от дозы наблюдаются различные эффекты лечебного действия, такие как седативный, снотворный или наркотический. Магния сульфат как наркотическое средство не применяется, так как при малейшей передозировке легко вызывают паралич дыхательного центра. Он оказывает также желчегонное действие, что связано с рефлекторным раздражением нервных окончаний слизистой оболочки двенадцатиперстной кишки. Таким образом сульфат магния применяют в качестве противосудорожного, спазмолитического и слабительного средства. Magnesii peroxydum (магния перекись) – смесь MgO (85%) и MgO2 (15%). Применяют при диспепсии, брожении в кишечнике, поносах. Лечебный эффект частично связан с действием MgO и частично – с образованием Н2О2 в желудке: MgO2 + 2HCl ® MgCl2 + H2O2 Magnesii subcarbonas (магния карбонат основной) Mg(OH)2∙4MgCO3∙H2O. Применяют наружно как присыпку, внутрь – при повышенной кислотности желудочного сока и как лёгкое слабительное. Входит в состав таблеток «Викалин» и «Викаир». Calcii chloridum (кальция хлорид) СаС12∙6H2O. Применяют при различных патологических состояниях: при недостаточной функции паращитовидных желез, при усиленном выделении кальция из организма, при аллергических заболеваниях, как средство, уменьшающее проницаемость сосудов, при кожных заболеваниях (зуде, экземе, псориазе и др.), при токсических поражениях печени, как кровоостанавливающее средство, как противоядие при отравлении солями магния, щавелевой кислотой и солями фтороводородной кислоты. Растворы кальция хлорида вводят внутривенно, так как они обладают сильным раздражающим действием и вызывают некроз тканей. Calcii sulfas ustus (кальция сульфат жженый, гипс) CaSO4∙2H2O. Применяют в травматологии для наложения гипсовых повязок и стоматологической практике. Barii sulfas pro roentgeno (бария сульфат для рентгеноскопии) BaSO4. Применяют внутрь в виде водной суспензии как контрастное средство при рентгенологическом исследовании пищевода, желудка и кишечника. Некоторые соединения s-элементов I и II групп применяются в качестве реактивов при анализе лекарственных веществ в фармацевтическом анализе, а также при анализе лекарственного растительного сырья. Например: NaOH, KOH, Ca(OH)2 и др. 3. Токсическое действие соединений s-элементов на живой организм Биогенные элементы в избытке могут оказывать токсическое действие, так как при этом нарушается химический гомеостаз. Например, избыток калия угнетающе действует на сердечную деятельность, поэтому прием препаратов калия строго дозируется. При повышенном содержании натрия в организме происходит нарушение функций нервной, сердечно-сосудистой и других систем, гладких и скелетных мышц. Один из s-элементов бериллий не относится к биогенным элементам, но обладает высокой токсичностью. Ионы бериллия подавляют активность многих ферментов, активируемых ионами Мg2+ в результате замещения ионов Мg2+ в его комплексах с ферментами. Это объясняется тем, что ион Ве2+, попадая в организм, образует более прочные комплексы чем ион Мg2+ с кислородсодержащими и другими лигандами, которые присутствуют в живых организмах, оказывая тем самым токсическое действие. Высокопрочные комплексы бериллия с фосфат-ионами хорошо растворимы по сравнению с менее прочными комплексами магния. Поэтому, магний и бериллий являются антагонистами: 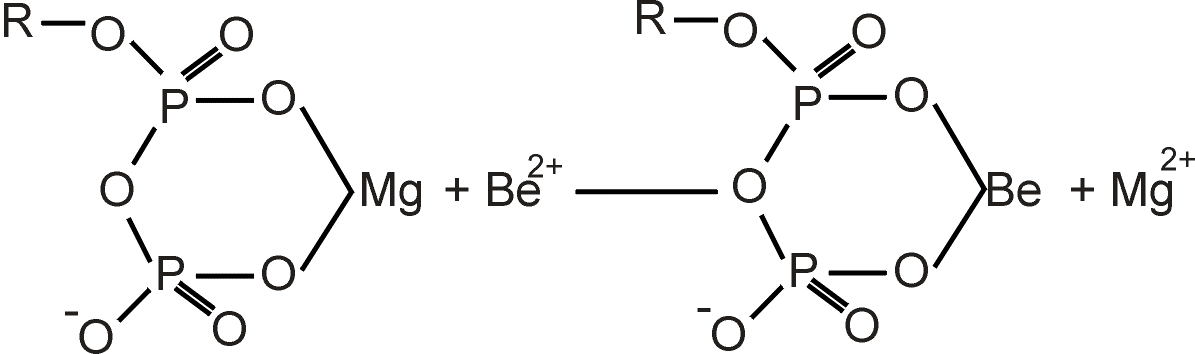 В результате попадания бериллия в организм возникает заболевание – «бериллиевый рахит». Кальций близок по физико-химическим характеристикам к стронцию и барию, поэтому ионы Sr2+ и Ba2+ являются синергистами иона Са2+. При избытке ионов Sr2+ возникает эндемическая уровская болезнь, которая была обнаружена у населения, проживающего у реки Уровы в Восточной Сибири. Анализ почвы этого района показал повышенное содержание в ней стронция. В костной ткани произошло вытеснение ионов Са2+ ионами Sr2+, который не способен выполнять функции Са2+. Избыток стронция вызывает размягчение и искривление костей, а также их ломкость – стронциевый рахит. Кроме того, избыток стронция вытесняет цинк из соединений с белками. Соединения бария очень токсичны. Механизм токсического действия этих солей заключается в том, что ионы Ва2+, имея одинаковый радиус с ионом К+, конкурируют с ним в биохимических процессах. В результате такой замены возникает гипокалиемия. Ионы Ba2+ могут проникать и в костные ткани, замещая в ней ионы Са2+, вызывая эндемические заболевания. Такое замещение имеет место вследствие того, что растворимость фосфатов щелочно-земельных металлов уменьшается в ряду Са – Sr – Ва и равновесие смещается вправо: 3SrX2(p-р) + Ca3(PO4)2(т) Û Sr3(PO4)2(т) + 3CaX2(p-р) где X = Cl-, HCO3- и др. Образование очень прочного и малорастворимого фосфата бария – Ва3(РО4)2 в костной ткани, нервных клетках и мозговом веществе обусловливает токсичность иона Ва2+. |
