I. Общая характеристика биоэлементов Классификация и топография элементов
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
Тема I. d-Элементы VI группы: хром, молибден, вольфрам1. Биологическая роль хрома, молибдена, вольфрама Хром относится к биогенным элементам. Общая масса хрома у взрослого человека равняется 6 мг. Как микроэлемент хром изучен еще недостаточно, но его существенная биогенная роль не вызывает сомнения. Установлено, что он играет важную роль в процессе метаболизма углеводов, осуществляя, по-видимому, связывание инсулина с рецепторами клеточных мембран. С этим согласуется тот факт, что обычное содержание хрома в сыворотке крови, которое составляет приблизительно 0,03 мМ, резко снижается при введении в кровь глюкозы. Хром потенцирует действие инсулина в периферических клетках, влияет на гомеостаз сывороточного холестерина. Кроме того, хром входит в состав некоторых ферментов, осуществляющих окислительно-восстановительные реакции в клетках. Входит в состав пепсина, расщепляющего белки в пищеварительном тракте животных. Молибден является эссенциальным (жизненно необходимым) микроэлементом. По содержанию в организме человека молибден относится к микроэлементам. Он входит во многие ферменты (ксантиндегидрогеназы, ксантиноксидазы, альдегидоксидазы, нитроредуктазы, сульфитоксидазы и др.), которые являются катализаторами окислительно-восстановительных процессов в растительных и животных организмах. Активные центры ферментов обычно содержат молибден, связанный с серой. Например, ксантиноксидаза – фермент, ускоряющий обмен сложных белков (в частности, пуриновый обмен): ксантиноксидаза ксантин + О2 + H2O Если мочевая кислота не успевает выводиться из организма, то соли её скапливаются в суставах и мышечных сухожилиях, вызывая подагру. Как лекарственные препараты соединения молибдена в медицинской практике не применяются. Есть данные, что молибден играет важную роль в процессе включения фтора в зубную эмаль. Вольфрам. В отличие от молибдена вольфрам не относится к эссенциальным элементам. Однако, вольфрам способен замещать молибден и ингибировать молибдензависимые ферменты, например, ксантиноксидазу, что способствует снижению уровня мочевой кислоты и повышению уровня ксантина и гипоксантина. Есть данные, что вольфрам не обладает канцерогенными, тератогенными и метаболическими свойствами у человека и животных. 2. Лечебное действие неорганических соединений молибдена Проводятся исследования эффективности применения молибдата аммония для лечения новообразований головного мозга и мужского бесплодия. 3. Применение неорганических соединений хрома и молибдена в медицине и фармации В медицине в лечебных целях соединения хрома из-за высокой токсичности в настоящее время не используются. Для диагностики заболеваний крови и желудочно-кишечного тракта применяется pаствор Na2CrO4 меченый изотоп 51Сr для инъекций (Solutio Natrii chromatis chromo – 51 notati pro injectionibus). Окислительные свойства хроматов и дихроматов широко используют в аналитической практике (хроматометрия). Метод основан на применении дихромата калия как сильного окислителя: 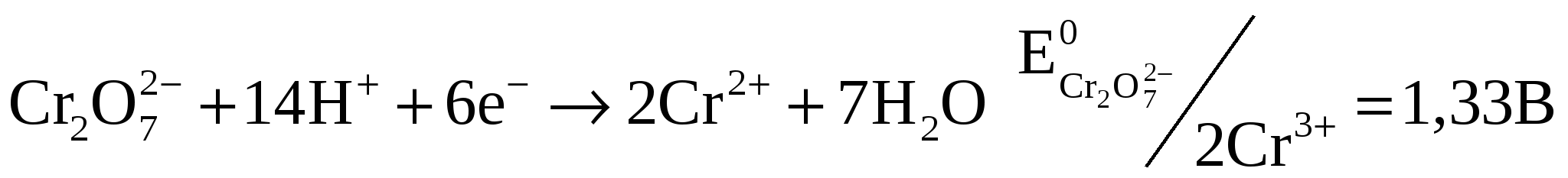 Хроматометрия используется для определения железа(II), урана(IV), меди(I), молибдена(III), некоторых органических веществ. В санитарно-гигиенической практике применяют хроматометрию для анализа промышленных и сточных вод. В ходе анализа определяется так называемая окисляемость воды, которая характеризует общее содержание органических и неорганических восстановителей. В лабораторной практике для очистки химической посуды широко применяют хромовую смесь, состоящую из К2Сr2О7, Н20 и концентрированной Н2SО4 в соотношении 1:6:2 (по массе), которая обладает сильными окислительными свойствами. Некоторые соединения молибдена применяются в анализе. Молибдат аммония (NH4)2MoO4∙4H2O используется как аналитический реактив на красный фосфор в присутствии концентрированной азотной кислоты, образуется осадок аммониевой соли гетерополифосформолибденовой кислоты: (NH4)3H4[P(Mo2O7)6]. 4. Токсическое действие соединений хрома Соединения хрома оказывают отрицательное воздействие на организм человека: общетоксическое, вызывают дерматиты и экземы при соприкосновении с кожей, аллергенное, канцерогенное. Причем соединения хрома(VI) значительно токсичнее, чем соединения хрома(III). Растворимые соединения хрома ядовиты: пары хромовой кислоты повреждают слизистые оболочки носа и дыхательных путей, хроматы и дихроматы разъедают кожу и вызывают экзему, а также повышают чувствительность к аллергенам. При приемах внутрь наблюдаются ожоги слизистой оболочки полости рта, ожоги пищевода и желудка, отечность. В литературных источниках имеются разноречивые данные о смертельной дозе хроматов 0,2-0,5-1 г и даже 8 г. При содержании в водоемах соединения хрома(VI) могут вызвать поражение внутренних органов при потреблении с питьевой водой, а при купании – воспалительные изменения слизистых глаз, дерматиты и экземы, а также оказать канцерогенное действие. Предельно допустимая концентрация хрома в питьевой воде 0,05 мг/л. В аналитической практике используют способность ионов тяжелых металлов образовывать труднорастворимые хроматы: кирпично-красный Ag2CrO4 растворяется в растворе аммиака и азотной кислоте. желтый Реакцию проводят в уксуснокислой среде, в которой PbCrO4 нерастворим. В щелочной среде PbCrO4 растворяется с образованием плюмбитов: PbCrO4 + 4OH- → PbO22- + CrO42- + 2H2O Ba2+ + CrO42- → BaCrO4↓ желтый кристаллический BaCrO4 растворяется в сильных кислотах. В присутствии Н2SO4 желтый BaCrO4 переходит в белый BaSO4. 2Ba2+ + Cr2O72- + H2O → 2BaCrO4↓ + 2H+ желтый Тема II. d-Элементы VII группы: марганец
Марганец – один из десяти металлов жизни. Он является важным биогенным элементом, который необходим для нормального протекания процессов в организме. Марганец является эссенциальным элементом для человека и животных. Соединения марганца в основном поступают в организм с пищей. Всасывание марганца происходит в тонком кишечнике. Этому процессу способствуют витамины В1, Е, в умеренных количествах фосфор и кальций, а препятствует – избыточное поступление в организм фосфора и кальция. Среднесуточная потребность человека в марганце около 5 мг, она удовлетворяется той пищей, которую мы едим. Биоусвояемость марганца низкая и составляет всего 3-5%. В органах и тканях взрослого человека содержится около 12 мг марганца. Концентрируется он главным образом в костной ткани (до 43% от общего количества), печени, почках, поджелудочной железе. В организме марганец образует комплексы с белками, нуклеиновыми кислотами (РНК и ДНК) и аминокислотами. Хотя эти комплексы из-за большого радиуса катиона Mn2+ и его жесткости обычно мало устойчивы, но способствуют активации большого числа ферментов. Установлено, что биогенная роль ионов марганца (II) в организме разнообразна: они оказывают влияние на кроветворение, образование костей, минеральный обмен, процессы размножения и др. Так как ионные радиусы марганца и магния близки, они могут замещать друг друга в биохимических процессах. Марганец участвует в таком жизненно важном процессе, как аккумуляция и перенос энергии в организме, доказано его участие в синтезе витаминов группы В и С. В опытах на животных установлено влияние марганца на образование гемоглобина. Имеются данные, что это влияние марганца проявляется при некотором оптимальном соотношении марганца и железа. Таким образом, марганец – жизненно необходимый элемент. Следует отметить, что в организме марганец находится в степени окисления +2, но его восстановительные свойства не выражены. Участвуя в биохимических процессах, марганец, как правило, не меняет своей степени окисления. Очевидно, это связано с тем, что в организме нет сильных окислителей, а также с тем, что органические лиганды стабилизируют состояние марганца(II). Дефицит марганца является одним из распространенных отклонений в биоэлементном обмене современного человека. Это связано с повышенной психо-эмоциональной нагрузкой, за счет повышенного расходования марганца для обеспечения основных нейрохимических процессов, протекающих в центральной нервной системе. 2. Лечебное действие неорганических соединений марганца Из соединений марганца в медицинской практике используют перманганат калия. Применяют растворы различных концентраций (в зависимости от заболевания). В целом растворы КМnO4 обладают антисептическими и прижигающими свойствами и используются для обработки поверхности кожи и слизистых оболочек, что обусловлено окислительным и коагулирующим действием его на белки. Лечебное действие KMnO4 основано на реакции: 4KMnO4 + 2H2O → 4MnO2↓ + O2↑ + 4KOH Образующийся MnO2 оказывает вяжущее, раздражающее и прижигающее действие, а выделяющийся кислород обладает антимикробным и дезодорирующим действием. Кислород выделяется без образования пузырьков, поэтому растворы KMnO4 можно вводить в глубокие раны при анаэробной инфекции. Перманганат калия является препаратом наружного действия. Иногда раствор КМnО4 применяют внутрь для окисления токсичных органических веществ, переводя их в менее токсичные формы. Например, морфин окисляется в мало токсичный оксиморфин. Кроме того, в комплексе с другими компонентами используют сульфат и хлорид марганца(II) для лечения анемии. При больших кровопотерях также применяют соединения марганца в сочетании с солями меди(II) и кобальта(II).
и фармации Kalii permanganas (калия перманганат) КМnO4. Применяют как антисептическое средство наружно в водных растворах для промывания ран (0,1-0,5%), для полоскания полости рта и горла (0,01-0,1%), для смазывания язвенных и ожоговых поверхностей (2-5%), для спринцеваний и промываний в гинекологической и урологической практике (0,02-0,1%). Растворы (0,02-0,1%) применяют также для промывания желудка при отравлениях морфином, аконитином и другими алкалоидами, а также фосфором. Для анализа ряда химических соединений и лекарственных препаратов, обладающих свойствами восстановителей, Н2О2, NaNО2, FеSО4 и др. применяют растворы перманганата калия, который и дал название методу – перманганатометрия. Определение проводят в кислой среде в присутствии серной кислоты: MnO4– + 8H+ + 5e- → Mn2+ + 4H2O Используют также восстановление перманганат-ионов в нейтральной среде до МnО2 (бурого осадка) по полуреакции: MnO4– + 2H2O + 3e- → MnO2¯ + 4OН– Перманганатометрию используют в клиническом и биохимическом анализе для определения некоторых ферментов, а также для определения мочевой кислоты в крови. В санитарно-гигиенической практике используют перманганат калия для определения окисляемости воды в промышленных и сточных водах. 4. Токсическое действие соединений марганца на живой организм При действии на организм через органы дыхания соединения марганца приводят к тяжёлым поражениям центральной нервной системы, а также действуют на почки, органы кровообращения и легкие. Предельно допустимая концентрация его соединений в воздухе равна 0,0003 мг/л в пересчёте на марганец. Описаны случаи острого отравления марганцевой пылью на производстве, с последующим быстрым развитием «марганцевого психоза» и других патологических проявлений. Всемирная организация здравоохранения установила предельно допустимую концентрацию в питьевой воде марганца 0,5 мг/л и желательную – 0,1 мг/л. При попадании в организм перманганаты токсичны из-за сильных окислительных свойств. При полосканиях, спринцеваниях концентрированными растворами перманганата калия наблюдается отёк слизистых оболочек с последующими воспалительными явлениями, приводящими иногда к общему отравлению организма. Независимо от способа введения марганец выводится из организма через желудочно-кишечный тракт и почки. Основным органом, задерживающим марганец, является печень. Для лечения острых отравлений перманганатами используют 3%-й раствор пероксида водорода в уксуснокислой среде: 2KMnO4 + 5H2O2 + 6CH3COOH → 2Mn(CH3COO)2+ 2CH3COOK + 8H2O + 5O2↑ Тема III. d-Элементы VIII группы: железо, кобальт, никель 1. Биологическая роль железа, кобальта, никеля Железо. По содержанию в организме человека железо относится к жизненно необходимым микроэлементам. Большая часть железа (»70%) сосредоточена в гемоглобине крови. Железо входит в состав ферментов, например, цитохромов, каталазы и др. В связанной форме железо находится в белках, которые выполняют роль переносчиков железа. Комплексы железа: а) Гемоглобин Наиболее важным внутрикомплексным соединением железа является гемоглобин, который представляет собой белок, содержащий небелковую группу – гем. Гем – это бионеорганический комплекс железа (II) с органическим веществом – порфирином. Физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от легких к тканям. Если гемоглобин условно обозначить HbFe2+, то реакцию обратимого присоединения кислорода можно выразить схемой:
дезоксигемоглобин оксигемоглобин Гемоглобин, присоединивший кислород, называется оксигемоглобином, а без кислорода – дезоксигемоглобином. Гемоглобин взаимодействует также с оксидом углерода(II) (угарным газом). При этом образуется макроциклический комплекс с железом – карбоксигемоглобин: карбоксигемоглобин Константа устойчивости этого комплекса приблизительно в 200 раз больше, чем оксигемоглобина. Поэтому при вдыхании оксида углерода(II) большая часть гемоглобина переходит в карбоксигемоглобин, что нарушает перенос кислорода от легких к тканям и вызывает отравление организма. При значительном увеличении парциального давления кислорода равновесие реакции может сместиться в сторону разрушения [Hb ∙ Fe2+ ∙ CO] и частичного образования оксигемоглобина. Серьезной причиной отравления оксидом углерода(II) является курение. Содержание карбоксигемоглобина в крови курильщика, выкуривающего пачку сигарет в день, составляет в среднем 4,7%, а у некурящих всего – 0,3-0,5%. б) Миоглобин (Mb) Комплексообразователем в миоглобине является ион Fe2+, который, предоставляя 6 свободных атомных орбиталей, образует 6 связей по донорно-акцепторному механизму. Из них 4 связи железо образует с порфириновым лигандом, пятая занята белком глобином, а шестая связь – молекулой воды, которая связана лабильно с комплексообразователем. Миоглобин связывает часть кислорода, поступающего в ткань, за счет замещения молекулы воды на молекулу кислорода, образуя оксигемоглобин [Mb ∙ Fe2+ ∙ O2]: Миоглобин достаточно прочно удерживает кислород. Это позволяет тканям запасать кислород для его использования только при острой кислородной недостаточности. в) Цитохромы – группа окислительно-восстановительных ферментов, представляющих собой гемсодержащий комплекс с белком. Функция комплекса заключается в переносе электрона за счет обратимого изменения степени окисления комплексообразователя: г) Каталазы и пероксидазы – группа железосодержащих ферментов, активные центры которых содержат Fe3+. Каталаза ускоряет разложение H2O2: Пероксидаза ускоряет реакции окисления субстратов RH2 пероксидом водорода: RH2 + H2O2 Таким образом, эти ферменты защищают клетку от Н2О2 - продукта свободного окисления. д) Ферритин В органах и тканях имеется депонированное (запасенное) железо, которое используется, если возникает дефицит железа. Депонируется оно с помощью белка – ферритина, который представляет собой биокластер с высокой молекулярной массой. Кобальт относится к жизненно необходимым (эссенциальным) элементам. В организме содержится 1,2 мг кобальта в основном в составе витамина В12, центральным атомом которого является Со3+. Витамин В12 необходим для нормального кроветворения и созревания эритроцитов, синтеза аминокислот, белков, РНК, ДНК. Никель. В организме человека никель содержится в количестве 5-13,5 мг, около 49% микроэлемента в мышечной ткани, кроме того в лёгких, коже, печени. В организме человека он входит в состав ряда ферментов. Установлено, что никель пролонгирует действие инсулина, что увеличивает его гипогликемическую активность. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет процесс перехода сульфгидрильных групп в дисульфидные. Он угнетает действие адреналина и снижает артериальное давление. 2. Лечебное действие соединений железа и витамина В12 Соединения железа(II) используются при различных заболеваниях, сопровождающихся анемией. Механизм терапевтического действия соединений железа(II) связан с образованием гемоглобиновой буферной системы. Гемоглобиновая буферная система является буферной системой эритроцитов, которая включает в качестве донора протона две слабые кислоты: гемоглобин HHb (рКa=8,20) и оксигемоглобин HHbO2 (рКa=6,95). Роль акцепторов протона играют сопряженные этим кислотам основания, т.е. их анионы Hb– и HbO2–. Механизм буферного действия гемоглобиновой буферной системы основан на следующих реакциях. При добавлении кислоты: Поглощать ионы Н+ в первую очередь будут анионы гемоглобина, который имеет большое сродство к протону. При действии основания наибольшую активность будет проявлять оксигемоглобин по сравнению с гемоглобином: Таким образом, гемоглобиновая система крови играет очень значительную роль сразу в двух важнейших физиологических процессах – дыхании и поддержании постоянства рН внутри эритроцитов, а в конечном итоге – крови. Гемоглобиновая буферная система в организме эффективно функционирует только в сочетании с гидрокарбонатной системой. Лечебное действие витамина В12 заключается в том, что некоторые его формы образуют в качестве кофермента соединения с витамином В6 или с некоторыми ферментами. В этих случаях он выполняет две основные функции: 1) роль метилирующего агента; 2) взаимный перенос атомов водорода и различных групп между соседними атомами углерода биосубстрата, при этом кобальт восстанавливается:
Ферковен Fercovenum (содержит железа сахарат, кобальта глюконат и раствор углеводов) – применяется при анемии. Железа лактат (Ferri lactas) – применяется при гипохромных анемиях. Железа закисного сульфат (Ferrosi sulfas) – применяется при анемии. Ферроплекс (FeSO4 с аскорбиновой кислотой) (Ferroplex) – применяется при анемии. Железа глицерофосфат (Ferri glycerophosphas) – применяется при анемии, астении. Железа (III) хлорид (Ferri chloridum) – дезинфицирующее и кровоостанавливающее средство. Железо восстановленное (Ferrum reductum) – при анемии. Феррум Лек (Ferrum Lek) – применяется внутримышечно и внутривенно при лечении гипохромной анемии. Радиоактивные изотопы железа (59Fe) – применяют при исследованиях обмена железа в организме. Коамид Coamidum – содержит кобальт – применяется для лечения анемии. Витамин В12 или цианокобаламин Cyanocobalaminum – применяется при лечении анемии, нервных заболеваний. Изотоп радиоактивного кобальта 60Со – применяют для диагностики и лечения злокачественных опухолей.
на живой организм Железо. Порог токсичности железа для человека составляет 200 мг/сутки. Летальная доза для человека: 7-35 г. Летальным исходом для ребенка может стать прием сульфата железа в дозе 3 г и выше. Недостаток содержания железа в организме является одной из самых распространенных причин возникновения анемии, обильных кровотечений, нарушения нервно-психических функций и снижения интеллекта у детей. Люди с избыточным содержанием железа страдают от физической слабости, теряют вес, чаще болеют. При этом избавиться от избытка железа намного труднее, чем устранить его дефицит. Необходимо помнить, что железо является окисляющим агентом (т.е. может явиться причиной возникновения свободных радикалов, способных разрушать ткани), поэтому не следует применять препараты железа в избыточных количествах. Кобальт. Токсическая доза для человека 500 мг. Летальная доза для человека не определена. Летальная доза кобальта для животных составляет 25-30 мг/кг. Недостаток В12 в организме вызывает злокачественную анемию. Дефицит кобальта часто встречается у вегетарианцев, лиц с нарушениями функций органов желудочно-кишечного тракта, спортсменов, испытывающих повышенные физические нагрузки; а также при кровопотерях. Основные проявления дефицита кобальта выражаются в общей слабости, повышенной утомляемости, снижении памяти, вегетососудистых нарушениях, аритмии, замедленном развитии в детском возрасте, медленном выздоровлении после заболеваний. Несмотря на то, что избыточное поступление кобальта в организм встречается довольно редко, этот процесс сопровождается различными нарушениями здоровья. Основные проявления избытка кобальта: поражение сердечной мышцы, аллергодерматиты (контактный дерматит), гиперплазия щитовидной железы, поражение слухового нерва, повышение артериального давления и уровня липидов в крови, повышение содержания эритроцитов в крови. Никель. Металлический никель не опасен, а вот пыль и пары его соединений – токсичны. Никель способен накапливаться в роговице, поэтому отравление им может привести к значительному ухудшению зрения. Отравление никелем также негативно сказывается на пищеварительном тракте и на нервной системе. Никель – канцерогенное вещество. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил [Ni(CO)4]. Предельно допустимая концентрация никеля в воздухе составляет от 0,0002 до 0,001 мг/м3 (для различных соединений). Согласно ГОСТ 12.1.005-88 никель и его летучие соединения относятся к I классу опасных веществ. Недостаточность никеля приводит к ингибированию нескольких печеночных энзимов, дезорганизует функционирование эндоплазматического ретикулума гепатоцитов, дыхательные процессы в митохондриях, изменяет содержание липидов в печени. Подобно кобальту, никель участвует в регуляции метаболизма гема в печени и почках, индуцируя активность гемоксигеназы. Повышенное содержание никеля в организме человека вызывает аллергические реакции (контактный дерматит). Тема IV. d-элементы I, II группы: медь, серебро, цинк, ртуть 1. Биологическая роль меди, серебра, цинка, ртути Медь. По содержанию в организме медь относится к микроэлементам, является металлом жизни и концентрируется в печени, головном мозге и в крови. В настоящее время известно около 25 медьсодержащих белков и ферментов. Эти ферменты активируют молекулу кислорода, которая участвует в процессе окисления органических соединений. Они составляют группу так называемых оксигеназ и гидроксилаз. Имеется большая группа медьсодержащих белков, которые катализируют окислительно-восстановительные реакции с переносом протона или электронов от окисляемого вещества непосредственно на молекулярный кислород – это так называемые оксидазы. К оксидазам относится такой важнейший дыхательный фермент, как цитохромоксидаза (ЦХО), которая катализирует завершающий этап тканевого дыхания. Все ферменты тканевого дыхания связаны с внутренними мембранами митохондрий. В ходе каталитического процесса степень окисления меди цитохромоксидазы обратимо изменяется:  Окисленная форма цитохромоксидазы (Сu2+) принимает электроны, переходя в восстановительную (Сu+) форму, окисляющуюся молекулярным кислородом, который сам при этом восстанавливается. Затем кислород присоединяет протоны из окружающей среды и превращается в воду. Механизм действия цитохромоксидазы не полностью расшифрован. Однако доказано, что на завершающем этапе тканевого дыхания ЦХО осуществляет перенос электронов на кислород. Одним из медьсодержащих белков, обратимо присоединяющих молекулярный кислород, является гемоцианин (НС). Медь вместе с железом участвует в кроветворении. Известно, что при дефиците меди в организме нарушается обмен железа между плазмой крови и эритроцитами, это может привести к разрушению эритроцитов. Потребность человека в меди 2-3 мг в сутки. Она полностью обеспечивается потребляемой пищей. Серебро − примесный микроэлемент. В организме человека содержится приблизительно 7,3 ммоль серебра. Концентрируется серебро в печени, в гипофизе, эритроцитах, в пигментной оболочке глаза. Цинк является микроэлементом и относится к металлам жизни. В организме концентрируется главным образом в мышцах, печени, поджелудочной железе, тестикулах. Цинк входит в состав более 40 металлоферментов, которые катализируют гидролиз пептидов, белков, некоторых эфиров и альдегидов. По-видимому, эта роль в определенной степени обусловлена тем, что цинк не проявляет разных степеней окисления. Постоянная степень окисления определяет его участие в реакциях гидролиза, идущих без переноса электронов. Одним из ранее открытых и наиболее изученных является цинксодержащий фермент – карбоангидраза. Этот фермент крови, содержащийся в эритроцитах, встречается в трех формах, которые отличаются активностью. Фермент состоит приблизительно из 260 аминокислотных остатков и представляет собой бионеорганический комплекс. Цинк, расположенный в полости комплекса является важнейшим и незаменимым компонентом активного центра фермента. При удалении Zn фермент теряет каталитическую активность. Содержание цинка в ферменте порядка 0,33%. Хотя доля металла невелика, его роль трудно переоценить. Именно благодаря этому небольшому количеству цинка образующийся в тканях оксид СО2 превращается в кислоту Н2СО3. Затем в легких идет процесс дегидратации Н2СО3. Таким образом, эта обратимая реакция влияет на процесс дыхания, на его скорость, на газообмен в организме. Существуют ферменты, которые участвуют в гидролизе дипептидов, они называются дипептидазами, в их состав обязательно входит цинк. Цинк входит в состав гормона инсулина, который влияет на содержание сахара в крови. Другими словами, цинк участвует в углеводном обмене. Ртуть обнаруживается во всех органах и тканях организма человека. Биологическая роль ртути не ясна. 2. Лечебное действие неорганических соединений меди, серебра и ртути Медь. Высокое сродство металлов I группы к сере определяют большую энергию связи Ме–S, а это, в свою очередь, обусловило определенный характер их поведения в биологических системах. Катионы этих металлов легко взаимодействуют с веществами, в состав которых входят группы, содержащие cеру. Например, ионы Cu2+ реагируют с дитиоловыми ферментами микроорганизмов по схеме: 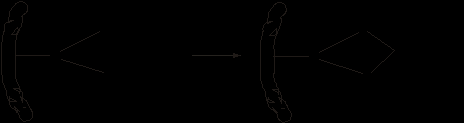 Включение ионов металлов в состав белка инактивирует ферменты, разрушает белки. Такой же механизм лежит и в основе действия лекарственных препаратов, содержащих медь и серебро, применяемых в дерматологии. Серебро. Как и большинство тяжелых металлов, этот элемент не играет важной роли. Но как все тяжелые металлы, попадая в организм, оказывает токсическое действие, которое обусловлено тем, что, соединяясь с белками, содержащими серу, серебро инактивирует ферменты, разрушает и свертывает белки, образуя нерастворимые альбуминаты. Эта же способность серебра образовывать нерастворимые альбуминаты с белками определяет бактерицидные свойства серебра и его соединений. Уже при содержании серебра порядка 10-8 ммоль/л вода обладает бактерицидным действием. В настоящее время доказано, что бактерицидное действие ионов серебра выше таких известных дезинфицирующих средств, как карболовая кислота, хлор, хлорная известь. Как правило, все используемые в медицине соединения серебра -препараты наружного действия. Их использование основано на вяжущих, прижигающих и бактерицидных свойствах этих соединений. Некоторые соединения цинка и ртути в небольших концентрациях нашли применение в медицинской практике. Использование их основано на вяжущем, прижигающем и антисептическом действии. Так, цинка сульфат применяют для изготовления глазных капель (0,25%), цинка хлорид используют в стоматологической практике для прижигания папилом, для лечения воспаленных слизистых тканей. В стоматологической практике используют также цинка оксид и цинка сульфат. 3. Применение неорганических соединений меди, серебра, цинка и ртути в медицине и фармации Cupri sulfas (меди II сульфат) CuSO4∙5H2O – антисептическое и вяжущее средство в виде 0,25% раствора при коньюнктивитах, для промывания мочевого пузыря, при уретритах и вагинитах. Аrgenti nitras (серебра нитрат) AgNO3 – вяжущее, прижигающее и противовоспалительное средство. Назначают в виде водных растворов, мазей, а также в виде ляписных карандашей. Stillius Lapidis (карандаш ляписный ) – для прижиганий. Protargoli (протаргол) – вяжущее, антисептическое противовоспалительное средство для смазывания слизистых оболочек верхних дыхательных путей, для промывания мочеиспускательного канала и мочевого пузыря, в глазных каплях при коньюнктивите, блефарите. Collargolum (колларгол) – коллоидный раствор серебра применяют в виде 0,2-1% раствора для промывания гнойных ран. Zinci sulfas (цинка сульфат) ZnSO4∙7H2O – антисептическое и вяжущее средство при коньюнктивитах и хроническом катаральном ларингите, в редких случаях назначают внутрь как рвотное. Zinci oxуdum (цинка оксид) ZnO – применяют наружно в виде присыпок, мазей, паст, как вяжущее, подсушивающее и дезинфицирующее средство при кожных заболеваниях. Hydrargyri dichloridum (ртути II хлорид) HgCl2 − обладает антисептическим действием. Hydrargyri amidochloridum (ртути амидхлорид) HgNH2Cl – обладает антисептическим действием. В настоящее время лекарственные препараты ртути в виду токсичности не применяются.
на живой организм Медь. В больших концентрациях растворимые соли меди токсичны. Так например, сульфат меди массой до 2 г вызывает сильное отравление с возможным смертельным исходом. Токсическое действие меди объясняется тем, что медь образует с белками нерастворимые бионеорганические хелаты − альбуминаты, что приводит к коагуляции белков. Ионы меди образуют прочную связь с аминным азотом и с группой –SН белков, что приводит к инактивации тиоферментов. Серебро, попадая в организм оказывает токсическое действие, обусловленное тем, что соединяясь с белками, содержащими серу, инактивирует, разрушает и коагулирует белки, образуя нерастворимые альбуминаты. При попадании в организм больших доз растворимых солей серебра может наступить острое отравление, которое сопровождается отмиранием слизистой оболочки желудочно-кишечного тракта. Растворимые соединения цинка и ртути оказывают раздражающее действие на кожу, а при попадании внутрь организма вызывают отравление. Ртуть является самым токсичным элементом Периодической системы. Отравления могут вызывать даже пары металлической ртути. Признаки отравления проявляются уже при содержании ртути в помещении в количестве 0,0002-0,0003 мг/л. Соединения ртути способны вступать во взаимодействие с сульфгидрильными группами белков, ферментов и некоторых аминокислот. При этом образуются нерастворимые соединения. Происходит подавление активности ферментов и свертывание белков. Ионы ртути блокируют одновременно две SН–группы: 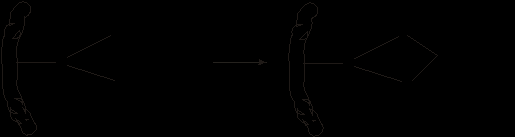 |
