Навигация по странице:Мышьяк, сурьма и висмут2. Лечебное действие неорганических соединений азота, фосфора, мышьяка и висмута3. Применение неорганических соединений азота, фосфора, мышьяка, висмута в медицине и фармации Solutio Ammonii caustici 10%Natrii nitrisSolutio Natrii phosphatis pro injectionibus - 32Solutio «Duplex» pro injectionibusДля качественного обнаружения соединений мышьяка, сурьмы и висмутаРеакции обнаружения соединений сурьмы.Реакции обнаружения соединений висмута.Тема IV. p-Элементы VI группы: кислород. Озон, вода, пероксид водорода 1. Биологическая роль кислорода, озона, воды Кислород.Solutio Hydrogenii peroxydi dilutaТоксическое действие озона, пероксида водорода Озон.Тема V. р-Элементы VI группы: сера, селен 1. Биологическая роль серы и селена Сера.2. Лечебное действие неорганических соединений серыПрименение неорганических соединений серы и селена в медицине и фармации Sulfur praecipitatum
|
I. Общая характеристика биоэлементов Классификация и топография элементов
Тема III. р-Элементы V группы: азот, фосфор, мышьяк, сурьма, висмут
1. Биологическая роль азота, фосфора, мышьяка, сурьмы, висмута
Азот и фосфор относятся к макроэлементам, массовая доля азота в организме человека 3,1%, фосфора – 0,95%. Мышьяк, сурьма и висмут относятся к примесным элементам, массовая доля их в организме человека составляет 10-6%.
Азот – органоген номер четыре. Значимость его для живого организма очень высока, именно он, наряду с углеродом, водородом и кислородом, входит в состав жизненно важных аминокислот:
R–CН–(NH2)–СООН,
которые образуют ДНК, РНК и белки – основу жизни. Во многих бионеорганических комплексах (гормоны, ферменты и др.) атом азота по донорноакцепторному механизму связывает органическую и неорганическую части молекулы, например, гемоглобин.
Фосфор – органоген номер пять, играет исключительно важную роль в обмене веществ. Суточная потребность человека в фосфоре составляет 1,3 г. Фосфор настолько распространен в пищевых продуктах, что случаи его явной недостаточности практически неизвестны. Однако не весь фосфор, содержащийся в продуктах, может всасываться, поскольку его всасывание зависит от многих факторов: рН, соотношения между содержанием кальция и фосфора в пище, наличия в пище жирных кислот.
В организме фосфор присутствует в виде фосфат-иона, который входит в состав неорганических и органических веществ. Фосфор обнаружен во всех клетках организма. Больше всего фосфора содержится в костях и скелетной мускулатуре. Основным минеральным компонентом костной и зубной тканей является Ca5(PO4)3OH.
Мембраны клеток в значительной степени состоят из фосфолипидов. Фосфор входит в состав белков, нуклеиновых кислот, нуклеотидов и других биологически активных соединений.
Универсальным источником энергии для всех биохимических процессов, протекающих в живых системах, является АТФ – аденозинтрифосфа́т, в молекуле которого содержатся три остатка фосфорной кислоты:
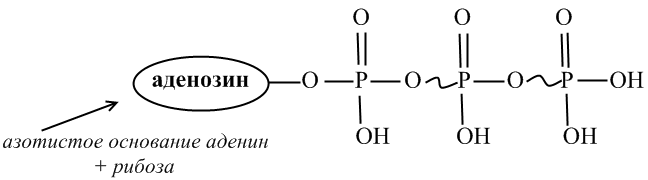
В организме происходит реакция гидролиза АТФ, в результате которой разрывается связь РО и выделяется значительное количество энергии. Поэтому указанную связь называют макроэргической. При рН = 7,0 АТФ существует в виде аниона АТФ4-, так как все фосфатные группы при этом значении рН ионизированы. Гидролиз АТФ можно записать в виде уравнения:
АТФ4- + Н2О → АДФ3- + Н2РО4-
Гидролиз макроэргических связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению энергии, по различным данным, от 40 до 60 кДж/моль.
Живые организмы не могут обходиться без фосфора. Сахара и жирные кислоты не могут быть использованы клетками в качестве источников энергии без предварительного фосфорилирования.
Совокупность гидро- и дигидрофосфатов в крови образует фосфатную буферную систему, которая вместе с другими буферными системами обеспечивает постоянство рН крови.
Мышьяк, сурьма и висмут постоянно находятся в живых организмах, но их физиологическая роль практически не выяснена. Ионы Аs 3+ и Sb3+ и в меньшей степени Bi3+ являются синергистами. Мышьяк и сурьма накапливаются в щитовидной железе, угнетают её функцию, вызывая эндемический зоб.
2. Лечебное действие неорганических соединений азота, фосфора,
мышьяка и висмута
Раствор аммиака (10%) применяется при обморочных состояниях, т.к. при вдыхании оказывает возбуждающее влияние на дыхательный центр, действуя через рецепторы верхних дыхательных путей. В больших концентрациях может вызвать рефлекторную остановку дыхания. Поэтому его нельзя применять пожилым людям с заболеваниями сердца.
Соединения нитритов, а также нитратов расширяют коронарные сосуды и способны купировать приступ стенокардии.
Хлорид аммония оказывает диуретическое действие, а также является эффективным средством для коррекции алкалоза (защелачивания крови), создания кислого рН мочи. Легко всасываясь из желудочно-кишечного тракта, препарат превращается в печени в мочевину, обладающую диуретической активностью, и соляную кислоту, которая уменьшает щелочность тканей:
2NH4Cl + H2CO3 ® CO(NH2)2 + 2HCl + 2H2O
Диуретический эффект аммония хлорида связан с тем, что в процессе компенсации ацидоза мобилизуется и выделяется почками натрий, одновременно выводится из организма соответствующее количество воды. Диуретическое действие хлорида аммония при повторном применении постепенно уменьшается.
Основной нитрат висмута проявляет вяжущее, подсушивающее и антисептическое действия. Его применение основано на том, что при попадании в пищеварительный тракт он подвергается гидролизу с образованием малорастворимых продуктов, которые не всасываются через стенки желудочно-кишечного тракта:
Bi(NO3)3 + H2O ® BiONO3¯ + 2HNO3
3. Применение неорганических соединений азота, фосфора, мышьяка,
висмута в медицине и фармации
Solutio Ammonii caustici 10% (раствор аммиака 10%) - нашатырный спирт. Применяют наружно для возбуждения дыхания и выведения больных из обморочного состояния. Иногда применяют внутрь в качестве рвотного средства, принимают только в разведенном виде. Наружно применяют в виде примочек при укусах насекомых. В хирургической практике используют для мытья рук по методу С.И.Спасокукоцкого и И.Г.Кочергина.
Nitrogenium oxydulatum (азота закись) N2О − веселящий газ. Закись азота в смеси с кислородом используют для кратковременного общего наркоза в хирургической практике, оперативной гинекологии, хирургической стоматологии.
Ammonii chloridum (аммония хлорид) NН4С1. Применяют как диуретическое средство при отеках сердечного происхождения. Как отхаркивающее средство применяется при бронхите, пневмонии.
Natrii nitris (натрия нитрит) NаNО2. Применяют как сосудорасширяющее средство при стенокардии, иногда при спазмах сосудов мозга.
Natrii phosphas (натрия фосфат) Na2НРО4∙12Н2О. Применяют как антацидное средство. Входит в состав препарата «Уродан», который применяют при подагре, мочекаменной болезни, хронических полиартритах.
Solutio Natrii phosphatis pro injectionibus - 32 (раствор фосфата натрия с меченым изотопом фосфора 32). Применяется для диагностики злокачественных опухолей.
Acidum arsenicosum anhydricum (ангидрид мышьяковистый) Аs2О3. Применяют наружно как некротизирующее средство при кожных болезнях. В стоматологической практике используют для омертвления (некротизации) мягких тканей зуба (пульпы). В микродозах (0,001 г на прием) препарат назначают при малокровии, истощении, нервозности.
В медицинской практике используют раствор калия арсенита К3АsО3 (Фаулеров раствор мышьяка - Liquor arsenicalis Fowleri). Иногда назначают препарат при малокровии, истощении, неврастении, миастении.
Solutio «Duplex» pro injectionibus (раствор «Дуплекс» для инъекций). Представляет собой водный раствор стрихнина нитрата (0,1%) и натрия арсената (1%). Применяют в качестве общеукрепляющего и тонизирующего средства.
Bismuthi subnitras (висмута нитрат основной) смесь BiONO3, Bi(OH)2NO3, BiOOH. Применяют в качестве вяжущего и антисептического средства при язвенной болезни желудка и двенадцатиперстной кишки, колитах, энтеритах. Наружно применяют в виде мази и присыпки (5-10%) при воспалительных заболеваниях кожи и слизистых оболочек (язвы, экземы, дерматиты, эрозии).
4. Токсическое действие соединений азота, фосфора, мышьяка,
сурьмы и висмута на живой организм
При производстве азотной кислоты и некоторых других веществ образуются нитрозные газы, представляющие собой смесь оксидов: NО, NО2, N2О3, N2О4. При контакте этих газов с влажной поверхностью в легких образуются азотная и азотистая кислоты, поражающие легкие, что приводит к отеку и сложным расстройствам. При отравлении газами в крови образуются также нитраты и нитриты, которые очень токсичны, так как они являются дезаминирующими агентами, способствуют окислению аминогрупп нуклеиновых кислот и повреждают ДНК. Для человека предельно допустимое содержание NO2 в воздухе составляет 10-4%. Неуправляемые переносы оксидов азота ветрами заканчиваются выпадением кислотных дождей, содержащих азотную кислоту. Непосредственное попадание нитратов и нитритов в пищевые продукты происходит из-за завышенного внесения азотных удобрений в почву.
Нитрат-ионы восстанавливаются в организме человека до нитрит-ионов, которые вызывают метгемоглобиновую гипоксию. Под действием нитритов гемоглобин превращается в метгемоглобин, который не способен связывать и переносить кислород:
HbFe2+ + NO2- ® HbFe3+ + NO
связывает не связывает
кислород кислород
Попадая в кровь, нитриты вызывают кислородную недостаточность. В связи с этим в настоящее время NаNО2 почти не используют в медицинской практике.
В кишечном тракте нитриты превращаются в нитрозамины R2N-N=О - сильные канцерогены.
Фосфаты для организма не токсичны, более токсичны фосфиты и особенно фосфорорганические соединения (ФОС), являющиеся сильными нервно-паралитическими ядами и входящие в состав боевых отравляющих веществ.
Для всех ФОС характерно угнетение холинэстеразы, что используется при диагностике отравления ими. Схема взаимодействия холинэстеразы с ФОС:
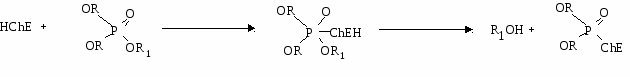
Для хронических форм отравлений ФОС характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Выводятся ФОС из организма, главным образом, почками.
Соединения мышьяка(V) и в особенности мышьяка(III) очень токсичны. Механизм токсического действия объясняется способностью мышьяка блокировать сульфгидрильные группы –SН ферментов и других биологически активных соединений. Например, в организме человека мышьяк взаимодействует с глутатионом. При этом блокируется сульфгидрильная группа, и глутатион теряет одну из важных биологических функций – восстановление токсичных пероксидов:
R–S–H + As(OH)3 ® R–S–As(OH)2 + H2O,
где R – радикал глутамат-иона.
Кроме того, мышьяк может замещать йод, селен и фосфор. Нарушая биохимические процессы метаболизма в организме, As является антиметаболитом этих элементов.
Смертельная доза для человека составляет приблизительно 0,05-0,1 мг мышьяка. Вредное действие мышьяка на организм связано не только с его токсичностью, но и канцерогенным действием.
Европейские нормы качества питьевой воды устанавливают предельно допустимую концентрацию мышьяка 0,2 мг/л. Эта же норма в питьевой воде принята в Англии. В нашей стране принята норма мышьяка в питьевой воде 0,05 мг/л (ГОСТ 2874-54).
Сурьма раздражает слизистую оболочку желудочно-кишечного тракта и кожу, вредно влияет на нервную систему и мышцу сердца. Соединения трехвалентной сурьмы токсичнее соединений пятивалентной сурьмы. Летальная доза сурьмы для взрослого 97,2 мг и для детей 48,6 мг. Предельно допустимые концентрации сурьмы в питьевой воде не нормируются ни в нашей стране, ни за рубежом.
Ядовитыми свойствами обладают легко растворимые соединения висмута, применяемые в терапевтической практике в качестве противосифилитических или рвотных средств. Однако и труднорастворимые соли висмута под влиянием соляной, молочной и других органических кислот образуют легко растворимые комплексные соединения висмута, всасывающиеся в кишечнике и угнетающие ферменты амино- и карбоксиполипептидазы. При введении в кровь комплексных солей висмута наблюдались отравления.
Для качественного обнаружения соединений мышьяка, сурьмы и висмута используются различные химические реакции.
Реакции обнаружения соединений мышьяка.
а) Реакции обнаружения мышьяка основаны на восстановлении мышьяка до арсина с дальнейшим обнаружением его методами Марша, Гутцайта и Зангер-Блека:
As2O3 + 6Zn + 6H2SO4 ® 2AsH3↑ + 6ZnSO4 + 3H2O
Метод Марша:
2AsH3  2As¯ + 3H2↑ 2As¯ + 3H2↑
Образуется серо-черный налет с металлическим блеском – «мышьяковое зеркало».
Метод Гутцайта:
AsH3 + 6AgNO3 ® Ag3As∙3AgNO3¯ + 3HNO3
желтое пятно на фильтровальной бумаге
Ag3As∙3AgNO3 + 3H2O ® 6Ag¯ + H3AsO3 + 3HNO3
черное пятно на фильтровальной бумаге
Метод Зангер-Блека:
2AsH3 + 3HgCl2 ® Hg3As2¯ + 6HCl
желтое пятно на фильтровальной бумаге
б) Реакция с сульфидами (фармакопейная реакция):
2AsCl3 + 3H2S ® As2S3¯ + 6HCl
желтый
2AsCl5 + 5H2S ® As2S5¯ + 10HCl
желтый
в) Сульфиды в сильнокислой среде образуют с солями мышьяка осадки As2S3 и As2S5 желтого цвета, которые не растворяются в концентрированной НС1, но растворимы в растворах Na2S, (NH4)2S, (NH4)2CO3 и аммиака:
As2S3 + 3Na2S ® 2Na3AsS3
тиоарсенит натрия
As2S5 + 3Na2S ® 2Na3AsS4
тиоарсенат натрия
г) Реакция с магнезиальной смесью (MgSO4 + NH3 + NH4Cl):
Арсенат-ионы в растворах образуют белый кристаллический осадок арсената аммония магния, растворимый в хлороводородной кислоте:
HAsO42- + Mg2+ + NH3 ® NH4MgAsO4¯
MgNH4AsO4 + 3HCl ® MgCl2 + NH4Cl + H3AsO4
Реакции обнаружения соединений сурьмы.
а) Соли сурьмы(III) в слабокислых растворах легко гидролизуются, при этом выпадают осадки белого цвета:
SbCl3 + H2O ® SbOCl¯ + 2HCl
б) Тиосульфат натрия Na2S2O3 образует в кислых растворах с солями сурьмы (III) оранжево-красный осадок Sb2OS2:
2SbCl3 + 2Na2S2O3 + 3H2O ® Sb2OS2¯ + 2Na2SO4 + 6HCl
в) Сероводород образует с солями сурьмы в кислой среде ярко-оранжевые осадки Sb2S3 и Sb2S5, растворимые в избытке Na2S с образованием тиосолей:
2SbCl3 + 3H2S ® Sb2S3¯ + 6HCl
Sb2S3 + 3Na2S ® 2Na3SbS3
тиоантимонит натрия
2H[SbCl6] + 5H2S ® Sb2S5¯ + 12HCl
Sb2S5 + 3Na2S ® 2Na3SbS4
тиоантимонат натрия
Реакции обнаружения соединений висмута.
Для качественного обнаружения соединений висмута используются осадочные реакции:
а) с йодидом калия образуется черный осадок BiI3, растворимый в избытке реактива с образованием комплексной соли – тетрайодовисмутата (III) калия:
Bi3+ + 3I- ® BiI3¯
BiI3 + KI ® K[BiI4]
б) с сульфидами (фармакопейная реакция) соли висмута (III) образуют коричнево-черный осадок Bi2S3, нерастворимый в разбавленных кислотах, кроме азотной кислоты:
2Bi3+ + 3S2-® Bi2S3¯
Bi2S3 + 8HNO3 ® 2Bi(NO3)3 + 2NO + 3S + 4H2O
Тема IV. p-Элементы VI группы: кислород. Озон, вода, пероксид водорода
1. Биологическая роль кислорода, озона, воды
Кислород. Кислород входит в состав всех жизненно важных органических веществ – белков, жиров, углеводов. При участии кислорода осуществляется один из важнейших жизненных процессов – дыхание, благодаря которому идет непрерывное поступление кислорода к тканям. Человек вдыхает и выдыхает в сутки 20-30 м3 воздуха. Потребность человека в кислороде в покое составляет 25 л/ч. Если концентрация кислорода в воздухе снижается до 9% – это представляет угрозу для жизни. У человека и высших животных кислород, проникая в кровь, соединяется с гемоглобином, образуя оксигемоглобин:
HbFe2+ + O2 « HbFe2+∙O2
Через стенки капилляров кислород поступает в клетки, где расходуется на окисление различных веществ (жиров, углеводов, белков и др.), в результате этих процессов образуется СО2 и Н2О, выделяется энергия, обеспечивающая жизнедеятельность живых организмов.
HbO2 ® Hb + O2
В митохондриях атомы водорода, отщепленные в виде Н+ от субстрата под действием фермента дегидрогеназы, связываются с кислородом:
4H+ + O2 + 4e- ® 2H2O
В природе у зеленых растений на свету идет процесс фотосинтеза, при котором поглощается СО2 и выделяется молекулярный кислород О2:
хлорофилл
6nCО2 + 5nН2О  (С6Н10О5)n + 6nО2 (С6Н10О5)n + 6nО2
свет
Озон. Аллотропное видоизменение кислорода – озон – на высоте 25 км над уровнем земли образует озоновый слой, который поглощает жесткое ультрафиолетовое излучение (l≤ 260 нм). Разрушение озонового слоя может привести к гибели живых организмов на Земле.
Вода. В организме взрослого человека массовая доля воды составляет 65%. Благодаря своему строению вода, является универсальным растворителем, практически все химические реакции в организме человека осуществляются в воде, жизнь без воды невозможна. Вода является одновременно средой и участником реакций гидролиза жиров, АДФ и АТФ:

При гидролизе в первую очередь разрывается связь 1, затем 2. При этом выделяется энергия, используемая организмом. Большая часть воды (около 70%) находится внутри клеток в протоплазме. Остальная часть воды (около 30%) – это внеклеточная вода, которая образует плазму крови и межтканевую воду.
2. Применение кислорода, озона, воды, пероксида водорода
в медицине и фармации
Oxygenium (кислород). Применяется при гипоксии, при гипоксемии; вдыхание газовой смеси, содержащей 40-50% кислорода, улучшает состояние больных. Оксигенотерапия показана также при отравлении угарным газом СО.
Carbogenum (карбоген) 95-97% О2; 5-3% СО2. Применяют при отравлении угарным газом для улучшения легочной вентиляции, используют также при шоковых состояниях, для возбуждения дыхательного центра во время наркоза.
Aqua purificata (вода очищенная). Используется для приготовления жидких лекарственных форм, растворов для иньекций, отваров, настоев; для приготовления реактивов, используемых в фарманализе.
Препараты водорода пероксида применяют наружно для обработки ран, полосканий полости рта и горла в качестве антисептических и дезодорирующих средств, а также кровоостанавливающих средств в стоматологии, отоларингологии, дерматологии.
Solutio Hydrogenii peroxydi diluta (раствор водорода перекиси 3%).
Perhydrolum (пергидрол) 28-30%.
Magnesii peroxуdum (магния перекись) (MgO2 + MgO).
Hydroperitum (гидроперит) – таблетки, содержащие комплекс мочевины с водорода пероксидом:
H2N − C − NH2 ´ H2O2
 
O
Токсическое действие озона, пероксида водорода
Озон.При большой концентрации озона в загрязненном выхлопными газами городов воздухе в организме человека возможна реакция озона с органическими веществами:
RH + O3 = RO2 + HO·
Эти радикалы инициируют радикально-цепные реакции с биоорганическими молекулами - липидами, белками, ДНК, что приводит к гибели клеток. На этой реакции основано применение озона для обеззараживания воды, озонирования воздуха.
Пероксид водорода. В организме человека пероксид водорода образуется в результате реакции:
2H+ + O2 + 2e- = H2O2
Из Н2О2 возможно образование радикалов
Н2О2 = 2НО·
Радикал НО· реагирует с биоорганическими веществами - липидами клеточных мембран, ДНК, нарушая её репаративную функцию, что приводит к неконтролируемому делению клеток и возникновению опухолей. В здоровом организме срабатывают защитные механизмы – под действием фермента каталазы Н2О2 разлагается:
2Н2O2 ® 2Н2О + О2
В старческом возрасте эти механизмы не срабатывают, в организме образуются радикалы, приводящие к массовой гибели клеток, старению организма и смерти.
Тема V. р-Элементы VI группы: сера, селен
1. Биологическая роль серы и селена
Сера. По содержанию в организме человека сера относится к макроэлементам (массовая доля 0,16%). Как и кислород, она жизненно необходима. Суточная потребность взрослого человека в сере около 4-5 г. Сера поступает в организм в виде неорганических и органических соединений, входящих в состав пищевых продуктов. Неорганические соединения серы (соли серной и сернистой кислот) не всасываются и выводятся из организма через кишечник. Органические соединения в организме расщепляются и всасываются в кишечнике. К элементам, способствующим усвоению серы, относятся F и Fe, а антагонистами серы являются As, Ba, Pb, Mo, Se.
Сера входит в состав многих биомолекул – белков, аминокислот (цистина, цистеина, метионина и др.), гормонов (например, инсулина), витаминов (например, витамина В1). Сера является компонентом структурного белка коллагена. Хондроитин-сульфат присутствует в коже, хрящах, ногтях, тканях миокарда. Серосодержащими метаболитами являются гемоглобин, эстрогены, фибриногены и др. Много серы содержится в структурных веществах волос, костях, нервной ткани.
Аминокислоты, содержащие серу, характеризуются наличием сульфгидрильных –SН-групп (например, цистеин) или наличием дисульфидных связей –S–S– (например, цистин). При окислении сульфгидрильных групп образуются дисульфидные связи и, наоборот, при восстановлении связей –S–S– образуются SН-группы, т.е. эти переходы обратимы:
R1–SH+R2–SH « R1–S–S–R2
В некоторой степени этот обратимый переход защищает организм от радиационных поражений. Под влиянием ионизирующего облучения в результате радиолиза воды в организме образуются свободные радикалы, в том числе Н· и ·ОН, активизирующие процессы окисления. Сульфгидрильные группы вступают в реакции со свободными радикалами:
RSH + ·ОН ® RS· + H2О.
Образующиеся радикалы RS· малоактивны. Тем самым предотвращается воздействие активных радикалов (·ОН) на нуклеиновые кислоты.
В живых организмах сера, входящая в состав аминокислот, окисляется. Конечными продуктами этого процесса преимущественно являются сульфаты. Также образуются тиосульфаты, элементарная сера и политионовые кислоты:
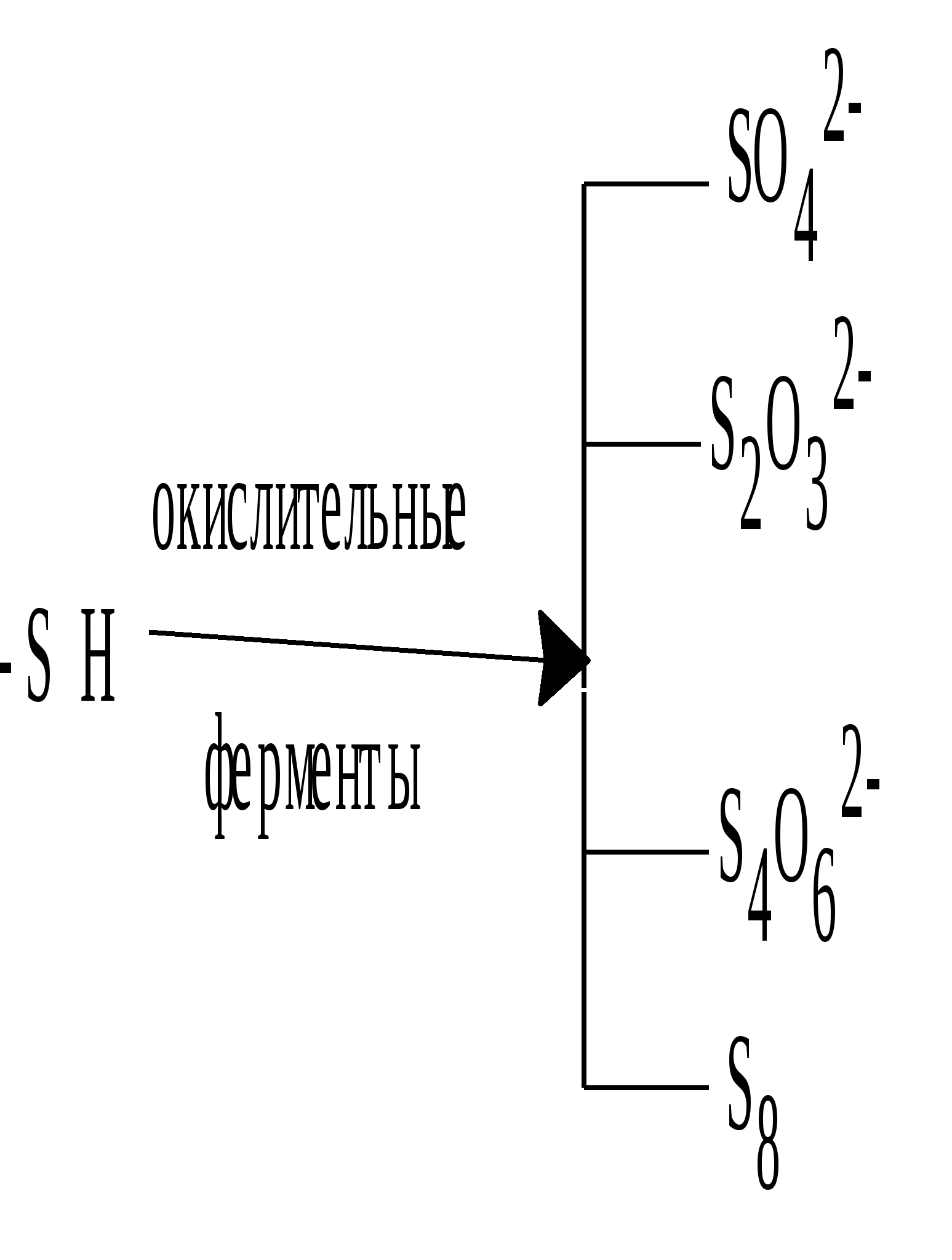
Образующаяся в организме эндогенная серная кислота участвует в обезвреживании ядовитых соединений – фенола, крезола, индола, вырабатываемых в кишечнике из аминокислот микробами. Кроме того, серная кислота связывает многие чужеродные для организма соединения (ксенобиотики) – лекарственные препараты и их метаболиты. Со всеми этими соединениями серная кислота образует относительно безвредные вещества – конъюгаты, в виде которых они и выводятся из организма. Например, с мочой человека выделяется конъюгат – калиевая соль сернокислого эфира фенола:

Практические данные о нарушениях, связанных с дефицитом серы в организме человека, немногочисленны. Экспериментально установлено, что недостаток метионина в пище тормозит рост молодых животных и снижает продуктивность взрослых животных. Поскольку метионин участвует в синтезе некоторых важных серосодержащих соединений (цистеина, глутатиона, биотина, тиамина, липоевой кислоты и др.), то проявления недостатка в организме этих веществ можно в определенной степени относить к симптомам дефицита серы.
Селен. По содержанию в организме селен относится к микроэлементам (массовая доля 10-5-10-7 %). Некоторые исследователи считают его жизненно необходимым элементом. Суточная потребность человека в селене составляет 20-100 мкг. Селен поступает в организм с пищей. Всасывание селена происходит в тонком кишечнике, где из растворимых соединений селена образуются соединения селена с метионином и цистеином. Усвоению селена способствует витамин Е. Накапливается селен в основном в печени и почках, а также в ногтях и волосах, костном мозге, сердечной мышце, поджелудочной железе, легких, коже. Концентрация селена в крови составляет 0,001-0,004 ммоль/л.
В живых организмах селен, как и сера, входит в состав биосубстратов в степени окисления -2. Вследствие близости химических свойств этих элементов, они могут замещать друг друга в соединениях. При этом селен может выступать как синергистом, так и антагонистом серы. При поступлении в организм в больших дозах селен в первую очередь накапливается в ногтях и волосах, основу которых составляют серосодержащие аминокислоты цистеин и метионин. Очевидно, что при этом селен, как аналог серы, замещает её в этих аминокислотах, превращая их в селеноцистеин и селенометионин. Установлено, что эти необычные аминокислоты входят в состав активных центров нескольких ферментов: формиатдегидрогеназы, глутатионредуктазы и глутатионпероксидазы, обеспечивая их высокую ферментативную активность. В то же время замещение группы –SH на группу –SeH в ряде ферментов приводит к снижению их дегидрогеназной активности и ингибированию клеточного дыхания.
Селен является элементом, выполняющим многочисленные защитные функции в организме, усиливает иммунную защиту организма, способствует увеличению продолжительности жизни. Установлена зависимость между высоким содержанием селена в пище и низкой смертностью от рака.
Хорошо известна способность селена предохранять организм от отравления соединениями ртути и кадмия. Причем селен способствует связыванию катионов этих металлов не селенсодержащими группами метаболитов, а другими активными центрами, на которые их токсическое действие не оказывает влияния. При дефиците селена в организме происходит усиленное накопление ртути, кадмия и мышьяка.
Недостаток селена в организме приводит к нарушению целостности клеточных мембран, значительному снижению активности сгруппированных на них ферментов, накоплению кальция внутри клеток, нарушению метаболизма аминокислот, снижению энергопродуцирующих процессов.
2. Лечебное действие неорганических соединений серы
В медицинской практике широко применяют как саму серу, так и многие её соединения.
Порошок «серы осажденной» применяют наружно в виде мазей и присыпок при лечении кожных заболеваний. В организме образуются продукты окисления серы – политионовые кислоты с общей формулой H2SXO6 (х = 3-6). Эти продукты обладают противомикробной и противопаразитарной активностью. На этом же основано применение «серы очищенной».
Тиосульфат натрия (Na2S2O3∙5H2O) применяют как детоксицирующее и противовоспалительное средство. Как детоксицирующее средство его используют при отравлениях соединениями ртути, свинца, синильной кислотой (HCN) и её солями, солями йода и брома. Механизм действия препарата, очевидно, связан с окислением тиосульфат-иона до сульфит-иона и элементарной серы:
S2O32- ® SO32- +S0.
Ионы свинца и ртути, попадающие в организм с пищей или воздухом, образуют плохорастворимые нетоксичные сульфиты:
Pb2+ + SO32- ® PbSO3¯.
Цианид-ионы взаимодействуют с элементарной серой, образуя менее ядовитые тиоцианаты:
CN- + S0 ® SCN-.
Применяют тиосульфат натрия и для лечения чесотки. После втирания в кожу 60% раствора Na2S2O3 делают повторные втирания 6%-ного раствора НС1. В результате реакции с НС1 тиосульфат натрия распадается на серу и оксид серы (IV):
Na2S2O3 + 2HCl ® 2NaCl + SO2↑ + S + H2O,
которые и оказывают губительное действие на чесоточных клещей.
Слабительный эффект Na2SO4∙10H2O и MgSO4∙7H2O, так же как и других солевых слабительных, связан преимущественно с медленным всасыванием из кишечника и увеличением в полости кишечника осмотического давления: под влиянием препарата происходит накопление воды в кишечнике, содержимое его разжижается, перистальтика усиливается и каловые массы быстрее выводятся.
Применение неорганических соединений серы и селена
в медицине и фармации
Sulfur praecipitatum (сера осажденная) S. Применяют наружно в виде мазей (5-10-20%) и присыпок при лечении кожных заболеваний (себореи, сикоза, псориаза, чесотки и др.).
Sulfur depuratum (сера очищенная) S. Применяют внутрь в качестве противоглистного и легкого слабительного средства, а наружно в 5-10-20% мазях и присыпках при лечении кожных заболеваний (себореи, сикоза, псориаза, чесотки и др.). Входит в состав сложного порошка солодкового корня, применяемого в качестве легкого слабительного.
Natrii sulfas (натрия сульфат) Na2SO4∙10H2O. Назначают внутрь в качестве слабительного средства, показан при пищевых отравлениях, так как не только очищает кишечник, но и задерживает всасывание яда и поступление его в кровь.
Natrii thiosulfas (натрия тиосульфат) Na2S2O3∙5H2O. Применяют внутривенно в виде водного 30% раствора и внутрь в виде 10% раствора как противотоксическое, противовоспалительное средство, при аллергических заболеваниях, артритах, невралгиях. Наружно применяют для лечения больных чесоткой.
Magnesii sulfas (магния сульфат) MgSO4∙7H2O. Применяют в качестве успокаивающего, противосудорожного, спазмолитического, слабительного, желчегонного средства, при лечении гипертонической болезни, а также при отравлениях ртутью, мышьяком, тетраэтилсвинцом, солями бария. Назначают внутрь в виде водных растворов, внутримышечно и внутривенно (20% или 25% растворы).
В аналитической практике широко применяется метод йодиметрического титрования. Из неорганических веществ этим методом анализируют I2, KMnO4, Na3AsO4, HgCl2, CuSO4 и многие органические лекарственные препараты - формалин, акрихин, антипирин, анальгин, аскорбиновую кислоту и др. Применяют несколько вариантов метода. Основным веществом, используемым в качестве восстановителя в йодиметрии, является тиосульфат натрия, который реагирует с йодом по уравнению:
2Na2S2O3 + I2 ® Na2S4O6 + 2NaI
Тиосульфат применяют для титрования избытка йода, добавляемого в процессе титрования некоторых восстановителей, или йода, образующегося при взаимодействии йодидов с окислителями, например:
Cl2 + 2I- ® 2Cl- + I2
Реакции осаждения и растворения сульфидов и сульфатов катионов используются для обнаружения многих катионов. Сульфиды могут быть получены воздействием на соли металлов сероводорода или сульфидов щелочных металлов и аммония. Большинство сульфидов окрашено, например: РbS – черный; CdS – желтый; Ag2S – черный; MnS – телесный; Bi2S3 – черный; Sb2S3 – оранжевый. Катионы Ba2+, Сa2+, Sr2+ осаждаются серной кислотой в виде сульфатов, нерастворимых в кислотах и щелочах.
В медицине селен в виде селенита и селената натрия, селенцистеина, селенсодержащих дрожжей применяют для профилактики и лечения различных заболеваний. Селен оказывает лечебный эффект при кардиопатиях различной этиологии, при гепатитах, панкреатитах, заболеваниях кожи, уха, горла и носа. Общеизвестна роль селена в профилактике и лечении злокачественных новообразований. Радиоактивные изотопы селена используются для диагностики болезней поджелудочной железы и др.
|
|
|
 Скачать 0.59 Mb.
Скачать 0.59 Mb.




