|
|
отверв. Все ответы — копия. I. общая нозология Определение понятия болезнь
Причины стаза
• Ишемия и венозная гиперемия. Они приводят к стазу вследствие существенного замедления кровотока (при ишемии в связи со снижением притока артериальной крови, при венозной гиперемии в результате замедления или прекращения её оттока) и создания условий для образования и/или активации веществ, обусловливающих склеивание форменных элементов крови, формирования из них агрегатов и тромбов.
• Проагреганты — факторы, вызывающие агрегацию и агглютинацию форменных элементов крови.
Патогенез стаза 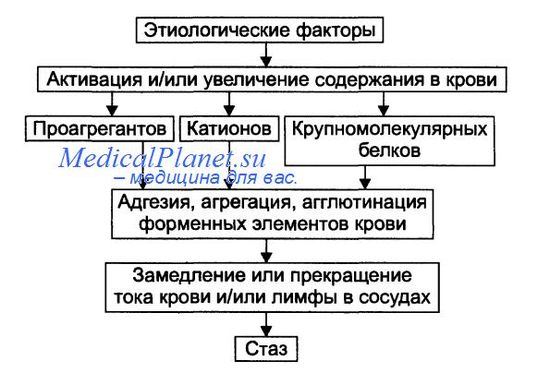
На финальном этапе стаза всегда происходит процесс агрегации и/или агглютинации форменных элементов крови, что приводит к сгущению крови и снижению её текучести. Этот процесс активируют проагреганты, катионы и высокомолекулярные белки.
Все разновидности стаза подразделяют на первичные и вторичные.
• Первичный (истинный) стаз. Формирование стаза первично начинается с активации форменных элементов крови и выделения ими большого количества проагрегантов и/или прокоагулянтов. На следующем этапе форменные элементы агрегируют, агглютинируют и прикрепляются к стенке микрососуда. Это и вызывает замедление или остановку кровотока в сосудах.
• Вторичный стаз (ишемический и застойный).
+ Ишемический стаз развивается как исход тяжёлой ишемии в связи со снижением притока артериальной крови, замедлением скорости её тока, турбулентным его характером. Это и приводит к агрегации и адгезии клеток крови.
+ Застойный (венозно-застойный) вариант стаза является результатом замедления оттока венозной крови, сгущения её, изменения физико-химических свойств, повреждения форменных элементов крови (в частности, в связи с гипоксией). В последующем клетки крови адгезируют друг с другом и со стенкой микрососудов.
Проявления стаза
При стазе происходят характерные изменения в сосудах микроциркуляторного русла:
• уменьшение внутреннего диаметра микрососудов при ишемическом стазе,
• увеличение просвета сосудов микроциркуляторного русла при застойном варианте стаза,
• большое количество агрегатов форменных элементов крови в просвете сосудов и на их стенках,
• микрокровоизлияния (чаще при застойном стазе).
В то же время проявления ишемии или венозной гиперемии могут перекрывать проявления стаза.
Последствия стаза
При быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается каких-либо существенных изменений.
Длительный стаз приводит к развитию дистрофических изменений в тканях, нередко — к гибели участка ткани или органа (инфаркт).
5.Эмболии, виды. Тромбоэмболии. Этиология, патогенез.
Эмболия - это закупорка сосудов эмболами, приносимыми током крови или лимфы.
Классификация эмболии:
I в зависимости от характера эмболов.
экзогенная (воздушная, газовая, бактериальная, паразитарная, плотными инородными телами);
эндогенная (тромбом, жиром, околоплодными водами, различными тканями).
эмболия большого круга кровообращения;
эмболия малого круга кровообращения;
эмболия системы воротной вены.
Тромбоэмболия.
Замедление кровотока и его нарушения. Фазы процесса тромбообразования:
клеточная - афезия, агрегация и агглютинация тромбоцитов;
плазматическая - фаза коагуляции.
Механизм клеточной фазы тромбообразования:
изменение электрического потенциала сосудистой стенки;
изменение заряда тромбоцитов и других клеток крови;
повышение адгезивно-агрегационной способности тромбоцитов.
С момента распада тромбоцитов и выхода тромбоцитарных факторов свертывания крови в окружающую среду начинается следующий этап тромбоза - плазматическая фаза.
I этап - образование тромбопластина при взаимодействии тканевых и плазменных компонентов системы свертывания крови.
II этап - образование активного тромбина из протромбина под действием протеолитического фермента тромбопластина.
III этап - превращение фибриногена в фибрин под влиянием тромбина.
Фибрин представляет основную массу тромба.
Заключительный этап свертывания крови - ретракция и уплотнение сгустка.
Для нормального течения ретракции необходимо наличие ионов кальция, глюкозы, АТФ, физиологическое течение гликолиза, определенные соотношения между концентрацией тромбина и фибриногена, а также фибриногена и тромбоцитов.
Последствия тромбоза:
приспособительное явление;
развитие некроза в бассейне тромбированного, лишенного коллатералей сосуда;
трофические нарушения с последующим развитием гангрены конечностей при атеросклерозе, сахарном диабете, облитерирующем эндартериите.
6. Воспаление. Этиология, основные признаки. (моя лекция,стадии воспаления по ней)
Воспаление - это типовой патологический процесс, возникающий под влиянием факторов экзогенной или эндогенной природы и характеризующийся стандартным комплексом сосудисто-тканевых изменений независимо от локализации процесса и характера этиологического фактора. Любой повреждающий агент, который по силе и длительности превосходит адаптационные возможности ткани, может вызвать воспаление. Все факторы принято делить на внешние (экзогенные) и внутренние (эндогенные).
К внешним относятся микроорганизмы (бактерии, вирусы, грибы), животные организмы (простейшие, черви, насекомые); химические вещества (кислоты, щелочи); механические (инородное тело, давление) и термические воздействия (холод, тепло); лучевая энергия (рентгеновские, радиоактивные, ультрафиолетовые лучи).
К эндогенным факторам относят те, которые возникают в самом организме в результате другого заболевания. Например, воспаление может возникнуть как реакция на опухоль, камни, тромб в сосудах. Причиной воспаления могут стать комплексы антиген - антитело, если они фиксируются в каком-либо органе.
Воспаление является типовым патологическим процессом, так как воспаление типично для многих заболеваний инфекционной и неинфекционной совокупностью патологических реакций и реакций компенсации, адаптации, защитно-приспособительных реакций.
В зависимости от реактивности организма выделяют следующие виды воспалительных реакций:
нормергическое воспаление, когда интенсивность воспаления адекватно соответствует силе действия патогенного фактора;
гиперергическая воспалительная реакция, когда интенсивность воспаления превышает силу действия патогенного агента (аллергические реакции);
гипоергическая воспалительная реакция - характерна для людей со сниженной реактивностью. В зависимости от характера доминирующего местного процесса различают три вида воспаления. При альтернативном воспалении преобладают повреждения, дистрофия, некроз. Оно наблюдается чаще всего в паренхиматозных органах при инфекционных заболеваниях, протекающих с выраженной интоксикацией (например, распад легких при туберкулезе).
Экссудативное воспаление характеризуется выраженным нарушением кровообращения с явлениями экссудации и эмиграции лейкоцитов.
По характеру экссудата различают серозное, гнойное, геморрагическое, фибринозное и смешанное воспаление.
Пролиферативное воспаление характерно для хронических специфических инфекций (при туберкулезе, сифилисе, лепре). При нем доминирует размножение клеток гематогенного и гистиогенного происхождения.
Признаки воспаления: боль, краснота, опухоль, повышение температуры, нарушение функции.
7. Теории воспаления. Понятие о структурно-функциональной единице воспаления
Как патологический процесс, лежащий в основе большинства заболеваний человека, воспаление является центральной проблемой патологии на протяжении всей истории учения о болезни. Соответственно формирование представлений о сущности воспаления издавна было тесно связано с развитием взглядов на природу болезни.
В экспериментальном периоде патологии на ранних его этапах доминировали теории воспаления Р. Вирхова (1858) и Ю. Конгейма (1885). Согласно клеточной (аттракционной, нутритивной) теории Р. Вирхова воспаление, заключается в нарушении жизнедеятельности клеточных элементов в ответ на раздражение, развитии дистрофических изменений, состоящих в появлении в клетках белковых зерен и глыбок, притяжении (аттракции) питательного (нутритивного) материала из жидкой части крови, возникновении вследствие этого мутного набухания цитоплазмы, характерного для воспаления.
По сосудистой теории Ю. Конгейма воспаление состоит в первую очередь в расстройствах кровообращения, приводящих к экссудации и эмиграции и обусловливающих последующие клеточные (дистрофические) изменения. Однако, как впоследствии было установлено, воспаление характеризуется одновременным развитием и тесной взаимосвязью сосудистых и тканевых явлений. Ю. Конгеймом впервые детально описана вся совокупность изменений сосудистого гонуса и кровотока с экссудацией и эмиграцией.
Особенно большой вклад в изучение воспаления внес И. И. Мечников (1892). Он положил начало сравнительной патологии воспаления, теории клеточного и гуморального иммунитета, учению о фагоцитозе и сформулировал биологическую (фагоцитарную) теорию воспаления. Согласно ей основным и центральным звеном воспалительного процесса является поглощение фагоцитами инородных частиц, в том числе бактерий.
Проанализировав воспалительную реакцию у животных видов, стоящих на разных ступенях эволюционного развития, И. И. Мечников показал ее усложнение в филогенезе. На ранних этапах филогенеза (у простейших одноклеточных организмов)' защита от вредных начал осуществляется путем фагоцитоза. При этом и у простейших организмов возникают некоторые явления альтерации. У многоклеточных организмов, не имеющих сосудистой системы, воспаление проявляется скоплением вокруг места повреждения фагоцитирующих амебоидных клеток (амебоцитов). У высших беспозвоночных воспаление выражается скоплением в месте повреждения кровяных клеток — лимфогематоцитов. Несмотря на наличие у них кровеносной системы (открытого типа) сосудистые реакции, характерные для позвоночных, не возникают. Вместе .с тем уже на этом этапе эволюционного развития обнаруживаются явления пролиферации. У позвоночных животных и человека воспалительная реакция значительно усложняется за счет сосудистых явлений с экссудацией и эмиграцией, участия нервной системы. Результаты сравнительно-патологических исследований, свидетельствующие о вовлечений все более сложных новых защитных и приспособительных явлений по мере усложнения воспалительного процесса, позволили И. И. Мечникову показать значение воспаления как защитно-приспособительной реакции всего организма. И. И. Мечников впервые установил связь воспаления с иммунитетом, в механизмах которого фагоцитоз также играет существенную роль.
В первой половине нынешнего столетия учение о воспалении стало развиваться в связи с возникновением биофизических и биохимических методов. Результаты разносторонних физико-химических исследований, воспалительного очага позволили Г.Шаде (1923) выдвинуть физико-химическую, или молекулярно-патологическую, гипотезу воспаления, согласно которой ведущим в патогенезе этого процесса является местное нарушение обмена веществ, приводящее к развитию ацидоза и повышению осмотического давления в ткани, лежащих, в свою очередь, в основе расстройств кровообращения и клеточных явлений при воспалении. Однако вскоре было показано, что физико-химические изменения характерные для очага воспаления, обнаруживаются в ходе уже развившейся воспалительной реакции и, сле-•довательно, не могут быть пусковым механизмом сосудистых и клеточных явлений [Альперн Д. Е., 1927]. При некоторых видах воспаления (аллергическое) ацидоз не развивается либо выражен слабо [Адо А, Д., 1935].
' На основании результатов широких пато-химических исследований В. Менкин (1938) пришел к выводу о ведущей роли биохимических сдвигов в патогенезе воспаления. Он предложил ряд специфических для воспаления веществ, опосредующих различные воспалительные, феномены, — не-крозин, экссудин, лейкотоксин, пирексин и др. Как установлено с тех пор, такую роль действительно выполняют физиологически активные вещества — медиаторы воспаления, многие из которых в настоящее время идентифицированы и достаточно изучены. Однако свести весь,патогенез воспаления только к разрозненным эффектам отдельных медиаторов было бы неправильным.
С начала нынешнего столетия, когда было установлено участие нервной системы в патогенезе воспаления, возникли гипотезы, отдающие первостепенную роль нервному фактору — рефлекторным механизмам, нарушению трофической функции нервной системы. Так, по вазомоторной (нервно-сосудистой) теории Г. Риккера (1924), первичным в возникновении воспаления является расстройство функции сосудодвига-тельных нервов. В зависимости от степени их раздражения и, следовательно, развивающейся сосудистой реакции складывается такое соотношение между тканью и кровью, которое ведет к возникновению воспалитель-. ной гиперемии и стаза и соответственно обусловливает интенсивность и характер нарушений обмена веществ. Однако вся совокупность воспалительных явлений не может быть объяснена только реакцией вазомоторов.
Д. Е. Альперн (1959) особое внимание уделял вопросу о единстве местного и общего в воспалении, о зависимости очага от реактивности организма. Он подчеркивал сущность воспаления как общей реакции организма на действие вредного агента. Им предложена нервно-рефлекторная схема патогенеза воспаления, в которой роль различных сосудисто-тканевых реакций предстает в их взаимосвязи под инициирующим- и регулирующим влиянием нервной системы, ее рефлекторных механизмов с участием гормонов эндокринных желез, главным образом гипофизарно-надпочечни-ковой системы.
8. Характеристика стадий воспалительного процесса(по моей лекции)
Различаются 4 стадии:
1. альтерация (alteratio),
2. экссудация (exsudatio),
3. эмиграция (emigratio),
4. пролиферация (proliferatio).
Альтерация (дистрофия, некроз) - первая фаза тканевых изменений в зоне воспаления характеризуется избыточным освобождением биологически активных веществ, лизосомальных ферментов, а, соответственно, стойким нарушением структуры и функции ткани. Общие закономерности альтерации независимы от специфики функции клеток: повышается проницаемость, нарушается структура и функция биологических мембран клеток, подавляется активность Na+-K+-АТФз. В зоне любой альтерации происходит движение в клетку, калий из клетки, что приводит к деполяризации в центре некроза, реполяризация невозможна из-за резкого повышения проницаемости клеточных мембран. Клетки перестают функционировать, выпадает болевая (термическая) чувствительность.
По периферии альтерации возникает частичная деполяризация. Клетки становятся возбудимыми, возрастает их функция, усиливается и болевая чувствительность, которая приводит к появлению боли (dolor).
В зоне альтерации отмечаются набухания митохондрий, просветление их матрикса, дезорганизация юрист, дефицит АТФ и угнетение всех энергозависимых процессов в клетке. Всегда повышается проницаемость мембран лизосом, активируются их форматы, которые выходят в цитоплазму. Начинается аутолиз клеток, распад их соединительной ткани под действием коллагеназы, элластазы, разрушающих белковый остов соединительной ткани. Фосфолипаза А2 лизосом индуцирует образование эйкозалоидов: простагландинов, тромбоксана, лейкотриенов. Идет распад лецитина, который становится источником образования полиненасыщенных жирных кислот.
Активируется фермент липоксигеназа, который приводит к трансформации незаменимых кислот в лейкотриены А, В, С, Д, Е. Эти липопептиды, обладающие выраженным вазоактивным действием, которое вызывает расширение сосудов, повышает их проницаемость, стимулирует процессы эмиграции лейкоцитов и экссудации. Активация аракидановой кислоты провидит к активации простагландинсинтетазы. Архидоновая и ланолиновая кислота трансформируются в простагландин G2. В процессе метаболизма простагландинов образуется большое количество свободных радикалов, повреждающих мембраны клеток.
Простагландин G2 метаболизируется при участии фермента простациклинсинтетазы в простациклин Y2. Этого фермента много в эндотелии сосудов. В норме простаципия препятствует спазму сосудов, вызывает умеренную дилятацию микроциркуляторного русла, препятствует агрегации и адгезии тромбоцитов, препятствует развитию тромбоза. Простагландины G2 при участии тромбоксансинтетазы тромбоцитов метаболизируются в тромбоксан.
В зоне альтерации наступает набухание эндотелия сосудов, его десквамация, обнажение, что вызывает активацию фактора Хагемана, приводящего к активации прокоагулянтной системы и возникновению тромбоза, активации калликреиновой системы. Эти ферменты действуют на белок плазмы крови - гликоген, отщепляющий от него активные пептиды - брадикинин, каллидин, вызывающие вазодилатацию сосудов. Кинины образуются и в тканях. Активация их возникает при сдвиге рН в кислую сторону. Возникает адгезия и агрегация тромбоцитов и тромбообразование. Тромбоциты дегранулируют, вызывая выброс серотонина, АТФ в зону альтерации.
В цитоплазме тучных клеток находятся гранулы с биологически активными веществами. На действие любого повреждающего фактора возникает неспецифическая реакция дегрануляции и освобождение в окружающую среду биологически активных веществ: гистамина, гепарина, фактора агрегации и активации тромбоцитов, фактора хемотаксиса эозинофилов, которые стимулируют эмиграцию лейкоцитов.
Большая роль в развитии выполняется принадлежность фибробластам. Они обладают способностью размножаться в зоне альтерация и усиленно продуцируют основные компоненты соединительной ткани: проколлагены, эластин, ретикулин, хондроитинсульфаты, гиалуроновую кислоту. Начинается образование фибробластического барьера, который инкапсулирует зону альтерация. В зону альтерации проникают лимфоциты, эмигрируют монокины.
Все медиаторы зоны воспаления делят на:
медиаторы гуморального происхождения (кинины, медиаторы свертывания крови, система комплемента. С3а, С5а);
медиаторы клеточного происхождения, готовые или предсуществующие (медиаторы тучных клеток, серотонин, гепарин, лизосомальные ферменты);
медиаторы клеточного происхождения, вновь образующиеся (эйкозаноиды, лимфокины, монокины, свободные радикалы). Различают первичную альтерацию - повреждение в момент действия альтерирующего фактора ее границы соответствуют границам повреждающего фактора и вторичную альтерацию, обусловленную действием диффундирующих из зоны первичной альтерации в окружающие неповрежденные ткани биологически активных веществ, медиторов воспаления.
Вторичная альтерация отсрочена во времени. Параллельно с альтерацией возникают сосудистые изменения:
спазм сосудов (артериол), который носит рефлекторный характер и скоро проходит;
артериальная гиперемия - возникает вслед за спазмом артериол. Она является результатом образования в воспаленном очаге большого количеств вазоактивных веществ - медиаторов воспаления, которые расслабляют мышечные элементы стенки артериол и прекапилляров. Это вызывает увеличение притока артериальной крови, ускоряет ее движение, открывает капилляры, повышает давление в них. Кроме того, расширение приводящих сосудов возникает в результате паралича вазоконстрикторов, сдвига рН среды в сторону ацидоза, накопления ионов калия, понижения эластичности окружающей сосуды соединительной ткани. Через 30-60 минут артериальная гиперемия сменяется венозной.
Экссудация – выход жидкой части крови, электролитов, белков и клеток из сосудов в ткани.
Механизмы экссудации:
повышение проницаемости сосудистой стенки под влиянием медиаторов воспаления;
повышение внутрисосудистого гидростатического давления в связи с изменениями кровообращения в очаге воспаления;
повышение онкотического давления из-за увеличения содержания белка вне сосудистой стенки;
уменьшение внутрисосудистого онкотического давления в связи с потерей белка вместе с экссудатом;
повышение коллоидно-осмотического давления ткани в зоне альтерации;
активация цитокемсиса, когда эндотелиальные клетки начинают пропускать через себя плазму клетки и растворимые в ней соединения.
Фазы экссудации:
ранняя фаза экссудации возникает через 10-15 минут с момента действия альтернирующего фактора и достигает максимума через 30 минут. Обусловлена выбросом гистамина, серотонина, активаций калликреин-кининовой системы, системы комплимента;
поздняя фаза экссудации начинается чуть позже, достигает максимума через 4-7 часов. Может быстро свернуться, а может длиться до 3-4 суток. Обусловлены образованием эйкозаноидов, выбросом монолимфокинов, свободных радикалов, биологически активных веществ нейтрофилов.
Эмиграция - выход лейкоцитов за пределы сосудистого русла в зону альтерации.
Осуществляется путем проникновения через сосудистую стенку. В эмиграции лейкоцитов в очаг воспаления наблюдается определенная очередность: сначала эмигрируют нейтрофильные гранулоциты, затем моноциты, позже лимфоциты. Эту последовательность впервые описал И. И. Мечников. Более позднее проникновение моноцитов объясняется их меньшей хемотоксической чувствительностью.
Эмиграция нейтрофилов начинается через 10-12 минут, достигает максимума через 3-4 часа. При острых воспалительных процессах в зоне воспаления преобладают нейтрофилы (до 95 %). Миграция моноцитов начинается через 16-18 часов, массовая - в течение 3-4 суток.
Лимфоциты эмигрируют спустя сутки и преобладают в зоне хронического воспалительного процесса.
Механизмы эмиграции:
действие хемотропных веществ. В очаге воспаления осуществляется активное движение лейкоцитов и к химическим раздражителям. Это явление описал И.И. Мечников и назвал его хемотаксис.
Хемотропные вещества: продукты жизнедеятелности микроорганизмов, продукты протеолиза тканей, продукты нибринолиза.
Компоненты комплемента С3 и С5, компоненты калликреин-кининовой системы, лимфокины, лейкотриены.
Хемоатрактанты взаимодействуют со специфическими рецепторами на мембране лейкоцитов. Возникает метаболический взрыв, образуются свободные радикалы. Мембрана начинает синтезировать адгезивные гликопротеины, понижается поверхностное натяжение мембраны и создаются условия для формирования псевдоподий. Одновременно возникает активация актино-миозиновых комплексов, что ведет к сократительному акту, и клетка передвигается в зону образования псевдоподий.
Поглощение объекта лейкоцитами может происходить двумя способами: контактирующий с объектом участок цитоплазмы втягивается внутрь клетки, а вместе с ним втягивается и объект. Второй способ заключается в том, что фагоцит прилагается к объекту своими псевдоподиями, а потом всем телом подтягивает в сторону объекта и обволакивает его. В итоге образуется фагосома, к которой приближается лизосома и начинается переваривание под действием лизосомальных ферментов;
развитие тромбоза, эмболии, изменение реологических свойств крови: повышение вязкости и снижение скорости кровотока;
повышение адгезивности эндотелиальных клеток;
повышение проницаемости сосудистой стенки под влиянием биологически активных веществ, медиаторов воспаления, лизосомальных ферментов;
действие электроэнергетических сил.
В зоне альтерации нормируется положительный потенциал за счет избыточного накопления Н+, а лейкоциты на своей поверхности несут суммарный отрицательный Z-потенциал.
Пролиферация — компонент воспалительного процесса и завершающая его стадия — характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток, а также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию альтерированных и/или замещение разрушенных тканевых элементов. Существенное значение на этой стадии воспаления имеют различные БАВ, в особенности стимулирующие пролиферацию клеток (митогены).
Пролиферативные процессы при остром воспалении начинаются вскоре после воздействия флогогенного фактора на ткань и более выражены по периферии зоны воспаления. Одним из условий оптимального течения пролиферации является затухание процессов альтерации и экссудации.
Формы и степень пролиферации органоспецифических клеток различны и определяются характером клеточных популяций.
• У части органов и тканей (например, печени, кожи, ЖКТ, дыхательных путей) клетки обладают высокой пролиферативной способностью, достаточной для ликвидации дефекта структур в очаге воспаления.
• У других органов и тканей эта способность весьма ограничена (например, у тканей сухожилий, хрящей, связок, почек и др.).
• У ряда органов и тканей паренхиматозные клетки практически не обладают пролиферативной активностью (например, миоциты сердечной мышцы, нейроны). В связи с этим при завершении воспалительного процесса в тканях миокарда и нервной системы на месте очага воспаления пролифе-рируют клетки стромы, в основном фибробласты, которые образуют и неклеточные структуры. В результате этого формируется соединительнотканный рубец. Вместе с тем известно, что паренхиматозные клетки указанных тканей обладают высокой способностью к гипертрофии и гиперплазии субклеточных структур.
Активация пролиферативных процессов коррелирует с образованием БАВ, обладающих антивоспалительным эффектом (своеобразных противовоспалительных медиаторов). К числу наиболее действенных среди них относятся:
• ингибиторы гидролаз, в частности протеаз (например, антитрипсина), р-микроглобулина, плазмина или факторов комплемента;
• антиоксиданты (например, церулоплазмин, гаптоглобин, пероксидазы, СОД);
• полиамины (например, путресцин, спермин, кадаверин);
• глюкокортикоиды;
• гепарин (подавляющий адгезию и агрегацию лейкоцитов, активность кининов, биогенных аминов, факторов комплемента).
Замещение погибших и повреждённых при воспалении тканевых элементов отмечается после деструкции и элиминации их (этот процесс получил название раневого очищения).
9. Особенности обмена веществ и физико-химические нарушения в очаге воспаления
Альтерация - это главное звено, по сути - пусковой механизм. Альтерация может быть первичная или вторичная. Первичная альтерация развивается сразу после воздействия повреждающего фактора и формируется на уровне функционального элемента органа. Первичная альтерация может проявляться специфическими изменениями, а также неспецифическими изменениями, которые развиваются стереотипно независимо от свойств и особенностей действия патогенного фактора. Эти изменения связаны:
1) с повреждением мембранных структур,
2) с повреждением мембраны митохондрий,
3) с повреждением лизосом.
Нарушения структуры мембраны клеток ведет к нарушению клеточных насосов. Отсюда теряется способность клетки адекватно реагировать изменением собственного метаболизма на изменения гомеостаза окружающей среды, изменяются ферментативные системы и митохондрии. В клетке накапливаются недоокисленные продукты обмена: пировиноградная, молочная и янтарная кислоты. Первоначально эти изменения являются обратимыми и могут исчезнуть, если этиологический фактор прекратил свое действие. Клетка полностью восстанавливает свои функции. Если же повреждение продолжается и в процесс вовлекаются лизосомы, то изменения носят необратимый характер. Поэтому лизосомы называют "стартовыми площадками воспаления" и именно с них начинается формирование вторичной альтерации.
Вторичная альтерация обусловлена повреждающим действием лизосомальных ферментов. Усиливаются процессы гликолиза, липолиза и протеолиза. В результате распада белков в тканях увеличивается количество полипептидов и аминокислот; при распаде жиров возрастают жирные кислоты; нарушения углеводного обмена ведет к накоплению молочной кислоты. Все это вызывает физико-химические нарушения в тканях и развиваются гиперосмия с повышением концентрации ионов K+, Na+, Ca2+, Cl-; гиперонкия - повышение количества белковых молекул из-за распада крупных на более мелкие; гипериония H+ - в связи с диссоциацией большого количества кислот с высвобождением ионов водорода. И как следствие всего этого - развивается метаболический ацидоз в связи с повышением кислых продуктов обмена. В процесс вовлекаются все компоненты ткани и альтерация носит необратимый характер, итогом которого будет аутолиз клеток. Образуются вещества, которые могут не только усиливать, но и ослаблять альтерацию, оказывая влияние на различные компоненты воспаления, т.е. регулируя микроциркуляцию, экссудацию, эмиграцию лейкоцитов и пролиферацию клеток соединительной ткани.
10. Нарушения микроциркуляции в очаге воспаления
Нарушение микроциркуляции в очаге воспаления характеризуется изменением тонуса микроциркуляторных сосудов, усиленным током жидкой части крови за пределы сосуда (т.е. экссудацией) и выходом форменных элементов крови (т.е. эмиграцией).
Для сосудистой реакции характерны 4 стадии:
1) кратковременный спазм сосудов,
2) артериальная гиперемия,
3) венозная гиперемия,
4) стаз.
Спазм сосудов возникает при действии повреждающего агента на ткани и связан с тем, что вазоконстрикторы возбуждаются первыми, поскольку они чувствительнее вазодилятаторов. Спазм длится до 40 секунд и быстро сменяется артериальной гиперемией. Артериальная гиперемия формируется следующими тремя путями: а) как результат паралича вазоконстрикторов; б) как результат воздействия медиаторов с сосудорасширяющей активностью; в) как результат реализации аксон-рефлекса.
Расслабляются прекапиллярные сфинктеры, увеличивается число функционирующих капилляров и кровоток через сосуды поврежденного участка может в десятки раз превышать таковой неповрежденной ткани.
Расширение микроциркуляторных сосудов, увеличение количества функционирующих капилляров и повышенное кровенаполнение органа определяет первый макроскопический признак воспаления - покраснение. Если воспаление развивается в коже, температура которой ниже температуры притекающей крови, то температура воспаленного участка повышается - возникает жар. Поскольку в первое время после повреждения линейная и объемная скорость кровотока в участке воспаления достаточно велики, то оттекающая из очага воспаления кровь содержит большее количество кислорода и меньшее количество восстановленного гемоглобина и поэтому имеет яркокрасную окраску. Артериальная гиперемия при воспалении сохраняется недолго (от 15 минут до часа) и всегда переходит в венозную гиперемию, при которой увеличенное кровенаполнение органа сочетается с замедлением и даже полным прекращением капиллярного кровотока.
Венозная гиперемия начинается с максимального расширения прекапиллярных сфинктеров, которые становятся нечувствительными к вазоконстрикторным стимулам и венозный отток затрудняется. После этого замедляется ток крови в капиллярах и приносящих артериолах. Главной причиной развития венозной гиперемии является экссудация - выход жидкой части крови из микроциркуляторного русла в окружающую ткань. Экссудация сопровождается повышением вязкости крови, периферическое сопротивление кровотоку возрастает, скорость тока крови падает. Кроме того, экссудат сдавливает венозные сосуды, что затрудняет венозный отток и также усиливает венозную гиперемию. Развитию венозной гиперемии способствует набухание в кислой среде форменных элементов крови, сгущение крови, нарушение десмосом, краевое стояние лейкоцитов, образование микротромбов. Кровоток постепенно замедляется и приобретает новые качественные особенности из-за повышения гидростатического давления в сосудах: кровь начинает двигаться толчкообразно, когда в момент систолы сердца кровь продвигается вперед, а в момент диастолы кровь останавливается. При дальнейшем повышении гидростатического давления кровь в систолу продвигается вперед, а в момент диастолы возвращается обратно - т.е.возникает маятникообразное движение. Толчкообразное и маятникообразное движение крови определяет возникновение пульсирующей боли. Постепенно экссудация вызывает развитие стаза - обычное явление при воспалении. Как правило, стаз возникает в отдельных сосудах венозной части микроциркуляторного русла из-за резкого повышения ее проницаемости. При этом жидкая часть крови быстро переходит во внесосудистое пространство и сосуд остается заполненным массой плотноприлежащих друг к другу форменных элементов крови. Высокая вязкость такой массы делает невозможным продвижение ее по сосудам и возникает стаз. Эритроциты образуют "монетные столбики", границы между ними постепенно стираются и образуется сплошная масса в просвете сосуда - сладж (от англ. sludge - тина, грязь).
11. Медиаторы воспаления, классификация, механизмы действия
Образование и реализация эффектов БАВ — одно из ключевых звеньев воспаления. БАВ обеспечивают закономерный характер развития воспаления, формирование его общих и местных проявлений, а также исходы воспаления. Именно поэтому БАВ нередко именуют как «пусковые факторы», «организаторы», «внутренний двигатель», «мотор» воспалительной реакции, «медиаторы воспаления».
Медиаторы воспаления - БАВ,
• образующиеся при воспалении,
• обеспечивающие закономерный характер его развития и исходов,
• формирование его местных и общих признаков.
Все медиаторы воспаления или их неактивные предшественники образуются в различных клетках организма. Тем не менее их подразделяют на клеточные и плазменные.
Клеточные медиаторы высвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились.
Плазменные медиаторы образуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но не в активном состоянии, а в виде предшественников. Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани.
|
|
|
 Скачать 1.85 Mb.
Скачать 1.85 Mb.
