Соляная кислота. II. Производство соляной кислоты
 Скачать 112.17 Kb. Скачать 112.17 Kb.
|
|
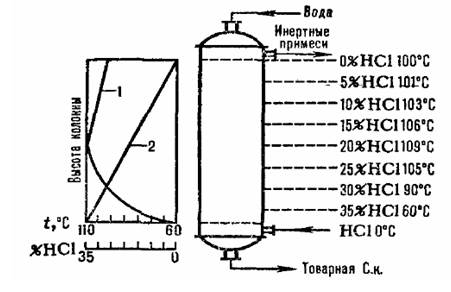
II. Производство соляной кислоты. Соляная кислота представляет собой раствор газообразного хлористого водорода HCl в воде. Последний представляет собой гигроскопичный бесцветный газ с резким запахом. Обычно употребляемая концентрированная соляная кислота содержит 36 – 38% хлористого водорода и имеет плотность 1,19 г/см3 . Такая кислота дымит на воздухе, так как из неё выделяется газообразный HCl; при соединении с влагой воздуха образуются мельчайшие капельки соляной кислоты. Чистая кислота бесцветна, а техническая имеет желтоватый оттенок, вызванный следами соединений железа, хлора и других элементов (FeCl3 ). Часто применяют разбавленную кислоту, содержащую 10% и меньше хлористого водорода. Разбавленные растворы не выделяют газообразного HCl и не дымят ни в сухом, ни во влажном воздухе. Соляная кислота представляет собой летучее соединение, так как при нагревании она улетучивается. Она является сильной кислотой и энергично взаимодействует с большинством металлов. Однако такие металлы, как золото, платина, серебро, вольфрам и свинец, соляной кислотой практически не травятся. Многие недрагоценные металлы, растворяясь в кислоте, образуют хлориды, например цинк: Zn + 2HCl = ZnCl2 + H2 . Процесс получения соляной кислоты имеет две стадии: 1) получение хлористого водорода; 2) абсорбция хлористого водорода водой. Соляная кислота применяется в химической, пищевой промышленности, цветной и черной металлургии. Кстати, известный факт, что соляная кислота содержится в желудочном соке (около 0,3 %) и играет важную роль, так как способствует перевариванию пищи и убивает различные болезнетворные бактерии (холеры, тифа и др.). Если последние попадают в желудок вместе с большим количеством воды, то вследствие разбавления раствора НСl они выживают и вызывают заболевание организма. Поэтому во время эпидемий особенно опасна сырая вода. При повышении концентрации НСl в желудке ощущается «изжога», которую устраняют, принимая внутрь небольшое количество NаНСО3 или МgО. Наоборот, при недостаточной кислотности желудочного сока соляная кислота прописывается для приема внутрь. Производство кислоты соляной освоено в 1962 году. За период эксплуатации производился ремонт, усовершенствовалось технологическое оборудование. Высокое качество сырья позволяет получать кислоту высокого качества. Кислота соляная также применяется в производстве пластмасс, ядохимикатов, полупродуктов и красителей для очистки поверхности металлов от окислов, карбонатов, в электротехнической, текстильной промышленности. Кислота соляная ингибированная Марка А – применяется для кислотной обработки скважин в нефтяной промышленности с целью улучшения сообщаемости скважин с пластом (для расширения и очистки пор и трещин, снятия фильтрационного сопротивления коллектора, сложенного карбонатными породами-доломитами и известняками, или загрязненного карбонатными отложениями). Кислота соляная марки Б – применяется для травления черных и некоторых цветных металлов и изделий из них, для химической очистки котлов и аппаратов от неорганических отложений. Соляную кислоту применяют для получения хлоридов Zn, Ba. Mg, Са, Fe, A1 и т. д., для травления при пайке и лужении, и цветной металлургии (извлечение Pt, An), при гидролизе древесины, в производстве красителей, для гидрохлорировании органических соединении и т. д. 1. Технология производства соляной кислоты. Соляная кислота (хлороводородная кислота), по химическому составу отвечающая хлориду водорода находит широкое применение в ряде отраслей народного хозяйства. В промышленности соляную кислоту получают следующими способами: - сульфатным; - синтетическим, - из абгазов (побочных газов) ряда процессов. Однако следует отметить, что первые два метода теряют свое промышленное значение. Производство соляной кислоты (реактивной, полученной сульфатным способом, синтетической абгазной) заключается в получении HCI с последующей его абсорбции водой. В зависимости от способа отвода теплоты абсорбции, которая достигает 72,8 кДж/моль процессы разделяются на изотермические (при постоянной температуре), адиабатические (без теплообмена с окружающей средой) и комбинированные. a) Сульфатные метод основан на взаимодействии хлорида натрия NaCl с концентрированной серной кислотой H2 SO4 при 500-550 С. Реакционные газы, отходящие от муфельных печей содержат 50-65% хлороводорода, а газы от реакторов с кипящим слоем до 5% HCI. В настоящее время предложено заменить серную кислоту на смесь SO2 и О2 с использованием в качестве катализатора Fe2 O3 и проведением процесса при температуре 540 С. b) В основе прямого синтеза соляной кислоты лежит цепная реакция горения: H2 + CI2 = 2HCI +184,7кДж (1) Реакция инициируется светом, влагой, твердыми пористыми веществами (древесный уголь, пористая платина) и некоторыми минеральными веществами (кварц, глина). Синтез в камерах сжигания ведут с избытком в 5-10% Н2. Камеры выполнены из стали, графита, кварца, огнеупорного кирпича. Наиболее современным материалом, предотвращающий загрязнение продукта является графит, импрегнированный фенолоформальдегидными смолами. Для предотвращения взрывного характера горения реагенты смешивают непосредственно в факеле пламени горелки. В верхней зоне камер сжигания устанавливают теплообменники для охлаждения реакционных газов до 150-160С. Мощность современных графитовых печей достигает 65 т/сут (в пересчете на соляную кислоту содержащую 35% HCI). В случае дефицита водорода применяют различные модификации процесса. Например, пропускают смесь CI2 c водяным паром через слой пористого раскаленного угля: CO+ H2O +CI2 = 2HCI+CO2 (2) Более 90% соляной кислоты в СНI в настоящее время получают их абгазного хлороводорода HCI, образующегося при хлорировании и дегидрохлорировании органических соединений, пиролизе хлорорганических отходов, хлоридов металлов, получении калийных нехлорированных удобрений и др. Абгазные газы содержат различные количества хлороводорода, инертные примеси (N2 H2 CH4 ), малорастворимые в воде органические вещества (хлорбензол, хлорметаны), водорастворимые вещества (уксусная кислота, хлораль), кислые примеси и воду. В промышленности для получения соляной кислоты наиболее широко применяют схемы адиабатической абсорбции. Абгазные газы вводят в нижнюю часть абсорбера, а воду (или разбавленную соляную кислоту – противотоком в верхнюю. Соляная кислота нагревается до температуры кипения благодаря температуре растворения HCI. Зависимость изменения температуры абсорбции и концентрации HCI показана на рис. 1
Рис. 1. Схема распределения температур (кривая 1) и концентрации (кривая 2) HCI при высоте адиаботического абсорбера Температура абсорбции определяется температурой кипения кислоты соответствующей концентрации, максимальная температура кипения азеотропной смеси находится около 110С. Типовая схема адиабатической абсорбции HCI из абгазов, образующихся при хлорировании, представлена на рисунке 2. Хлороводород поглощается в абсорбере 1, а остатки малорастворимых в воде органических веществ отделяют от воды после конденсации в аппарате 2, дочищают в хвостовой колонне 4 и сепараторах 3,5 и получают товарную соляную кислоту. 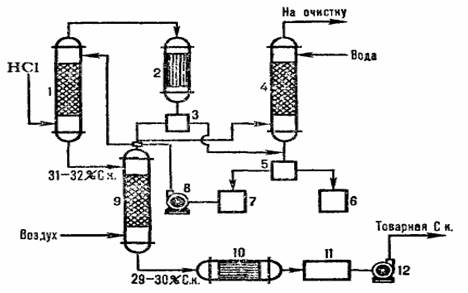 1 – абиабатический абсорбер; 2 – конденсатор; 3, 5 – сепараторы; 4 – хвостовая колонна; 6 – сборник органической фазы; сборник водной фазы; 8,12 – насосы; 9 – отдувочная колонна; 10- теплообменник, 11 – сборник товарной кислоты. Рис. 2. Схема типовой адиабатический абсорбции соляной кислоты из абгазов. Получение соляной кислоты из абгазных газов с использованием комбинированной схемы абсорбции представлено в виде типовой схемы на рис.3. В колонне адиабатической абсорбции получают соляную кислоту пониженной концентрации, но свободную от органических примесей. Кислоту с повышенной концентрацией HCI производят в колонне изотермической абсорбции при пониженной температуре. Степень извлечения HCI из абгазов при использовании в качестве абсорбентов разбавленных кислот составляет 90-95%. При использовании в качестве абсорбента чистой воды степень извлечения почти полная.  Рис. 3. Схема типовой комбинированной абсорбции соляной кислоты из абгазных газов. Хлористый водород используют для производства хлорорганических продуктов путем гидрохлорировании органических соединений, например этилена, ацетилена. 2. Упаковка и требования безопасности при работе с соляной кислотой. Техническую синтетическую соляную кислоту наливают в специальные гуммированные цистерны отправителя или получателя, гуммированные контейнеры, полиэтиленовые бочки вместимостью 50 дм3 и стеклянные бутыли вместимостью 20 дм3 согласно действующей нормативной документации. Стеклянные бутыли упаковывают в ящики типа V-1, номер 3-2 по ГОСТ 18573. Упаковка должна соответствовать ГОСТ 26319. Допускается заливать продукт в цистерны и контейнеры с остатком соляной кислоты, если анализ остатка подтверждает соответствие его качества требованиям настоящего стандарта, В противном случае остаток соляной кислоты удаляют, а цистерну или контейнер промывают. Бочки и бутыли должны быть сухими и чистыми. Наливные люки цистерн, контейнеров и пробки бочек должны быть герметизированы резиновыми или полиэтиленовыми прокладками, как при отправке потребителям (заполненных кислотой), так и при возврате поставщику порожней тары. Горловины бутылей, укупоренные притертыми стеклянными пробками или завинчивающимися крышками, должны быть обернуты полиэтиленовой пленкой и завязаны шпагатом. Уровень (степень) заполнения цистерн, контейнеров, бочек и бутылей вычисляют с учетом максимального использования грузоподъемности (вместимости) и объемного расширения продукта при возможном перепаде температуры в пути следования. Техническая синтетическая соляная кислота - едкая жидкость, стабильная в химическом отношении. На воздухе «дымит» в результате выделения хлористого водорода и притяжения им влаги воздуха с образованием кислотного тумана. Металлы, расположенные в ряду напряжений левее водорода (Al, Zn, Fe, Со, Ni, Pb и др), вытесняют его из соляной кислоты, что может привести к образованию взрывоопасных водородо-воздушных смесей. Меры безопасности - исключение контакта соляной кислоты с этими металлами за счет антикоррозионных покрытий, продувки азотом и проверки газовой фазы из оборудования и трубопроводов на взрываемость перед проведением огневых работ. Туман соляной кислоты раздражает верхние дыхательные пути и слизистые оболочки глаз. При попадании на кожу - вызывает ожоги. Согласно ГОСТ 12Л.005 предельно допустимая концентрация (ПДК) паров соляной кислоты в воздухе рабочей зоны - 5 мг/м3 , класс опасности - 2 (вещества высокоопасные. Соляная кислота обладают остронаправленным механизмом действия. При работе с ними необходима специальная защита кожи и глаз, определение хлористого водорода, хлора - согласно действующей нормативной документации. Точки отбора проб должны быть согласованы с местными органами санэпидслужбы. Оценка состояния воздушной среды при одновременном присутствии хлора и хлористого водорода - согласно ГОСТ 12.1.005. Технологические процессы получения и применения соляной кислоты и используемое производственное оборудование должны соответствовать требованиям санитарных правил № 1042-73. Производственные помещения должны быть оборудованы вентиляцией согласно ГОСТ 12.4.021 и СНиП 2.04.05-91 и подводом воды, отвечающей требованиям ГОСТ 2874. Все работы с соляной кислотой должны проводиться в спецодежде типа К50 по ГОСТ 12.4.103 и в защитных очках типа Г по ГОСТ 12.4.013. Все работающие должны быть обеспечены промышленными фильтрующими противогазами марки В (СИЗОД ФГП, ФГ-130) по ГОСТ 12.4.12L В случае разлива соляную кислоту смывают с поверхностей пола и оборудования большим количеством воды или щелочного раствора. Кислые сточные воды перед поступлением в систему общезаводской канализации должны нейтрализоваться на локальных очистных установках. Тушение пожара производится с помощью распыленной воды и воздушно-механической пены. Некондиционный продукт нейтрализуют раствором щелочи. Газовые выбросы улавливают, нейтрализуют. Паспорт безопасности вещества. 1. Наименование и состав вещества. 1.1. Наименование. техническое (по НД): кислота соляная химическое (по IUPAC): гидрохлорид водный синонимы: хлористоводородная кислота, хлороводородная кислота 1.2. Состав.
1.3. Степень опасности продукта в целом. Продукция является промышленным ядом и едким веществом, высоко опасным по степени воздействия на организм. Необходима специальная защита кожи и глаз. 2. Виды опасного воздействия. 2.1. Воздействие на человека. Общая характеристика воздействия: Высоко опасное вещество с остронаправленным механизмом действия. Туман соляной кислоты обладает выраженным раздражающим действием на верхние дыхательные пути, кожу, глаза, вызывает тяжелые химические ожоги. Пути поступления: При вдыхании, при попадании на кожу и слизистые оболочки глаз, в органы пищеварения. Поражаемые органы, ткани и системы человека: Центральная нервная и дыхательная системы, желудочно-кишечный тракт, печень, почки, кожа, глаза. Наблюдаемые симптомы: При ингаляционном отравлении: кашель, першение в горле, слезотечение, насморк, нарушение ритма дыхания, удушье, охриплость голоса, загрудинные боли, рвота с кровью. При попадании внутрь организма: ожоги губ, слизистой полости рта, резкие боли в эпигастральной области, рвота с кровью, охриплость голоса, спазм и отек гортани, болевой шок, коллапс. При попадании в глаза: конъюнктивиты и поражения роговицы глаз, резь, возможно ослепление. При попадании на кожу: возникает серозное воспаление с пузырями, изъязвления появляются при сравнительно долгом контакте. 2.2. Воздействие на окружающую среду. Общая характеристика воздействия: Кислота соляная опасна для окружающей среды. Пути воздействия на окружающую среду: При нарушении правил хранения и транспортирования, вследствие аварийных ситуаций, неорганизованного размещения и захоронения отходов и т.д. Наблюдаемые признаки воздействия: Загрязнение атмосферного воздуха обнаруживается по наличию резкого выраженного запаха. Загрязнение водных объектов приводит к изменению органолептических свойств воды (появление характерного запаха и привкуса). При снижении водородного показателя в воде водоемов (pH<4,0) наблюдается токсическое действие на рыб уже через несколько часов. При этом кожные покровы и жабры покрываются слизью, респираторный эпителий, а затем жаберные листки разрушаются. Очень чувствительны к кислоте карпы, снижение pH до 4,8 является для них критическим. Гигиенические нормативы (предельно допустимые концентрации в различных объектах окружающей среды): ПДКср. =5 мг/м3 (пары); 2 кл. опасности; ПДКсс. =0,1 мг/м3 ; 2 кл. опасности; ПДКводы =350мг/л, орг. привкус; необходим контроль водородного показателя в воде (pH=6,5-8,5); 4 кл. опасности; ПДКрыб.хоз. (хлорид-анион)=300 мг/л; 4 кл. опасности (экологический); для морских водоемов – 11900 мг/л; необходим контроль водородного показателя в воде (pH=6,5-8,5). 3. Меры первой помощи. 3.1. При отравлении ингаляционном путем (при вдыхании): Придать пострадавшему горизонтальное положение; свежий воздух, питье теплого молока с питьевой содой; антигистаминные и противокашлевые препараты. Срочная госпитализация! 3.2. При отравлении пероральным путем (при проглатывании): Обильное питье холодной воды с кусочками льда, молока (по возможности с несколькими взбитыми сырыми яйцами или антацидными препаратами, не содержащими гидрокарбонаты); осторожно с введением карбонатов, нейтрализацией. Противопоказано вызывать рвоту искусственным путем! Срочная госпитализация! 3.3. При воздействии на кожу: Удалить избыток вещества ватным тампоном, смыть проточной водой в течение 10-15 мин. Срочная госпитализация! 3.4. При попадании в глаза: Немедленно промыть проточной водой или изотоническим раствором хлорида натрия или 4% раствором трисамина при широко раскрытой глазной щели в течение 10-15 мин. Срочная госпитализация! 3.5. Противопоказания: Вызывать рвоту искусственным путем противопоказано. 3.6. Средства первой помощи: Сода питьевая, антигистаминные и противокашлевые средства, растворы хлорида натрия или трисамина. 4. Меры и средства обеспечения пожаровзрывоопасности. 4.1. Общая характеристика пожаровзрывоопасности: Негорючая жидкость. 4.2. Показатели пожаровзрывоопасности: Отсутствуют. 4.3.Опасность, вызываемая продуктами горения и термодеструкции: Возможности термодеструкции нет. 4.4. Рекомендуемые средства тушения пожара: С помощью распыленной воды и воздушно-механической пены. Используются все средства пожаротушения по основному источнику возгорания (в очаг пожара первоначально вовлекается полимерная упаковка). 4.5. Запрещенные средства тушения пожаров: Сведения отсутствуют. 4.6. Средства индивидуальной защиты при тушении пожаров: Изолирующий защитный костюм КИХ-5 С в комплекте с изолирующим противогазом ИП-4М или дыхательным аппаратом АСВ-2. При отсутствии указанных образцов – защитный общевойсковой костюм Л-1 или Л-2 в комплекте с промышленным противогазом с патронами В с аэрозольным фильтром, БКФ, КД. 4.7. Специфика при тушении. Емкости с кислотой в зоне пожара могут взрываться при нагревании, требуется охлаждение водой с максимального расстояния. При взаимодействии со многими металлами (Al, Zn, Fe, Co, Ni, Pbи др.) выделяется водород, образующий с воздухом взрывоопасную смесь (объемные пределы взрываемости смеси водорода с воздухом 4-75%). 5. Меры по предотвращению и ликвидации чрезвычайных ситуаций. 5.1. Меры по предупреждению ЧС. Общие рекомендации: Герметизация оборудования, транспортных средств, тары, применение кислостойких материалов, вентиляция помещений, автоматический контроль содержания соляной кислоты в воздухе рабочей зоны. Применение СИЗ. Рекомендации по пожаровзрывобезопасности: Используются все средства пожаротушения по основному источнику возгорания (в очаг пожара первоначально вовлекается полимерная упаковка). Рекомендации по обращению и хранению: Избегать вдыхания паров кислоты. Не допускать разбрызгивания и проливов кислоты. Приливать кислоту в воду. Хранить в герметичных емкостях, использовать кислостойкие материалы. Не допускать совместного хранения со щелочами, органическими и горючими веществами, окислителями. Хранилища соляной кислоты устраивают на открытом воздухе или в неотапливаемых складских помещениях с хорошей вентиляцией. Рекомендации по обеспечению безопасности персонала (пользователя): Избегать вдыхания паров соляной кислоты, попадания её на кожный покров, глаза. Использовать СИЗ. Требуется вентиляция помещений. Герметизация оборудования, аппаратов, емкостей. Автоматический контроль вредных веществ в воздухе рабочей зоны. Соблюдать меры по обеспечению безопасности персонала. Рекомендации по защите окружающей среды: Не допускать пролива кислоты. Предотвращать попадание продукта в дренаж, канализацию, водоемы, почву. Систематический контроль вредных веществ в атмосферном воздухе на соответствие норм ПДК. Осуществлять контроль водородного показателя (pH=6,5-8,5) в воде водоемов. Рекомендации по транспортированию: Перевозится как опасный груз. 5.2. Меры по ликвидации ЧС. Необходимые действия общего характера: Изолировать опасную зону в радиусе не менее 50 м. Удалить посторонних. В опасную зону входить в защитных средствах. Держаться наветренной стороны. Избегать низких мест. Пострадавшим оказать первую помощь. Действия при утечке, разливе, россыпи: Сообщить в ЦСЭН. Не прикасаться к пролитому веществу. Устранить течь с соблюдением мер предосторожности. Перекачать содержимое в исправную сухую, защищенную от коррозии емкость или в емкость для слива с соблюдением условия смещения жидкостей. Проливы оградить земляным валом, провести нейтрализацию раствором щелочи, соды или известью или залить большим количеством воды с соблюдением мер предосторожности. Убрать по возможности из зоны аварии металлические изделия или защитить от попадания на них вещества. Не допускать попадания веществ в водоемы, подвалы, канализацию. Действия при пожаре: Охлаждать емкости водой с максимального расстояния. Действия при ликвидации последствий ЧС: Для рассеивания (осаждения, изоляции паров) использовать распыленную воду. Вещество откачать из пониженной местности с соблюдением мер предосторожности. Срезать поверхностный слой грунта с загрязнениями, собрать и вывезти для утилизации. Места срезов засыпать свежим слоем грунта. Поверхности подвижного состава промыть большим количеством воды, моющими композициями. 6. Правила обращения и хранения. 6.1. Меры безопасности и средства защиты при работе с веществом (материалом). Бесперебойная работа вентиляции. Герметизация оборудования и транспортной тары, использование материалов стойких к кислотам. Оборудование производственных помещений фонтанчиками с водой. Применение СИЗ. Предотвращать розливы кислоты. Автоматический контроль концентрации паров кислоты в воздухе рабочей зоны. Во время работы с кислотой запрещается принимать пищу, пить, курить. При разбавлении – приливать кислоту в воду. 6.2. Условия и сроки безопасного хранения. Кислоту соляную хранят в герметичных резервуарах изготовителя и потребителя, изготовленных из материалов, стойких к соляной кислоте. Срок хранения продукта неограничен. 6.3. Несовместимые при хранении вещества (материалы): Органические вещества, щелочи, окислители, ЛВЖ. 6.4. Материалы, рекомендуемые для тары и упаковки. Специальные гуммированные цистерны, гуммированные контейнеры, полиэтиленовые бочки, стеклянные бутыли, упакованные в ящики. Для прокладок – резина, полиэтилен, стекло, гуммированные материалы. 6.5. Рекомендации по безопасному перемещению и перевозке. Герметизация тары и цистерн с помощью прокладок. Заполнение цистерн и тары рассчитывают с учетом полного использования их вместимости и объемного расширения продукта, при возможном перепаде температур в пути следования. При перемещении в стеклянной таре обязательно применять обрешетку. 6.6. В быту. Кислоту соляную хранят в специальной таре, изготовленной из материалов, стойких к соляной кислоте. При применении соляной кислоты в быту избегать прямого контакта с продуктом, необходимо использовать средства защиты: очки, перчатки, фартук. При попадании кислоты на кожу или в глаза действовать в соответствии с разделом 3. 7. Требования по охране труда и меры по обеспечению безопасности персонала (пользователя). 7.1. Параметры рабочей зоны, подлежащие обязательному контролю. ПДКр.з. =5 мг/м3 (пары); 2 кл. 7.2. Меры обеспечения содержания вредных веществ в допустимых концентрациях. Строгое соблюдение параметров технологического режима. Герметизация оборудования, трубопроводов, емкостей для перевозки и хранения кислоты. Использование общеобменной и местной вытяжной вентиляции. Требуется автоматический контроль концентрации паров кислоты в воздухе рабочей зоны. Автоматический контроль концентрации паров кислоты в воздухе рабочей зоны. 7.3. Меры и средства защиты персонала. Общие рекомендации: Избегать прямого контакта с продуктом, для предотвращения любого контакта носить непроницаемую одежду. Оборудовать в производственных помещениях фонтанчики с водой для смыва кислоты. Обеспечить правильную организацию рабочих мест, надзор за наличием и исправным состоянием оборудования, приборов, инструмента, ограждений, предохранительных, вентиляционных и других санитарно-технических устройств. Оборудование должно быть герметичным и кислостойким. Использовать СИЗ. Защита органов дыхания: Промышленные фильтрующие противогазы марки B. При содержании паров соляной кислоты более 0,5% об., либо в аварийных ситуациях, следует применять шланговые противогазы типа ПШ или изолирующие воздушно-дыхательные аппараты АВХ. Защитная одежда (материал, тип): Спецодежда К50 по ГОСТ 12.4.103 из кислостойкой ткани (винитроновая ткань, лавсан или ткань, обработанная латексами). Фартук из неопрена, текстовинита. Сапоги из противокислотной резины. Защитные очки типа Г по ГОСТ 12.4.103. Резиновые перчатки, рукавицы «КР». В быту: Избегать прямого контакта с продуктом. 8. Физические и химические свойства. 8.1. Физическое состояние (агрегатное состояние, цвет, запах). Прозрачная желтая жидкость с резким выраженным запахом хлористого водорода. На воздухе дымит. Максимальная концентрация при 20°C равна 38 % по массе, плотность такого раствора 1,19 г/см³. 8.2. Параметры, характеризующие основные свойства вещества (материала), в первую очередь опасные. Физические свойства растворов соляной кислоты разных концентраций при 20°C, 1 атм.:
Растворимость в воде и органических растворителях: Растворимость соляной кислоты в углеводородах при 25°С и 0,1 МПа (мол.%): в пентане - 0,47, гексане - 1,12, гептане - 1,47, октане - 1,63. Растворимость соляной кислоты в алкил- и арилгалогенидах невелика. Растворимость при 10°С в ряде спиртов составляет примерно 1 моль/моль спирта, в эфирах карбоновых кислот 0,6 моль/моль, в карбоновых кислотах 0,2 моль/моль. В простых эфирах образуются устойчивые аддукты R2O · НСl. Растворение НСl в воде - сильно экзотермический процесс. 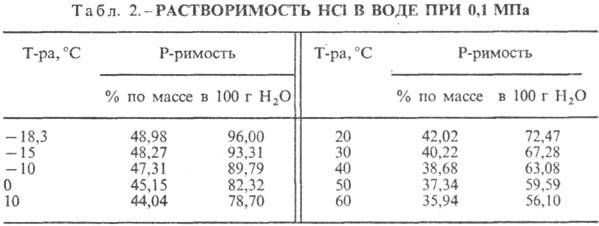 9. Стабильность и химическая активность. 9.1. Стабильность: На воздухе дымит в результате выделения хлористого водорода и притяжения им влаги воздуха с образованием кислотного тумана. 9.2. Реакционная способность: Реагирует с большинством металлов, кроме золота, серебра, платины, тантала, ниобия с образованием соли и выделением газообразного водорода, с оксидами металлов с образованием растворимой соли и воды, с гидроксидами металлов с образованием растворимой соли и воды. 9.3. Опасные проявления. Образование взрывоопасной воздушно-водородной смеси при контакте соляной кислоты с металлами. Реагируя с сильными окислителями, такими, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор. 10. Токсичность. 10.1. Оценка степени опасности (токсичности) воздействия на организм. Высокоопасное (высокотоксичное) вещество. 10.2. Показатели острой токсичности: DL (ЛД), CL (ЛК). Минимальная смертельная концентрация для человека при вдыхании в течение 30 минут – 1968 мг/м3 , в течение 5 минут – 4543 мг/м3 .
Дозы (концентрации), обладающие минимальным токсическим действием: ПКзап. =0,1 мг/м3 , инг., человек; Limir =15 мг/м3 , инг., человек (по действию на верхние дыхательные пути и слизистые оболочки глаз). 10.3. Сведения об опасных для здоровья воздействиях при непосредственном контакте с веществом, а также последствия этих воздействий (раздражающие действие на верхние дыхательные пути, глаза, кожу, включая кожно-резорбтивное действие; сенсибилизация). Оказывает раздражающее действие на верхние дыхательные пути (катары верхних дыхательных путей, развитие токсического отека легких, появление коричневых пятен и эрозий на коронках зубов, изъязвление слизистой оболочки носа, иногда её прободение), кожу (при ожоге возникает серозное воспаление с пузырями), глаза. Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем. При попадании концентрированного раствора в желудок – загрудинные боли, ожог полости рта, рвота с кровью, позже некрозы внутренних органов, перфорация пищевода и желудка, деструкция ВДП. Установлено кожно-резорбтивное действие: при резорбции – ацидоз, гепато- и нефропатия. Сенсибилизирующее действие не установлено. 10.4. Сведения об опасных отдаленных последствиях воздействия на организм (влияние на функцию воспроизведения, канцерогенность, кумулятивность и пр.). Эмбриотропное, тератогенное, мутагенное действия установлены. Гонадотропное действие не изучалось. Канцерогенное действие на человека не установлено; на животных – слабое (оценка МАИР: группа 3). Кумулятивность слабая. 10.5. Дополнительные сведения. При длительной работе с соляной кислотой наблюдаются катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. 11. Воздействие на окружающую среду. 11.1. Оценка возможных воздействий на окружающую среду (атмосферный воздух, почва, вода, биота). Кислота соляная опасна для окружающей среды (воздуха, почвы, воды). Загрязняет воздух и водоемы. Необходим контроль водородного показателя в воде водоемов (pH=6,5 – 8,5). 11.2. Наиболее важные характеристики воздействия на окружающую среду. Гигиенические нормативы (ПДК в атмосферном воздухе, воде, почве): ПДКатм.возд. =0,2/0,1 мг/м3 , рефл.-рез., 2 кл. опасности. ПДКводы (хлориды)=350мг/л, орг. привкус; необходим контроль водородного показателя в воде (pH=6,5-8,5); 4 кл. опасности. ПДКрыб.хоз. (хлорид-анион)=300 мг/л; 4 кл. опасности (экологический); для морских водоемов – 11900 мг/л; необходим контроль водородного показателя в воде (pH=6,5-8,5). Показатели экотоксичности: Стабильность в абиотических условиях (τ½ ) > 30 сут. (чрезвычайно стабильно). Острая токсичность для рыб:
Миграция и трансформация в окружающей среде: Не трансформируется. Биологическая диссимиляция: Не изучалась. 11.3. Дополнительные сведения. Согласно классификации по опасности загрязнения воды (WGK, Германия) вещество отнесено к классу 1 (слабоопасное вещество). |