Имплантация. Виды имплантатов, материалы, требования.. Имплантация опорноудерживающих конструкций. Виды имплантатов, материалы
 Скачать 294.5 Kb. Скачать 294.5 Kb.
|
|
www.spbgmu.ru Имплантация опорно-удерживающих конструкций.Виды имплантатов, материалы.По ученому пособию М. Ф. Сухарева, Р. Ш. Гветадзе, А. М. Шпыновой О показаниях и противопоказаниях к использованию метода имплантацииПоказания и противопоказания к имплантации окончательно определяются после сбора анамнеза и результатов обследования. Стоматологическую имплантацию целесообразно проводить при частичной потере зубов с включенными, концевыми и комбинированными дефектами зубного ряда. При полном отсутствии зубов имплантация показана для фиксации несъемных и съемных зубных протезов. Имплантация может быть использована при устранении травм челюстно-лицевой области, протезировании врожденных и приобретенных дефектов лица. Целью клинических и параклинических методов обследования является выявление противопоказаний к проведению имплантации, общего и местного характера. При планировании имплантации в качестве противопоказаний для ее проведения следует рассматривать наличие патологии щитовидной железы, когда наблюдается увеличение или снижение тиреоидных гормонов. При гипертиреозе происходит резорбция кости за счет снижения уровня ее минерализации. При заболеваниях паращитовидных желез наблюдается резорбция костной ткани вследствие гипокальциемии и недостатка витамина В. Сахарный диабет — это заболевание, которое связано с нарушением синтеза инсулина. При этом недостаток инсулина приводит к нарушению обмена в собственной костной ткани и снижению регенерации тканей организма. Заболевания коры надпочечников, вызванные большой выработкой кортизона, альдостерона и андрогенов, угнетают остеогенез. Деструкции и нарушения регенерации кости отмечаются при лимфогранулематозе, лейкозе, гемолитической анемии. Онкологические заболевания, особенно злокачественные опухоли, также относятся к противопоказаниям к проведению имплантации. Кроме того, после лечения онкологических заболеваний обычно проводится лучевая и химиотерапия, которые снижают возможности кости к регенерации и способствуют развитию остеопороза. К противопоказаниям к имплантации следует отнести психические заболевания: шизофрению, паранойю, а также пограничные состояния, в частности неврозы. Следует отметить и возможность развития канцерофобии, то есть возникновение суждений пациента о связи имплантации и возможности появления онкологической патологии. Алкоголизм и наркомания вызывают не только изменение в психике пациента, но и оказывают большое отрицательное влияние на обменные процессы в костной ткани. Опрашивая пациентов, необходимо выявить и заболевания, снижающие сопротивляемость организма инфекциям. Врожденные или приобретенные заболевания, которые развиваются в результате нарушений в иммунной системе организма. Наличие вируса иммунодефицита приводит к разрушению иммунной системы и развитию воспалительных осложнений после проведения оперативного вмешательства. При планировании имплантации необходимо учитывать заболевания костной системы, которые в основном встречаются в проявлениях первичного и вторичного остеопороза. При наличии аллергии к металлам необходимо предварительно провести тесты для определения возможности внедрения металлических имплантатов и использования конкретных металлов для проведения имплантации и протезирования. Таким образом, абсолютные противопоказания к имплантации определяются наличием заболеваний, при которых проведение имплантации наносит вред здоровью пациента и делает невозможным прогнозирование положительных результатов имплантации и протезирования. Особо следует остановиться на противопоказаниях при наличии заболеваний жевательно-речевого аппарата. При планировании имплантации необходимо проводить предварительное лечение этих заболеваний для исключения риска возникновения воспалительных осложнений. К этим заболеваниям относятся: пародонтит и пародонтоз, лейкоплакия, стоматиты, аномальные виды прикуса, заболевания височно-нижнечелюстных суставов. Также необходимо учитывать наличие у пациента бруксизма и неудовлетворительной гигиены полости рта. При проведении имплантации у пациентов пожилого возраста положительный прогноз может быть сомнительным за счет снижения обменных процессов в тканях организма. Использование имплантатов в качестве опоры для различных конструкций съемных и несъемных зубных протезов существенно зависит от особенностей анатомического строения костей лицевого скелета. Современные конструкции дентальных имплантатов и материалы для их создания. Все известные конструкции имплантатов классифицируют • по форме: цилиндрические, винтовые и пластиночные; • по структуре поверхности внутрикостной части: пористые, пористые со сквозными отверстиями, пористые с напылением титана или гидроксиапатита; • по конструкции: неразборные или разборные имплантаты, с амортизатором или без амортизатора; • по методике применения: для непосредственной или отсроченной имплантации; • по способу соединения с зубным протезом: неразъемное и разъемное. Конструкция имплантата обоснована токсикологическими, биомеханическими свойствами материалов, из которых они созданы, а также возможностями современных технологий получения имплантатов фрезерованием, штамповкой и литьем. По форме внутрикостной части имплантаты могут быть цилиндрическими, винтовыми и пластиночными. У цилиндрических имплантатов внутрикостная часть может быть цельной или полой, когда в ней высверливается канал. Поверхность внутрикостной части полого имплантата может быть покрыта активным покрытием, и на ней имеются отверстия различного диаметра. Винтовые имплантаты в основном изготавливаются конической формы с различным профилем резьбы. Поверхность внутрикостной части имеет шероховатость или покрытие из активного материала. В связи с тем, что на этапах регенерации кости и после протезирования может отмечаться вывинчивание имплантатов, для предотвращения этого на их внутрикостной части создаются углубления, продольные канавки, отверстия. 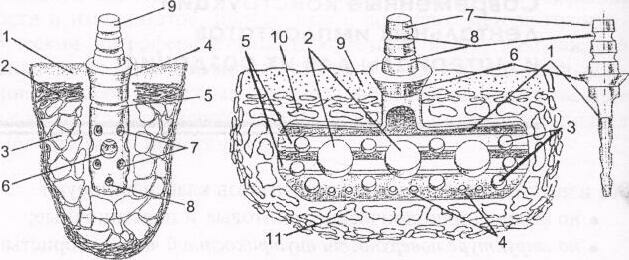 Рис. 1. Цилиндрический виутрикостный имплантат: 1 — слизистая оболочка; 2 — компактный слой; 3 — губчатая кость; 4 — шейка имплантата; 5 — бороздки на цилиндрической части имплантата; 6, 7, 8 — отверстия различного диаметра; 9 — головка имплантата Рис. 2. Пластиночный внутрикостный имплантат: 1 — пластиночная часть имплантата; 2, 3, 4 — отверстия разного диаметра; 5 — бороздки на внутрикостной части; 6— шейка имплантата; 7 — головка имплантата; 8 — бороздки на головке имплантата; 9— слизистая оболочка; 10 — компактный слой; 11 — губчатая кость Внутрикостная часть пластиночных имплантатов имеет различную форму и обработанную поверхность для создания соответствующего микрорельефа. На внутрикостной части имплантата имеются отверстия различного диаметра — от 0,5 мм до 3,0 мм, считается, что их площадь не должна превышать 1/3 общей площади поверхности внутрикостной части. По конструкции внутрикостные имплантаты подразделяются на неразборные и разборные. Неразборные конструкции имплантатов цилиндрической винтовой или пластиночной формы предусматривают единый комплекс, состоящий из внутрикостной части имплантата, от которой отходит шейка, переходящая в опорную головку имплантата. Разборные конструкции имплантатов также могут быть цилиндрической, винтовой и пластиночной формы. Разборные имплантаты состоят из двух основных элементов: внутрикостной части и фиксируемой к ней с помощью цемента или резьбового соединения опорной головки. Следует отметить, у некоторых конструкций разборных имплантатов наличие в области опорной головки переходной формы в виде шестигранника, который фиксирует в определенном положении головку к внутрикостной части. Фиксация головки имплантата в этом случае осуществляется винтом, проходящим через сквозной резьбовой канал в опорной головке. Разборные имплантаты имеют дополнительные элементы, такие как винт-заглушка и формирователь десневой манжетки. Опорные головки имеют различную конусность в пределах от 20 до 40°, и могут быть расположены под различным углом — от 10 до 20° к внутрикостной части. В настоящее время находят применение опорные головки из титана со сформированной на ней культей из керамики. В конструкции имплантатов возможно применение амортизаторов в виде колец, колпачков, пружин. Считается, что применение амортизирующего элемента позволяет снизить напряжение в кости при жевательной нагрузке. Планируя имплантацию, необходимо учитывать размеры имплантата, то есть его длину и диаметр, что связано с объемом и плотностью кости. Высота внутрикостной части цилиндрических и винтовых имплантатов может колебаться от 10 до 25 мм, диаметр — от 1,8 до 5,5 мм. Толщина внутрикостной части пластиночного имплантата составляет от 1,0 до 1,6 мм, высота внутрикостной части — от 5 до 15 мм. В стоматологической имплантологии применяется большое количество материалов. Имплантационные материалы должны отвечать определенным требованиям, включающим отсутствие патологических изменений в тканях организма и нарушений жизнедеятельности органов и тканей в течение всего периода их функционирования. Имплантационные материалы не должны оказывать токсического, канцерогенного и аллергического воздействия на ткани и органы человека. Для получения стоматологических имплантатов должны использоваться биосовместимые материалы. Поверхность имплантата должна обеспечивать адсорбцию и адгезию органической и минеральной составляющих кости и не угнетать деятельность остеобластов и остеоцитов. При контакте поверхности имплантата и костной ткани происходит костное, фиброзно-костное и соединительнотканное соединение. После внедрения внутрикостного имплантата, часть его поверхности находится в контакте с остеонами и трабекулами компактного и губчатого слоя кости, а часть поверхности располагается в области костно-мозговых пространств, где будет формироваться соединительная ткань. Характер соединения, образующегося между поверхностью имплантата и костью, зависит от многих факторов. На процесс заживления костной раны влияет объем и качество хирургической операции. Способность к регенерации кости определяется отсутствием значительного нарушения кровоснабжения и грубого повреждения структурных образований кости (остеонов и трабекул). Характер регенерации кости будет определяться формой и материалом, из которого изготовлен имплантат, состоянием поверхности внутрикостной части, а также наличием плотного контакта между костью и поверхностью имплантата. После внедрения плотность соединения кости с поверхностью имплантата осуществляется за счет образования коллагеновых волокон и физико-химической связи, в результате реакции между минерализованной матрицей кости и слоем оксидной пленки поверхности титанового имплантата или его гидроксиапатитовым покрытием. Важное значение для структурного формирования кости в области контакта с поверхностью имплантата имеет воздействие жевательной нагрузки. Наличие костного и фиброзно-костного соединения является физиологической реакцией кости на внедрение имплантата и определяет его долговременную фиксацию. Образование только соединительнотканного соединения свидетельствует о такой реакции кости, которая не обеспечивает надежной фиксации имплантата и определяет возможность его отторжения. Таким образом, длительность функционирования имплантата определяется биологической совместимостью материала имплантата и наличием плотного костного и фиброзно-костного соединения. Кроме взаимодействия имплантата с костью имеется его связь со слизистой оболочкой полости рта. Наличие органической связи между эпителием десны и твердыми тканями зуба предполагал Gottlib (1921) и затем это было подтверждено гистологическими исследованиями Г. Ю. Пакаланса (1970). Гистологически, связь между поверхностью пришеечной части имплантата и слизистой оболочкой десны подобна зубодесневому соединению, но отличается локализацией коллагеновых волокон и степенью кровоснабжения. Большинство коллагеновых волокон в пришеечной области ориентированны вдоль вертикальной оси имплантата, и лишь небольшое количество имитирует круговую связку. Надкостница и собственная пластинка слизистой оболочки формируют незначительное по площади прикрепление к пришеечной части имплантата, в основном десне-вые манжетки создаются за счет эпителиальных клеток десны. Образующаяся и фиксированная десневая манжетка в области имплантата, обеспечивает защиту от проникновения к внутрикостной части микробов и токсинов. Следует отметить, что для хорошего прилегания и формирования соединительнотканного барьера пришеечная часть имплантата должна быть тщательно отполирована, а также проведена щадящая операция на слизистой оболочке. Создание гладкой поверхности пришеечной части имплантата способствует поддержанию хорошей гигиены полости рта. Для создания имплантатов применяются различные материалы, но в основном для этой цели используют металлы, которые должны обладать определенными свойствами, а именно: не подвергаться коррозии и электрохимическим реакциям, не вызывать патологических изменений в тканях организма. На стоматологический имплантат воздействует жевательная нагрузка, которая может достигать значительной величины. Известно, что функциональная выносливость опорного аппарата зуба различна у отдельных групп зубов: резцы и клыки от 5 до 20 кг, премоляры и моляры от 20 до 80 кг. Таким образом, на имплантат при жевании воздействуют большие вертикальные и горизонтальные силы. Поэтому материал, из которого изготовлен имплантат, должен обладать определенным запасом прочности. Прочность — это свойство материала выдерживать действие внешних сил без его разрушения. Деформацией твердого тела называется изменение его размеров и объема, формы тела под действием приложенных сил. Деформации материала, которые после воздействия внешних сил исчезают и не вызывают изменения структуры, объема и свойств, называются упругими. Деформации дентального имплантата, включая предел прочности и упругости материала, должны превосходить силу внешнего воздействия и выдерживать динамические нагрузки. Под динамической нагрузкой подразумевается жевательное воздействие, которое чередуется с периодами его отсутствия. Инертные материалы имеют физико-химическую связь с костной структурой. Имплантаты, из которых они созданы, не разрушаются в процессе взаимодействия с окружающими тканями организма. К инертным материалам относятся титан и его сплавы, никелид титана, цирконий. Титан — легкий, прочный металл, обладающий высокой устойчивостью к коррозии. Титан плавится при температуре 1690° С и обладает плотностью 4,5 г/см3, является немагнитным металлом, имеет невысокий коэффициент теплопроводности и низкий модуль упругости. Важное свойство титана заключается в самопроизвольном создании, до определенной толщины, оксидной пленки, что обеспечивает его высокую коррозийную устойчивость. Оксидный слой на поверхности титанового имплантата является основой для последующего формирования и жизнедеятельности остеогенных клеток: остеобластов, остеоцитов, фибробластов. Титан является абсолютно биоинертным материалом, не вызывающим воспалительной реакции в организме и способствующим образованию кости на поверхности имплантата. В клинической практике применяются внутрикостные имп-лантаты из никелид титана, обладающие эффектом памяти формы. Эффект памяти формы основан на изменении внутреннего строения сплава, вследствие перестройки кристаллической решетки материала в условиях охлаждения до температуры ниже 10° С. После охлаждения с помощью титанового инструмента, лепестки стержня цилиндрического имплантата сводятся до полного контакта, а лепестки на титановой поверхности пластиночного имплантата устанавливаются в одной плоскости. При введении имплантата в костное ложе при температуре 35—37°С проявляется эффект термомеханической памяти сплава, когда лепестки раздвигаются и принимают первичную форму, фиксируя имплантат в кости челюсти. Цирконий — прочный металл, на поверхности которого образуется слой оксида и нитрида, обеспечивающий его высокую устойчивость к коррозии. Основным его источником является ортоксилат циркония. В настоящее время чистый цирконий применяется для изготовления внутрикостных имплантатов. К основным технологическим способам изготовления имплантатов относятся фрезерование, обработка титана посредством штамповки или пластического деформирования. Методом литья в основном производятся поднадкостничные имплантаты из кобальтохромового сплава. Большое значение при конструировании имплантатов придается созданию внутрикостной поверхности, которая определяет не только прочностные свойства, коррозийную стойкость, но также и адгезию остеогенных клеток. Структура поверхности имплантата существенно влияет на создание контакта с костью и распределение напряжений в кости при жевательной нагрузке. Надежность долговременной фиксации внутрикостных имплантатов можно достичь за счет увеличения площади контакта поверхности имплантата с костной тканью путем создания шероховатой структуры его поверхности. Микронеровности на внутренней части имплантата можно создать с помощью механической обработки или обработки абразивными материалами под давлением. При механической обработке (метод наката) микрорельеф поверхности имплантата образуется за счет поверхностной деформации при взаимодействии с более твердым материалом. Абразивная или пескоструйная обработка под давлением проводится порошком алюмооксидной керамики. После этого для создания более равномерной шероховатости поверхности имплантата, проводится травление соляной, серной, азотной кислотами. Возможно создание шероховатой поверхности имплантата при помощи эксимерного лазера. Формирование поверхности имплантата может осуществляться с помощью технологии плазменного напыления. При этом на поверхность титанового имплантата можно наносить не только порошок чистого титана, но и активные материалы, например гидроксиапатит или стеклокерамику. В результате создается покрытие толщиной от 30 до 50 мкм. На поверхность имплантатов «Эндопор» для увеличения площади контакта с костью, методом термического спекания наносятся титановые шарики. Керамические материалы также находят применение в качестве внутрикостных имплантатов. Важной характеристикой этих материалов является их высокая коррозийная стойкость и хорошая биологическая совместимость с костью. Для изготовления внутрикостных имплантатов используется алюмооксидная керамика, которая имеет моно- и поликристаллическую структуру. Монокристаллические сапфировые заготовки для цилиндрических и пластиночных имплантатов выращивают на автоматизированных установках в вакууме или особо чистом аргоне. Следует отметить, что имплантаты из алюмооксидной керамики, несмотря на высокую инертность и биологическую совместимость, являются хрупкими и имеют малый запас прочности, поэтому в настоящее время керамические имплантаты почти не применяются. Толерантные материалы, к которым относятся сплавы на основе кобальта и нержавеющей стали, не образуют физико-химического соединения между поверхностью имплантата и костью, что приводит к образованию вокруг имплантата соединительнотканной прослойки. Поэтому не происходит их плотного, неподвижного соединения с костью и отсутствует хорошая устойчивость после внутрикостной имплантации. Основу кобальтохромового сплава составляет кобальт (66—67%), обладающий высокими механическими качествами, и хром (26—30%), вводимый для придания сплаву твердости и повышения антикоррозийной стойкости. Температура плавления сплава составляет 1458°С. Благодаря хорошим литейным свойствам, сплав используется для изготовления каркасов литых коронок, мостовидных и дуговых протезов, а также применяется при отливке поднадкостничных каркасов имплантатов, которые фиксируются на поверхности кости верхней и нижней челюсти. Кроме металлов к толерантным материалам относятся полимеры, не обладающие токсическими и канцерогенными свойствами (полиэтилен, полипропилен). В процессе создания имплантатов происходит загрязнение (контаминация) их поверхности, что зависит от технологии их изготовления и способа обработки внутрикостной поверхности. Очистка поверхности имплантата может проводиться химическими способами с помощью кетонного раствора. Существуют способы очистки в тлеющем электрическом разряде и с помощью ультразвуковой обработки. Стерилизацию имплантатов осуществляют автоклавированием, сухожаровым способом, а также посредством ультрафиолетового облучения, что позволяет добиться относительно чистой поверхности имплантата. Виды имплантации и хирургические особенности введения имплантатов. Хирургический этап лечения следует проводить при строгом соблюдении правил асептики и антисептики в оснащенной необходимым оборудованием и инструментарием операционной или хирургическом кабинете. По взаимоотношению имплантата с твердыми и мягкими тканями организма можно выделить различные типы имплантации. • Эндодонто-оссальная имплантация — проводится для укрепления подвижных зубов при введении через канал корня в подлежащую кость челюсти титанового штифта с различными элементами фиксации на его поверхности. Имплантация может проводиться одновременно с резекцией верхушки корня. • Внутрикостная (эндооссальная) имплантация — заключается в введении имплантата через слизисто-надкостничный слой в кость верхней или нижней челюсти. Имплантат может иметь различную форму: винта, цилиндра или пластинки. Внутрикостная часть переходит в шейку головки имплантата, которую облегает слизистая оболочка десны. Опорная головка, на которой фиксируется протезная конструкция, выступает в полость рта. • Поднадкостничная (субпериостальная) имплантация — проводится путем введения имплантата под слизисто-надкостничный лоскут. Поднадкостничный имплантат представляет собой металлический каркас, расположенный на кости челюсти с выступающими в полость рта опорными головками. Субпериостальная имплантация применяется при выраженной атрофии кости на верхней и нижней челюсти. • Внутрислизистая имплантация — заключается во введении имплантата в слизистую оболочку альвеолярного отростка. Внутрислизистые имплантаты изготавливают из титана или кобальтохромового сплава. Имплантаты имеют грибовидную форму и фиксируются на внутренней поверхности базиса съемного протеза. При наложении протеза имплантаты вводят в соответствующие углубления на слизистой оболочке. Внутрислизистая имплантация показана для улучшения фиксации съемного протеза, а также при протезировании врожденных и приобретенных дефектов лица. • Подслизистая имплантация — предполагает введение под слизистую оболочку переходной складки полости рта магнитных имплантатов для создания клапанной зоны при фиксации полных съемных протезов. Соответственно положению имплантатов, введенных под слизистую оболочку, в базисе съемного протеза фиксируются магниты противоположной полярности. Проведение имплантации и последующего протезирования относится к сложным стоматологическим процедурам, поэтому обоснованна необходимость психологической коррекции и психомедикаментозной подготовки пациентов. Целью психотерапевтической работы врача является купирование тревожности и эмоционального напряжения, коррекция неверного отношения пациентов к стоматологическому лечению, предотвращение невротических реакций. При планировании имплантации необходимо разъяснить пациенту предполагаемый план лечения, провести демонстрацию имплантатов, фотографий с результатами имплантации и протезирования. Следует отметить, что операция имплантации связана с болевым синдромом. В формировании болевых ощущений лежат многокомпонентные нейро-гуморальные процессы, возникающие в центральной нервной системе в результате воздействия раздражителя. Поэтому при проведении имплантации необходима анестезиологическая защита пациентов, включающая премедикацию и обезболивание. Премедикация основана на применении лекарственных средств при подготовке пациента к наркозу или местной анестезии, с целью повышения их эффективности и профилактики осложнений. Эффективность премедикации транквилизаторами бензодиазепинового ряда и седативных средств подтверждается нормализацией физиологических реакций: частоты сердечных сокращений и дыхания, уровня артериального давления, деятельности желез внешней секреции. Широко распространены психотроп-ные средства: феназепам, диазепам, элениум, фенибут — которые принимают за 30—40 минут до операции имплантации. Премедикация обеспечивает снятие эмоционального напряжения и снижение эмоционального восприятия боли, в то же время сами болевые ощущения, связанные с хирургической операцией, снижаются незначительно, что требует применения обезболивания анестетиками. Операция имплантации проводится под местным обезболиванием, включающим наиболее распространенные способы: инфильтрационная и проводниковая анестезии. Инфильтрационная анестезия обеспечивает обезболивание концевых рецепторов второй и третьей ветви тройничного нерва и применяется при имплантации на верхней челюсти и в переднем отделе нижней челюсти. Проводниковая анестезия обеспечивает обезболивание в боковых отделах нижней челюсти. Обычно проводится односторонняя торусальная анестезия. Наиболее часто используемые местные анестетики — производные 4% раствора артикаина (Septanest, Ubistesin, Ultracain) и производные 3% раствора мепивакаина (Scanolonest). Показанием для проведения имплантации с помощью общего обезболивания является невозможность устранения страха перед предстоящим вмешательством психотропными средствами и непереносимость пациентом местных анестетиков. В зависимости от сроков удаления зубов можно выделить: • непосредственную имплантацию, сущность которой заключается в том, что операция внедрения имплантата проводится одновременно с удалением зуба; непосредственная имплантация может проводиться с помощью неразборных и разборных имплантатов; • отсроченную имплантацию, которая заключается в формировании костного ложа для имплантата после заживления костной раны, связанной с удалением зубов, через 6—9 месяцев. Отсроченная имплантация может осуществляться с помощью неразборных и разборных имплантатов, поднадкостничных имплантатов. При подготовке костного ложа для имплантата необходимо соблюдать принцип атравматичности, что достигается использованием определенной методики и инструментов для препарирования кости. Для препарирования ложа под цилиндрические, винтовые и пластиночные имплантаты используют специальные установки с индикатором скорости вращения и специальным насосом для подачи охлаждающего раствора в область внедрения имплантата. В основном препарирование проводится при скорости вращения инструмента от 500 до 2500 об/мин. Для препарирования костного ложа используются угловые наконечники с низкими скоростями вращения. Регулирование скорости вращения обеспечивается применением в наконечнике понижающего редуктора, который снижает скорость вращения микромотора и увеличивает силу вращающего момента. При операции имплантации используются скальпель, распатор, крючки, ножницы, стерильные марлевые салфетки и тампоны, шовный материал. Для имплантации используется специальный набор инструментов для препарирования костного ложа и установки имплантата. При внедрении имплантатов обязательно должен использоваться для эвакуации жидкости вакуумный электроотсос. Наряду с щадящим отношением к оперируемым тканям необходимо строго соблюдать асептику - метод профилактики инфекции путем предупреждения проникновения микроорганизмов в рану, ткани или полости тела. Известно, что при создании костного ложа возникает не только механическая травма кости, но и происходит ее нагревание. Следует отметить, что образование зоны некроза в кости вследствие ее перегрева в процессе сверления может привести не только к замедлению регенерации, но и образованию остеомиелита. Предельно допустимым при препарировании костного ложа под внутрикостные имплантаты считается нагревание кости на 7° С выше нормального значения температуры тела человека. Причиной нагревания кости является трение, при этом концентрации тепла в зоне сверления способствует низкая теплопроводность кости. Поэтому для предотвращения некроза костной ткани необходимо обильное орошение области внедрения имплантата охлаждающим раствором, прерывистое сверление и использование остро заточенных сверл различного диаметра. Необходимо учитывать глубину сверления канала в кости и ее плотность. Непосредственная имплантация заключается во внедрении имплантата в лунку удаленного зуба. При этом удаление зуба должно быть атравматичным, без нарушения целостности стенок костной альвеолы. Для первичной стабилизации имплантата необходимо в области дна лунки удаленного зуба создать направляющий канал глубиной до 2—3 мм. При фиксации неразборного имплантата опорная головка с помощью временного пластмассового протеза фиксируется к зубам, ограничивающим дефект, что обеспечивает неподвижность имплантата на период формирования костного соединения. Внедрение разборного имплантата осуществляют без опорной головки, и в лунке удаленного зуба фиксируется только внутрикостная часть вместе с заглушкой. После мобилизации краев слизистой оболочки в области лунки, операционная рана ушивается с помощью кетгута. Через 3—4 месяца к внутрикостной части имплантата может быть фиксирован формирователь десны, а затем опорная головка. Следует отметить, что в обоих случаях не удается с помощью стандартных имплантатов добиться точной конгруэнтности поверхности лунки и поверхности имплантата, поэтому образовавшийся промежуток необходимо заполнять остеопластическим материалом, например, используя Коллапан или Био-Осс. На период заживления костной раны внутрикостную часть имплантата с остеопластическим материалом можно изолировать с помощью барьерной мембраны. Разработана методика непосредственной имплантации, позволяющая с помощью компьютерного моделирования получить из титанового стержня аналог корня удаленного зуба. После удаления зуба проводят лазерное сканирование формы корня зуба и данные о его размерах фиксируются в компьютере. Затем по заданной программе проводят фрезерование копии формы корня зуба из титанового шаблона. После кюретажа лунки удаленного зуба, имплантат с заглушкой фиксируют и операционную рану ушивают кетгутом. Через 3—4 месяца после операции на внутрикостной части имплантата закрепляют опорную головку и проводят протезирование. Отсроченная имплантация может проводиться с помощью неразборных цилиндрических, винтовых и пластиночных имплантатов. При препарировании кости под неразборные цилиндрические и винтовые имплантаты соблюдается следующая последовательность манипуляций: • первоначально проводится разрез и отслоение слизисто-надкостничных лоскутов, возможно создание кругового отверстия в слизистой оболочке, соответствующего диаметру имплантата, с помощью специального циркулярного перфоратора; • при введении цельного цилиндрического имплантата, создание направляющего канала производится спиралевидным сверлом, на высоту внутрикостной части; • с помощью шаровидного бора создаются углубления в компактном слое кости, затем проводится препарирование направляющего канала сверлом диаметром, соответствующим внутрикостной части имплантата; • при установке цилиндрического имплантата для создания конгруэнтности костного ложа используются специальные развертки; если цилиндрическая внутрикостная часть полая, то с их помощью формируется костный столбик; • размеры костного ложа контролируются соответствующим аналогом имплантата; • фиксация цилиндрических имплантатов осуществляется с небольшим натягом с помощью имплантовода и хирургического молоточка; • при фиксации винтовых неразборных имплантатов с помощью сверл создается направляющий канал; • при фиксации винтовых имплантатов для создания профиля резьбы внутрикостной части имплантата применяются метчики. При установке неразборных имплантатов с остроконечным профилем резьбы, возможно их введение без использования метчика. При введении неразборного пластиночного имплантата Radix, после отслоения слизисто-надкостничного лоскута проводится формирование костного ложа для пластиночного имплантата. Для этого первоначально, дисковой пилой малого диаметра (10 мм), создают углубление в пределах компактного слоя. Затем дисковой пилой большего диаметра (20 мм), при скорости вращения 1000 об/мин., проводят пропил в губчатом слое кости. Окончательное формирование костного ложа осуществляют с помощью специального фиссурного бора диаметром 1 мм. Устанавливают имплантат слегка постукивая по рукоятке имплантовода, фиксирующего головку до погружения имплантата в сформированное костное ложе. Внутрикостная часть пластиночного имплантата должна быть погружена на 1—2 мм ниже уровня компактного слоя кости. При введении пластиночного имплантата с цилиндрической шейкой необходимо наряду с пропилом кости сформировать в компактном слое канал определенного диаметра. Перед закрытием операционной раны в область пропила кости вводят остеопластический материал (Коллапан, Коллапол, Остеоматрикс, Биоимплант) и слизистая оболочка ушивается кетгутом или синтетическим материалом (Vicril, Dexon, Dafilon). При этом необходимо обеспечить плотное прилегание краев слизисто-надкостничных лоскутов и исключить сдавливание слизистой оболочки. Отсроченная имплантация может проводиться с помощью разборных винтовых, цилиндрических и пластиночных имплантатов. Внедрение разборного винтового имплантата проводится следующим образом. Установка имплантата проводится в костное ложе, которое должно точно соответствовать его размерам и форме. При этом важно обеспечить первичную стабилизацию имплантата или его неподвижность и полное погружение внутрикостной части имплантата. Через 3-4 месяца к внутрикостной части имплантата фиксируется формирователь десневой манжетки, а затем головка имплантата и осуществляется протезирование. Планирование имплантации проводится с учетом анатомо-топографического строения верхней и нижней челюсти у конкретного пациента. Неблагоприятные для имплантации условия могут возникнуть при травматичном удалении зубов с образованием дефектов кости, а также при выраженной атрофии беззубых челюстей. Значительное уменьшение высоты кости челюсти от вершины альвеолярного отростка до дна верхнечелюстной пазухи и вершины альвеолярной части до нижнечелюстного канала практически не позволяет провести фиксацию имплантатов. Существует несколько вариантов восстановления костной структуры для проведения имплантации: во-первых, использование для операции имеющейся кости с обхождением верхнечелюстой пазухи и нижнечелюстного канала; во-вторых, применение для восстановления объема кости аутотрансплантации с взятием костного материала с ветви нижней челюсти, подбородочной области или использование остеопластических материалов; и, в-третьих, применение поднадкостничной (субпериостальной) имплантации. Для получения кальций-карбонатных материалов используются натуральные кораллы, кальций-фосфатный материал — кости животных. Полученный из кораллов материал представляет поликристаллическую керамику, основу которой составляет карбонат кальция. Из остеопластических материалов этой группы в клинической практике используют BioCoral и Interpore 200. Удаление химическим или термическим путем из костей животных органических веществ привело к созданию вещества Bio-Oss, в котором содержится фосфат кальция и гидроксиапатит. Коллаген может применяться в качестве основы для остеопластических материалов в виде гидроксило-коллагеновой губки. Наиболее известны «Коллапан» и «Коллапол». В качестве костнопластического материала используется «Биоматрикс» (высокоочищенный коллаген, выделенный из губчатой кости быка или свиньи), изготавливается в виде пластин или дисков и содержит суммарную фракцию глюкозаминогликанов. Биокомпозиционный материал «Биоимплант» состоит из чистого губчатого костного коллагена, костных сульфатированных глюкозаминогликанов и костного минерального компонента — гидроксиапатита. Фиксация имплантата при неблагоприятных анатомических условиях осуществляется после тщательной ревизии дефекта кости с полным удалением фиброзной или грануляционной ткани. Для обеспечения пролиферации, адгезии и дифференциации остеогенных клеток в качестве матрицы используются костные трансплантаты и остеопластические материалы. Изоляция введенного имплантата и остеопластического материала осуществляется с помощью слизисто-надкостничного лоскута, который должен полностью перекрывать дефект, или резорбируемых (Resolut, Bio-Gide) и нерезорбируемых барьерных мембран. Изоляция дефекта кости имеет важное значение для предотвращения проникновения мягких тканей и клеток эпителия, присутствие которых не способствует регенерации кости и фиксации имплантата. Комплекс мероприятий, направленных на реконструкцию и восстановление объема кости, окружающей имплантат, получил название «направленная регенерация кости». При выраженной атрофии альвеолярного отростка в области верхнечелюстной пазухи невозможно провести фиксацию имплантатов. В этом случае проводят операцию по созданию нового уровня дна верхнечелюстной пазухи с введением аутотрансплантатов кости и остеопластических материалов через сформированный в кости канал для имплантата или с остеотомией латеральной стенки верхнечелюстной пазухи. После остеотомии проводится надлом стенки с одновременным отслоением слизистой оболочки. После препарирования костного ложа для имплантата проводится его установка и заполнение образовавшегося пространства остеопластическим материалом. На область дефекта латеральной стенки верхнечелюстной пазухи накладывается барьерная мембрана и операционная рана ушивается кетгутом В клинической практике при неблагоприятных анатомических условиях (выраженная атрофия альвеолярного отростка) могут использоваться поднадкостничные имплантаты. Методика создания поднадкостничного имплантата заключается в следующем. Первоначально проводится разрез слизистой оболочки по вершине альвеолярного отростка или альвеолярной части челюсти и осуществляется отслоение слизисто-надкостничного лоскута с обнажением тела челюсти. Затем с открытого участка кости снимают двойной оттиск и проводят отливку огнеупорной модели, на которой формируется из воска и отливается из кобальтохромового сплава каркас будущего имплантата. После 3—4-недельного перерыва, достаточного для купирования воспаления в области операционной раны, проводят повторное отслоение слизисто-надкостничных лоскутов и фиксацию полированного каркаса имплантата на кости челюсти. Возможна установка поднадкостничного имплантата в течение одного дня, когда интервал между операцией и техническим изготовлением каркаса составляет 5—6 часов В послеоперационном периоде для предупреждения кровоизлияния, гематомы и отека мягких тканей необходимо фиксировать давящую повязку и обеспечить гипотермию в области проведения операции. Осмотр проводят через день, а швы снимают на 7—10-е сутки после операции. Медикаментозное лечение проводят для профилактики воспалительных осложнений. С этой целью применяют аспирин. Назначают препараты, способствующие минерализации костного матрикса, в состав которых входит кальций в комплексе с витаминами. После имплантации рекомендуют полоскание полости рта антисептическими растворами и использование мазей «Солкосерил», «Метрогил», способствующих заживлению операционной раны. |
