Билеты по химии. История представления об атомах. Состав и строение атома. Ученье Демокрита
 Скачать 276.97 Kb. Скачать 276.97 Kb.
|
|
38.Кривые титрования. Выбор индикатора по кривой титрования. Кривая титрования – это график зависимости pH, оптической плотности или каких-либо других характеристик титруемого раствора (ось ординат) от объема добавленного титранта (ось абсцисс). Масштаб оси абсцисс всегда линейный, а оси ординат может быть линейным или логарифмическим. Линейный масштаб удобен для тех методов контроля за титрованием (спектрофотометрия, амперометрия), в которых контролируемый параметр меняется с концентрацией линейно, а логарифмический – в случае логарифмического изменения (например, при потенциометрии с ионоселективным электродом). Логарифмический масштаб часто используют при визуальном определении конечной точки титрования, поскольку именно в этом масштабе наиболее наглядно проявляется резкое изменение свойств раствора вблизи точки эквивалентности. Для точного определения конечной точки титрования необходимо, чтобы на кривой титрования вблизи точки эквивалентности наблюдался перегиб (скачок). Это требование устанавливает пределы как для минимальной определяемой концентрации, так и для минимальной константы равновесия, приемлемой для реакции титрования. На рис. 3 представлены кривые титрования сильной кислоты сильным основанием и слабой кислоты сильным основанием. Видно, что при уменьшении концентрации скачок становится менее выраженным. Нижний предел концентрации зависит от конкретной реакции и метода определения конечной точки титрования, но проводить титрование при концентрациях ниже 10–4 М уже затруднительно. Рисунок 4 иллюстрирует влияние константы равновесия реакции титрования на кривую титрования. Для реакций нейтрализации в водных растворах константа равновесия в случае сильной кислоты и сильного основания составляет 1014, а для слабой кислоты и сильного основания – 1014Ka, где Ka – константа диссоциации кислоты. По мере уменьшения константы равновесия уменьшается и величина скачка. Чтобы визуальное определение конечной точки титрования было надежным, константа равновесия не должна быть меньше 106. При инструментальном контроле титрования или расчете положения конечной точки титрования на основании полученных данных константа равновесия может составлять всего 102. 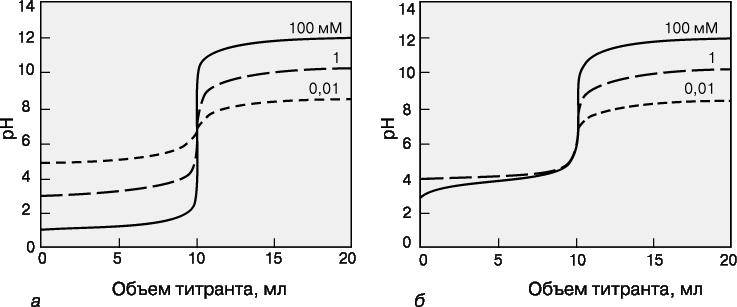 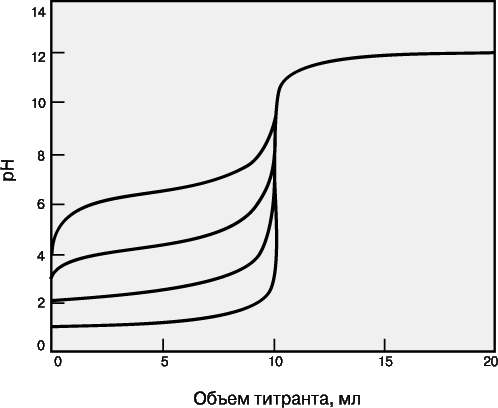 39.Степень окисления.Окислительно-восстановительные реакции. Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений. Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в формульной единице, например: Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот. Окисли́тельно-восстанови́тельные реа́кции,— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого. Виды окислительно-восстановительных реакций:
NH4NO3 → N2O + 2H2O 40.Влияние среды на протекания окислительно-восстановительных процессов (на примере иона MnO4) Для прогноза продуктов и направления протекания окислительно- востановительных процессов надо знать, что типичными окислителями являются: 1) простые вещества, атомы которых имеют большую электроотрицательность >3 (элементы VIA и VIIA групп). Из них наиболее сильные окислители F, О, Сl. 2) Вещества, содержащие элементы в максимальной степени окисления: (КМnO4, K2Cr2O7, HClO4, H2SO4 и др. 3) Катионы металлов и водород К типичным восстановителям относятся: 1) простые вещества, атомы которых имеют малую электроотрицательность < 1,5 (элементы IA и IIА групп и некоторые другие металлы). 2) Вещества, содержащие элементы в низших степенях окисления: (H2S, NH3 и др) Вещества, содержащие атомы в промежуточных степенях окисления, способны как повышать, так и понижать степень окисления, т.е. могут быть как восстановителями (при действии более сильного чем они окислителя) так и окислителями (при действии более активного, чем они, восстановителя). Такие вещества проявляют окислительно-восстановительную двойственность. рН среды оказывает влияние на направление окислительно-восстановительных реакций и характер образующихся продуктов. Чем меньше кислотность среды, тем, как правило, менее глубоко идет процесс. Например, КМnО4 проявляет окислительные свойства за счет Мп+7 и восстанавливается:
Хромат и дихромат калия выступают в качестве окислителей в кислой среде, восстанавливаясь до иона Сr+3 . Изменение рН среды может развернуть реакцию. Так диспропорционирования хлора в щелочной среде Сl2 + КОН = КСl + КСlOз + Н2О идет в обратном направлении при подкислении раствора. НСl + НСlOз = С12 + Н2O 41. Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциало определяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами. Электродом называют проводники, имеющие электронную проводимость и находящиеся в контакте с ионным проводником Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура . 42. Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород , насыщенную водородом и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция: 2Н+ + 2e− = H2 Стандартный электродный потенциал, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту. 43. Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Гальванические первичные элементы - это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля –Якоби. 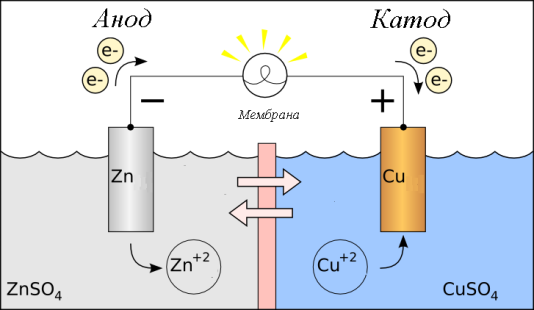 Электродвижущая сила (ЭДС) — скалярная физическая величина, характеризующая работу сторонних сил, то есть любых сил неэлектрического происхождения, действующих в квазистационарных цепях постоянного или переменного тока. В замкнутом проводящем контуре ЭДС равна работе этих сил по перемещению единичного положительного заряда вдоль всего контура 44. Сухим гальваническим элементом является самый известный первичный элемент (батарея одноразового использования), который сегодня широко используется в переносных устройствах. Изначально элементы заполнялись жидким электролитом. В дальнейшем электролит стали загущать с помощью крахмалистых веществ — это позволяло сделать более практичные элементы питания, называемые сухими, в которых сведена к минимуму возможность вытекания электролита. Электри́ческий аккумуля́тор — химический источник тока многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования[1], а также для обеспечения резервных источников энергии в медицине, производстве и в других сферах Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне[1] — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе. Топливные элементы осуществляют превращение химической энергии топлива в электричество, минуя малоэффективные, идущие с большими потерями, процессы горения. Это электрохимическое устройство в результате высокоэффективного «холодного» горения топлива непосредственно вырабатывает электроэнергию. 45. Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита. Последовательность электродных процессов на катоде происходит в порядке от больших потенциалов к меньшим. При этом возможны три случая: катионы металлов, имеющих малую величину стандартного потенциала (от Li до Al включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды: 2Н2О + 2е Н2 + 2ОН- Катионы металлов, имеющих стандартный потенциал меньший, чем у водорода, но больший, чем у алюминия (от Mn2+ до Н+) при электролизе на катоде восстанавливаются одновременно с молекулами воды катионы металлов, имеющих стандартный потенциал больший, чем у водорода (от Cu2+ до Au+), при электролизе практически полностью восстанавливаются на катоде. 46. Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: Гидроксид железа Fe(OН)3 и является тем, что называют ржавчиной. Химическая коррозия. Кислород воздуха взаимодействует с поверхностным слоем металла, при этом образуется оксидная пленка. Она образуется в условиях сухого воздуха и при комнатной температуре, и при нагревании. Такую коррозию называют химической. Пленка может быть прочной и препятствовать дальнейшему процессу коррозии. Такие прочные пленки образуются на поверхности алюминия и цинка. Но есть и рыхлые пленки, которые не предохраняют металл от разрушения, как, например, у оксидов щелочных металлов. Так, поверхность только что отрезанного кусочка натрия на глазах мутнеет, образуется рыхлая, с трещинами пленка, свободно пропускающая к поверхности металла кислород воздуха, а также другие газы и пары воды. 47. Электрохимическая коррозия - самый распространенный вид коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии. Коррозия с кислородной деполяризацией. Процессы коррозии металлов, у которых катодная реакция осуществляется с участием растворенного в электролите кислорода, называются коррозией с кислородной деполяризацией.С кислородной деполяризацией корродируют металлы, находящиеся в атмосфере или соприкасающиеся с водой и растворами солей. 48. Электрохимическая коррозия - самый распространенный вид коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии. Коррозией металлов с водородной деполяризацией. Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией. Коррозия металлов с водородной деполяризацией имеет место: 49. Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материа лов и способом их нанесения.[3]. Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата является абразивоструйная очистка[4]. Обычно выделяют три направления методов защиты от коррозии:
Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы. При проектировании конструкции стараются максимально изолировать от попадания коррозионной среды, применяя клеи, герметики, резиновые прокладки. Активные методы борьбы с коррозией направлены на изменение структуры двойного электрического слоя. Применяется наложение постоянного электрического поля с помощью источника постоянного тока, напряжение выбирается с целью повышения электродного потенциала защищаемого металла. Другой метод — использование жертвенного анода, более активного материала, который будет разрушаться, предохраняя защищаемое изделие.В качестве защиты от коррозии может применяться нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента (пассивный метод). 50. Полимерами называют соединения, макромолекулы которых состоят из атомных группировок мономеров, последовательно связанных в виде цепи. Цепное строение макромолекул предопределяет повышенную прочность связей между ними, что обеспечивает возможность образования волокон и пленок. Другое свойство макромолекул – гибкость – обуславливает эластичность полимеров, т.е. способность к значительным, многократным, обратимым деформациям под действием малых нагрузок. Вследствие большой молекулярной массы и цепного строения растворы полимерных соединений обладают высокой вязкостью. Часто достаточно нескольких процентов растворяемого вещества, чтобы раствор потерял текучесть. Наряду с химическим составом важнейшей характеристикой высокомолекулярных соединений (ВМС) является молекулярная масса и степень полимеризации, равная числу повторяющихся звеньев цепи. Полимеры, как правило, состоят из макромолекул разной массы. Это принципиальное, присущее только полимерам свойство называется полидисперсностью или полимолекулярностью. Молекулярно-массовыми характеристиками полимеров являются средние молекулярные массы и функции распределения по этому показателю. Среднечисловая молекулярная масса Мn полимеров вычисляется как отношение суммарной массы макромолекул к их общему числу n. |
