Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. 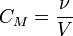 , ,
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.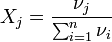 ,где: νi — количество i-го компонента, моль; n — число компонентов; ,где: νi — количество i-го компонента, моль; n — число компонентов;
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. 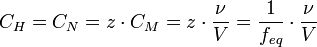 ,где: ν — количество растворённого вещества, моль; V — общий объём раствора, л; z — число эквивалентности (фактор эквивалентности ,где: ν — количество растворённого вещества, моль; V — общий объём раствора, л; z — число эквивалентности (фактор эквивалентности 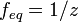 ). ).
16. Молярная концентрация эквивалента. Эквивалент. Фактор эквивалентности и особенности его расчета. Молярная масса эквивалента.
Молярная концентрация эквивалентов вещества определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1: 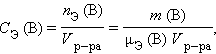 где nЭ (B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента. где nЭ (B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях
Фактор эквивалентности Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности(обозначается обычно как 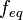 ). ).
Число эквивалентности Число эквивалентности 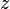 представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности 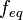 связан с числом эквивалентности следующим соотношением: связан с числом эквивалентности следующим соотношением: 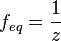 Например, в реакции: Например, в реакции: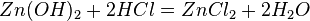 Эквивалентом является мнимая частица Эквивалентом является мнимая частица 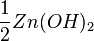 . Число . Число  есть фактор эквивалентности, есть фактор эквивалентности, 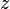 в данном случае равно в данном случае равно 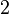 . .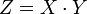 Молярная масса эквивалентов обычно обозначается как Молярная масса эквивалентов обычно обозначается как 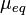 или или 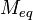 . Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как . Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как 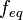 ).Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества. ).Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.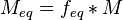
17. Фазовые переходы. Фазовые равновесия. Фазовые диаграммы и их анализ.
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.Наиболее часто рассматриваются фазовые переходы при изменении температуры, но при постоянном давлении (как правило равном 1 атмосфере). Именно поэтому часто употребляют термины «точка» (а не линия) фазового перехода, температура плавления и т. д. Разумеется, фазовый переход может происходить и при изменении давления, и при постоянных температуре и давлении, но и при изменении концентрации компонентов (например, появление кристалликов соли в растворе, который достиг насыщения).
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия. Типы фазовых равновесий: Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру. Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением. Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества. Фа́зовая диагра́мма (диаграмма состоя́ния) — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме. Анализ фазовых диаграмм. Обычными координатами для построения фазовой диаграммы являются термодинамические параметры — температура и давление — и состав системы (в мольных или массовых процентах).В общем случае количество координат превышает число компонентов системы на единицу Для конденсированных систем зачастую не учитывают изменение фазовых равновесий за счёт давления, в этом случае число измерений диаграммы равно числу компонентов (диаграмма конденсированной двухкомпонентной системы двумерна, трёхкомпонентной — трёхмерна и т. п.) Сложные фазовые диаграммы в печатных изданиях изображают в виде сечений или проекций. Согласно правилу фаз, на двумерной диаграмме однофазная область описывается полем, двухфазная — линией (на p-T диаграммах) или набором параллельных линий конод, для которых фиксированы составы равновесных фаз (на диаграммах с участием состава), трёхфазная — точкой (на p-T диаграммах) или горизонталью (на T-x или p-x диаграммах).
18.Коллегативные свойства растворов.
Коллигативные свойства растворов — это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя.
19.Термохимическая теплота. Тепловой эффект химической реакции и фазового перехода.
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплотфазовых переходов.
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов. Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
20. Закон Гесса и его следствия.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье-Лапласа). Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
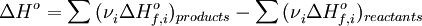
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
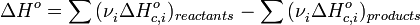
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры. Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
21. Зависимость теплового эффекта от температуры. Уравнение Кирхгоффа
Тепловой эффект химической реакции - отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов. Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Закон Кирхгофа гласит, что температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Уравнение Кирхгофа, являющееся следствием этого закона используется для расчёта тепловых эффектов при разных температурах. Интегральная форма закона:
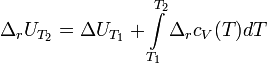 
Где 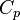 и и 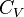 — изобарная и изохорная теплоёмкости, — изобарная и изохорная теплоёмкости,  — разность изобарных теплоёмкостей продуктов реакции и исходных веществ, — разность изобарных теплоёмкостей продуктов реакции и исходных веществ, 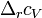 — разность изохорных теплоёмкостей продуктов реакции и исходных веществ, а — разность изохорных теплоёмкостей продуктов реакции и исходных веществ, а  и и 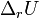 — соответствующие тепловые эффекты.Если разница — соответствующие тепловые эффекты.Если разница 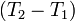 невелика, то можно принять невелика, то можно принять 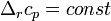 и и  Следовательно, интегральная форма закона примет вид: Следовательно, интегральная форма закона примет вид: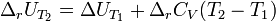

При большой разнице температур необходимо учитывать температурные зависимости теплоёмкостей:  и и 
22. Экспериментальное определение теплового эффекта химической реакции.
Экспериментальное определение тепловых эффектов ведут с помощью приборов - калориметров. А процесс — называют калориметрией. Калориметр представляет собой теплоизолированный сосуд, в котором может проводиться та или иная реакция. Выделяемая в результате реакции теплота передается либо воде, либо самой реакционной смеси, вызывая повышение температуры. При экспериментальном определении тепловых эффектов химических реакций возникают ошибки и неточности, обусловленные, главным образом, теплообменом прибора с внешней средой. Чтобы уменьшить теплообмен, ведут реакцию возможно быстрее и температуру калориметра в начале опыта держат по возможности равной температуре воздуха в лаборатории. Определение изменения температуры тоже может повести к ряду неточностей. Большей частью для измерения температуры пользуются термометром и отсчет производят через лупу.
23. Основные понятия химической кинетики: Скорость химической реакции, молекулярность, простая и сложная с точки зрения химической кинетики реакции. Основной закон (постулат) химической кинетики.
Скорость химической реакции — Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1. Например для реакции: 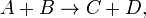 скорость можно выразить так: скорость можно выразить так: 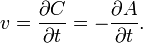 Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия. Простыми называются реакции, протекающие в одну стадию за счёт одновременного столкновения молекул, записанных в левой части уравнения. В простой реакции могут участвовать одна, две или, что встречается крайне редко, три молекулы. Простые реакции: Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия. Простыми называются реакции, протекающие в одну стадию за счёт одновременного столкновения молекул, записанных в левой части уравнения. В простой реакции могут участвовать одна, две или, что встречается крайне редко, три молекулы. Простые реакции:
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.): H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных): СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц: О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны. Для простых реакций кинетические уравнения относительно просты. Например, для реакции H2 + I2 = 2HI кинетическое уравнение имеет вид: 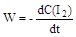 = k ∙ C(I2) ∙ C(H2). (W – скорость реакции) Сложные реакции протекают в несколько стадий, причём все стадии связаны между собой. Поэтому кинетические уравнения сложных реакций более громоздки, чем простых реакций. Например, для сложной реакции H2 + Br2 = 2 HBr известно: = k ∙ C(I2) ∙ C(H2). (W – скорость реакции) Сложные реакции протекают в несколько стадий, причём все стадии связаны между собой. Поэтому кинетические уравнения сложных реакций более громоздки, чем простых реакций. Например, для сложной реакции H2 + Br2 = 2 HBr известно: 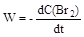 = = 
|
 Скачать 276.97 Kb.
Скачать 276.97 Kb.