Билеты по химии. История представления об атомах. Состав и строение атома. Ученье Демокрита
 Скачать 276.97 Kb. Скачать 276.97 Kb.
|
|
30. Вода-слабый электролит. Ионное произведение воды. pH. pOH Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды. Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует: Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле: где:
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л. При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как: Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C). Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Водоро́дный показа́тель, pH - мера активности ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр: Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH-: Связывающее уроавнение: 31.Эксперементальное определение водородного показателя Многие органические вещества могут изменять свой цвет в зависимости от кислотности. Самый известный подобный «индикатор» это чай. Когда вы бросаете в стакан с крепким коричневым чаем ломтик лимона, чай в стакане становится значительно светлее. При снижении pH, то есть при увеличении кислотности благодаря лимонной кислоте чай меняет свою окраску на более светлую. Другим не менее известным «индикатором» является сок столовой свеклы. Хозяйки давно знают его способность принимать более насыщенный красный цвет в кислой среде. После того как борщ практически готов и имеет оранжевый цвет добавьте в него немного уксуса и прямо на глазах ваше блюдо окрасится в ярко красный цвет. Сейчас наиболее известными индикаторами в химии являются лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и ряд других. Эти индикаторы могут иметь два цвета в зависимости от кислотности среды. Цвет для каждого из индикаторов может изменяться в диапазоне 1 – 2 единицы рН. 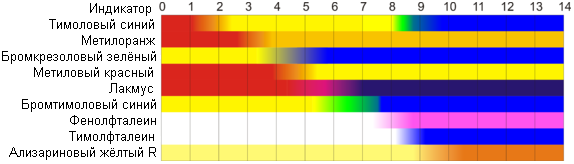 Следовательно, этот метод определения водородного показателя имеет ряд недостатков. Во-первых, определять кислотность можно лишь в определенном небольшом диапазоне значений рН. Этот недостаток иногда обходят, приготовляя универсальный индикатор – смесь нескольких из выше перечисленных индикаторов. Но этот индикатор все же не охватывает всю шкалу активности водорода. Во-вторых использование изменения окраски индикатора для определения активности водородных ионов сильно затруднено, а иногда и невозможно в мутных и цветных средах. 32.Расчет рН в растворе сильного электролита. Для сильных кислот и щелочей, полностью диссоциированных на ионы, Н+ = zCк и ОН = zCщ, (2.4) где Ск и Сщ моляльные концентрации кислоты и, соответственно, щелочи, z основность кислоты или кислотность основания. Пример. Вычислить рН раствора серной кислоты концентрацией 0,005 моль/кг в воде и в растворе хлорида алюминия концентрацией 0,005 моль/кг. Решение. 1. Составить уравнение диссоциации серной кислоты: 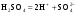 . .2. Согласно уравнению диссоциации концентрация катионов водорода 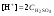 , концентрация сульфат-ионов , концентрация сульфат-ионов 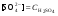 . .3. Оценить рН раствора по концентрации катионов водорода: 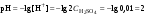 . .4. Вычислить ионную силу раствора: 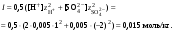 5. Вычислить значение коэффициента активности катионов водорода: 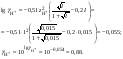 6. Вычислить значение активности катионов водорода в растворе серной кислоты: 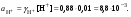 7. Вычислить значение рН: 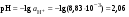 . .8. Вычислить ионную силу раствора, содержащего серную кислоту и хлорид алюминия 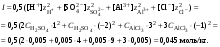 9. Вычислить коэффициент активности катионов водорода 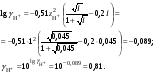 10. Вычислить рН раствора серной кислоты в присутствии хлорида алюминия 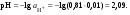 Вывод: увеличение ионной силы раствора приводит к снижению активности катионов водорода и снижению рН. 33.Расчет рН в растворе слабого электролита. Слабые кислоты и основания в водных растворах диссоциированы не полностью и основная масса вещества существует в растворе в молекулярной форме. Процесс диссоциации слабого электролита протекает ступенчато. Например, для слабой двухосновной кислоты H2An: 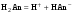 – первая ступень диссоциации; – первая ступень диссоциации;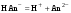 – вторая ступень диссоциации. – вторая ступень диссоциации.Основной количественной характеристикой силы слабого электролита является константа равновесия процесса диссоциации или константа диссоциации. Каждая ступень диссоциации характеризуется своей константой равновесия. Для слабой двухосновной кислоты H2An существует две константы диссоциации: 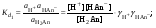 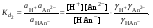 Значения констант диссоциации для 25°С приводятся в справочной литературе или могут быть вычислены через энергию Гиббса реакции диссоциации. 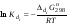 , (2.13) , (2.13)где 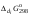 вычисляется, в соответствии с законом Гесса, для конкретной ступени диссоциации через энергии Гиббса образования ионов в водном растворе и энергии Гиббса образования молекул слабого электролита в водном растворе. Например, для слабой одноосновной кислоты: вычисляется, в соответствии с законом Гесса, для конкретной ступени диссоциации через энергии Гиббса образования ионов в водном растворе и энергии Гиббса образования молекул слабого электролита в водном растворе. Например, для слабой одноосновной кислоты: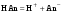 ; ;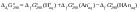 . .Обычно константа диссоциации по второй ступени приближенно в 104-105 раз ниже, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН в растворах многоосновных слабых кислот обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. 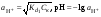 и (2.15) и (2.15)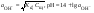 , (2.16) , (2.16)где 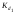 – первая константа диссоциации слабого электролита, Ск и Сщ молярные концентрации кислоты и, соответственно, щелочи. – первая константа диссоциации слабого электролита, Ск и Сщ молярные концентрации кислоты и, соответственно, щелочи.Пример. Вычислить рН раствора гидроксида аммония концентрацией 0,5 моль/л; 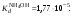 Решение. 1. Записать уравнение диссоциации гидроксида аммония 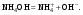 2. Вычислить концентрацию гидроксид-ионов в растворе аммиака в воде 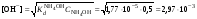 и величину рН (полагая 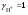 ) )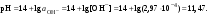 34.Гетерогенные равновесия в растворе электролита. Произведение растворимости. Произведение растворимости Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится встречаться ссистемами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. Вследствие динамического характера равновесия скорость процесса растворения осадка будет совпадатьсо скоростью обратного процесса кристаллизации. Так, для насыщенного раствора электролита Этот процесс является гетерогенным, т.е. протекает на поверхности осадка. Поэтому константа равновесия этого процесса будет определяться только произведением активностей ионов в растворе и независит от активности твердого компонента: Таким образом, произведение активностей ионов электролита, содержащихся в его насыщенном растворе при данной температуре, есть величина постоянная. Эту величину называют произведением, растворимости электролита и обозначаютПР. Как константаравновесия, произведение растворимости зависит от природы растворенного вещества и растворителя, а также от температуры и не зависит от активностей ионов в растворе. Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением: где fi — фугитивность компонентов газовой фазы, а ak — активность компонентов конденсированной фазы. 35. Реакции ионного обмена и их применение в качественном анализе Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами: Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O 2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O CO32- + 2H+ → CO2↑ + H2O В качественном анализе имеют дело преимущественно с водными растворами электролитов, т. е. солей, оснований и кислот, диссоциирующих на ионы. Можно сказать, что каждый ион обладает определенными свойствами, которые он сохраняет независимо от присутствия в растворе других ионов. Например, катион водорода, присутствующий в водном растворе любой кислоты, независимо от ее аниона окрашивает синий лакмус в красный цвет и проявляет другие, характерные для него свойства. Поскольку сильные электролиты практически полностью ионизированы, при смешении растворов в реакцию могут вступать только ионы. Проиллюстрируем это положение несколькими примерами взаимодействия веществ, дающих при диссоциации ионы Ва2+ и SО42- : BаСl2 + H2S04 = BаSО4 ↓ + 2HCl Bа(NО3)2 + Na 2S04 = BаSО4 ↓+ 2NаNО3 Bа(ОН)2 + K2S04 = BаSО4 ↓ + 2КОН Продуктом всех этих реакций является белый мелкокристаллический осадок сульфата бария, не растворимый в кислотах и щелочах. Получение одного и того же продукта при взаимодействии трех пар различных соединений легко объясняется ионной теорией. Ведь сущность приведенных трех реакций может быть выражена следующим ионным уравнением: Bа2+ + SО42- = BаSО4↓ Следовательно, сульфат бария ВаS04 образуется всякий раз, когда при смешении растворов катионы Ва2+ встречаются с анионами SО42-. Поэтому с помощью сульфат-ионов можно обнаруживать в растворе катионы Ва2+ и, наоборот, с помощью ионов бария – анионы SО42-. Таким образом, реакции, происходящие в растворах между электролитами, это реакции между ионами. Поэтому аналитическими реакциями обнаруживают не химические вещества, а образуемые ими катионы и анионы. 36.Гидролиз солей. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»). Различают обратимый и необратимый гидролиз солей.
37.Кислотно-основное титрование. Определение концентрации раствора на основе метода титрования. Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации: Н3O+ + ОН− = 2Н2О Принцип титрования заключается в следующем: к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют небольшими порциями раствор титранта до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования). Момент окончания титрования можно установить при помощи химической реакции или по изменению некоторого физического свойства. Часто используются органические красители, окраска которых изменяется по достижении конечной точки титрования. Расчет концентрации исследуемого раствора, в соответствии с законом эквивалентов, проводят по формуле: Сэкв 1V1 = Сэкв 2V2, (7) где Сэкв 1 и Сэкв 2 – молярные концентрации эквивалента пробы и титранта, соответственно, моль экв/л; ^ V1 – отмеренный объем пробы, л; V2 – объем титранта, израсходованный на титрование, л. При определении концентраций кислот и оснований используют метод кислотно-основного титрования, в основе которого лежит реакция нейтрализации: Н++ОН− = Н2О. В кислотной среде концентрация ионов водорода Н+ больше концентрации гидроксид-ионов ОН-, а в щелочной среде, наоборот, меньше. Для удобства характеристики среды используют понятие водородного показателя рН, численно равного отрицательному десятичному логарифму молярной концентрации ионов водорода в растворе: pH=-lg[ H+ ] Поскольку в водных растворах произведение молярных концентраций ионов водорода и гидроксид-ионов: CH+COH=CH20 называемое ионным произведением воды, – величина постоянная и при Т=298К KH20=10-14, Истинная точка эквивалентности кислотно-основного титрования соответствует равенству молярных концентраций ионов водорода Н+ и гидроксид-ионов ОH- СH+=COH Реакция нейтрализации не сопровождается видимыми изменениями, например, переменой окраски раствора. Поэтому для фиксирования точки эквивалентности используют органические красители, структура и окраска которых зависит от величины водородного показателя рН. |
