КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИОКСИДАНТОВ. Клиническая фармакология антиоксидантов
 Скачать 3.89 Mb. Скачать 3.89 Mb.
|
|
Таблица 9.4. Применение восстановленного глутатиона (татионила) в офтальмологии 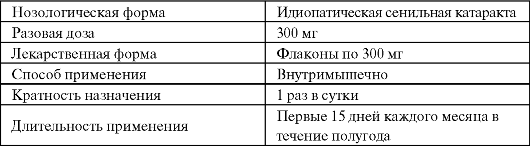 Другим потенциально перспективным для клинического использования эндогенным антиоксидантом является карнозин (дипептид β-аланил-гистидин). В организме карнозин образуется из β-аланина и гистидина под действием карнозинсинтетазы, а в дальнейшем под влиянием N-метилтрансферазы и в присутствии S-аденозилметиони- на он может превращаться в анзерин. Карнозин и анзерин участвуют в формировании буферной системы организма, способны нейтрализовать активные формы кисло- рода и сахаров, являются буфером протонов и металлов переменной валентности. Карнозин способен защищать белки от неэнзиматического гликозилирования (гликирования), поскольку представляет более удобную мишень для атаки альдегидами. Высокие концентрации карнозина могут эффективно защищать белки от альдосахаров. Более того, карнозин способен связываться с карбонильными группами окисленных белков, а образующееся при этом карнозилированное производное белка быстрее подвергается протеолизу и выключатся из клеточного метаболизма. Клиническое применение карнозина в качестве лекарственного средства пока ограничивается офтальмологией, однако широкий спектр действия позволяет рассматривать его в качестве одного из перспективных биоантиоксидантов и регуляторов клеточного метаболизма (табл. 9.5). Таблица 9.5. Применение карнозина в офтальмологии 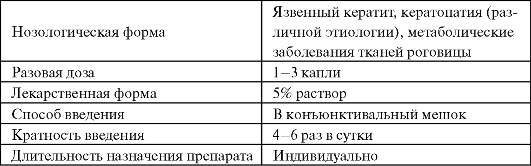 В соответствии с современным уровнем знаний, α-липоевую кислоту классифицируют как витаминоид. Ее биосинтез может осуществляться не только в бактериях и растениях, но и в высших организмах. α-липоевая кислота играет достаточно важную роль в утилизации сахаров и осуществлении нормального энергетического обмена. Через ε-аминогруппу лизинового остатка она связывается с центральным компонентом ацилтрансферазы и действует как кофермент в ряде многоферментных комплексов митохондрий.
α-липоевая кислота и, особенно, дигидролипоат (ее восстановленная форма), являются важными антиоксидантами, работающими как в клетке, так и вне ее. α-липоевая кислота способна нейтрализовать гидроксильный радикал, синглетный кислород, пероксинитрит, гипохлорит и перекись водорода. Кроме того, она хелатирует металлы с переменой валентностью, участвует в восстановлении пула антиоксидантов (например, аскорбиновой кислоты и α-токоферола), повышает внутриклеточный уровень глутатиона, модулирует активность некоторых транскрипционных факторов (например, NFkB). Дигидролипоевая кислота (но не α-липоевая) дополнительно способна нейтрализовать супероксиданион-радикал и пероксильный радикал. Величина окислительно-восстановительного потенциала для дигидролипоевой кислоты/липоевой кислоты, измеренная при рН 7,0, составляет - 0,29 В, что хорошо согласуется со значением потенциала для глутатионовой системы защиты в мембране клетки (-0,23 В). Антиоксидантное действие α-липоевой кислоты нашло применение как один из патогенетических подходов к лечению диабетической полинейропатии и ангиопатии, развитие которых сопровождается усилением перекисной модификации белков и липидов (табл. 9.6). Таблица 9.6. Некоторые особенности применения α-липоевой кислоты в качестве антиоксиданта  Побочные эффекты α-липоевой кислоты представлены в табл. 9.3. Синтетические препараты • Ионол (Дибунол). • Пробукол (Фенбутол). • Ацетилцистеин (АЦЦ). • Тирилазад мезилат (Фридокс). • Диметилсульфоксид (Димексид). • Эмоксипин. • Олифен (Гипоксен). • Эхинохром-а (Гистохром). • Церовив (NXY-059). Из синтетических скэвенджеров одним из первых в эксперименте и клинической практике был исследован ионол (Дибунол) - липофильное соединение, представляющее собой бутилокситолуол. Антиоксидантные свойства препарата сопряжены с его способностью связывать активные формы и соединения кислорода с образованием стабильного феноксильного радикала, не принимающего участия в цепи окислительных превращений и прерывающего цепи окисления в субстрате.
Ионол обладает выраженной антиоксидантной активностью и первоначально был предложен для местного применения (рак и папилломатоз мочевого пузыря, ожоги, отморожения, язвы) (табл. 9.7). Имеются данные о фармакокинетике 5% линимента препарата при его наружном применении. Он хорошо всасывается с поверхности кожи, накапливается в богатых липидами тканях и определяется в очаге поражения в концентрациях, достаточных для проявления терапевтического эффекта - 32-86 мг/кг. При этом Cmax в крови не превышает 0,64 мг/л и в последующем (через 4 ч после нанесения препарата на кожу) снижается до 0,24 мг/л. При многократном применении ионола имеется прямая зависимость между концентрацией препарата в пораженных тканях и кратностью нанесения на кожу. Учитывая это, препарат можно применять местно 2-3 раза в сутки под окклюзионную повязку длительностью до 2-3 недель. Системное введение препарата может быть использовано в комплексной терапии острого инфаркта миокарда, так как он предупреждает активируемую стрессом избыточную продукцию NO, NO-обусловленное снижение тонуса коронарных сосудов и развитие постстрессорной гипотензии, снижает риск развития левожелудочковой сердечной недостаточности и нарушений сердечного ритма. Однократный прием ионола в острой фазе процесса улучшает функциональные показатели работы сердца; длительный курсовой прием - стимулирует работу, но без достоверного улучшения сократительной способности миокарда. Стимуляция работы сердца наиболее отчетливо проявляется на 2-3 сутки приема (эффект дозозависимый), что может потребовать дополнительного назначения β-адреноблокаторов. Помимо этого, ионол нормализует концентрацию Таблица 9.7. Основные показания к применению и схемы назначения ионола 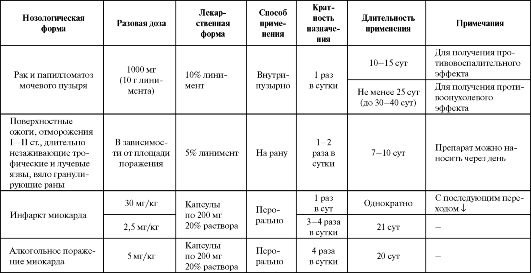 фибриногена в крови, восстанавливает фибринолитическую активность и уменьшает агрегацию форменных элементов крови.
При длительном курсовом назначении препарата, особенно в дозах, приближающихся и превышающих 30 мг/кг в сутки, при отмене препарата или резком снижении дозы возможно развитие феномена отдачи, поэтому дозу препарата надо снижать постепенно, в течение не менее 3 суток. Курсовое применение ионола (особенно в высоких дозах) иногда могут сопровождать парадоксальные эффекты, когда его антиоксидантное действие трансформируется в противоположное - прооксидан- тное, с подавлением ферментной антиоксидантной системы митохондрий, увеличением образования кислородных радикалов, снижением функционирования цепи переноса электронов в микросомах. Такие нарушения могут быть связаны с действием продуктов окислительной модификации ионола в организме и/или взаимодействием препарата с эндогенными антиоксидантными системами с повреждением их защитных функций. Эти нарушения, как правило, носят кратковременный характер и нормализуются через 3 суток после введения препарата (см. табл. 9.3). К синтетическим антирадикальным средствам относятся также эмоксипин и пробукол. Эмоксипин - препарат класса 3-оксипириди- на, обладающий широким спектром биологического действия. Он ингибирует свободнорадикальное окисление, активно взаимодействует с перекисными радикалами липидов, гидроксильными радикалами пептидов, стабилизирует клеточные мембраны. Кроме того, препарат снижает агрегацию тромбоцитов и нейтрофилов, уменьшает полимеризацию фибрина, тормозит переход фибрина-мономера в фибринполимер, ингибирует фосфодиэстеразу циклических нуклеотидов, увеличивает содержание цАМФ и цГМФ в клетках. Первоначально эмоксипин был предложен для применения в офтальмологической практике, однако впоследствии с успехом стал применяться в лечении других заболеваний, сопровождающихся усилением перекисного окисления липидов и гипоксией (инфаркт миокарда, реперфузионный синдром, нестабильная стенокардия, ишемические и геморрагические нарушения мозгового кровообращения различного генеза). В остром периоде инфаркта миокарда препарат ограничивает величину очага некроза, улучшает сократи- тельную способность сердца и функцию его проводящей системы. В этом случае его можно комбинировать с изосорбида-5-монони- ратом, что позволяет достичь большего антиангинального и про-
тивоаритмического эффектов, предотвратить развитие сердечной недостаточности и разрыва миокарда. При острых ишемических нарушениях мозгового кровообращения эмоксипин уменьшает тяжесть общемозговой и локальной неврологической симптоматики, повышает устойчивость ткани к гипоксии и ишемии. При повышенном АД оказывает гипотензивный эффект. Обладает ретинопротекторными свойствами, защищает сетчатку от повреждающего действия света высокой интенсивности, способствует рассасыванию внутриглазных кровоизлияний, уменьшает проницаемость капилляров. Препарат используется также для профилактики осложнений при коронарной ангиографии (за день до манипуляции и в день процедуры внутривенно капельно 10 мл 1% раствор эмоксипина в 100 мл изото- нического раствора натрия хлорида со скоростью 20-30 капель в мин) (табл. 9.8). Эмоксипин эффективен в комплексной терапии наджелудочковой тахикардии и тахи-бради формы синдрома слабости синусного узла у детей (при данной патологии он превосходит мексидол). Побочные эффекты эмоксипина представлены в табл. 9.3. Пробукол (фенбутол) относится к производным бутилфенолов и является гиполипидемическим средством. Он вызывает подавление синтеза холестерина на ранних стадиях, в определенной мере снижает его абсор- бцию из кишечника, увеличивает обратный транспорт холестерина из периферических тканей в печень. Мало влияет на концентрацию в крови триглицеридов и липопротеидов очень низкой плотности, практически не влияет на рассасывание уже существующих бляшек. Препарат медленно всасывается при приеме внутрь, хорошо растворяется в жировой ткани, постепенно выделяясь в кровь, поэтому его действие сохраняется в течение длительного времени (до шести ме- сяцев после прекращения терапии). Выделяется в основном с желчью и калом, в малой степени с мочой. Особенность действия пробукола состоит в том, что он, связывая активные формы кислорода, предотвращает свободнорадикальное окисление ЛПНП в плазме крови, тем самым уменьшает их захват макрофагами и превращение последних под эндотелием сосудов в «пенистые» клетки, образующие основу атеросклеротической бляшки. Под влиянием препарата увеличивается активность антиоксидантных ферментов.
В исследовании MVP при использовании пробукола отмечено восстановление функции эндотелия у больных ИБС, уменьшение случаев рестеноза после коронарной ангиопластики (при применении не менее чем за 4 недели до процедуры и последующем лечении в течение 6 месяцев). Другие антиоксиданты (α-токоферол в высоких дозах (700 мг/сут), β-каротин и ви- Таблица 9.8. Основные показания к применению и схемы назначения эмоксипина  тамин С) оказались в этом случае неэффективны. В некоторых работах показано, что пробукол способствует уменьшению зоны некроза при ишемии миокарда. Показания к применению препарата представлены в табл. 9.9. Таблица 9.9. Основные показания к применению и схемы назначения пробукола 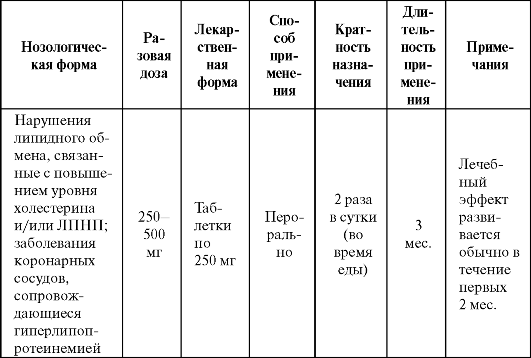 Антирадикальная активность имеется также у синтетических препаратов, обладающих и другими фармакологическими свойствами. Например, диметилсульфоксид (димексид) широко используется в фармации в качестве растворителя лекарственных веществ, нерастворимых в воде. Кроме того, он облегчает проникновение лекарственных средств через биологические барьеры (кожу, слизистые оболочки и т. п.), т. е. обладает свойствами «пенетранта», оказывает местноанестезирующее, анальгетическое и противомикробное действие, обладает умеренной фибринолитической активностью. В качестве антиоксиданта диметилсульфоксид является очень эффективной «ловушкой» для гидроксильного радикала, обладающего наиболее выраженным повреждающим действием. Используется как наружное средство при воспалительных и некоторых других заболеваниях опорно-двигательного аппарата (табл. 9.10). Весьма высокий и устойчивый антиоксидантный эффект препарата обнаружен при тяжелых черепно-мозговых травмах. При данной патологии димексид, повышая антиоксидантный статус организма и
препятствуя развитию вторичного повреждения головного мозга, определяет нейропротекторный эффект. Побочные эффекты препарата представлены в табл. 9.3. Таблица 9.10. Основные показания к применению и схемы назначения диметилсульфоксида в качестве антиоксиданта 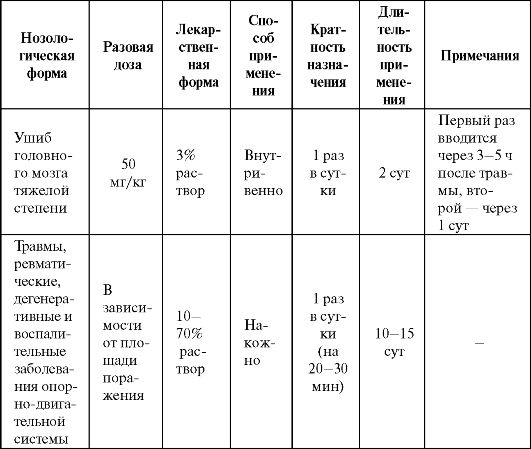 Тирилазад мезилат (фридокс) представляет собой 21-аминостероид (лазароид), сходный по строению с глюкокортикоидами, но лишенный их гормональных свойств. Данный препарат был создан после того, как было установлено, что нейропротективный эффект глюкокортикоидов (в частности, метилпреднизолон) реализуется, в том числе, за счет антиоксидантного действия. Тирилазад по антиоксидантной активности более чем в 100 раз превосходит глюкокортикоиды. Препарат обладает прямым антирадикальным эффектом (особенно в отношении гидроксильных радикалов), угнетая реакции ПОЛ, а также способствует сохранению в мембранах клеток α-токоферола, являющегося природным антиоксидантом. Стабилизирует клеточную мембрану, снижая ее текучесть. Фармакокинетика тирилазада имеет значимые половые различия - общие уровни активных метаболитов в крови у женщин сред- него возраста составляют менее 50% от аналогичных показателей у мужчин среднего возраста. Препарат обладает заметной тропностью к нервной ткани, в силу чего он был предложен к применению при субарахноидальных кровоизлияниях у мужчин с целью повышения выживаемости и улучшения функционального исхода, в том случае, если причиной субарахноидального кровоизлияния является разрыв аневризмы сосуда мозга (табл. 9.11). Таблица 9.11. Основные показания к применению и схемы назначения тирилазада мезилата 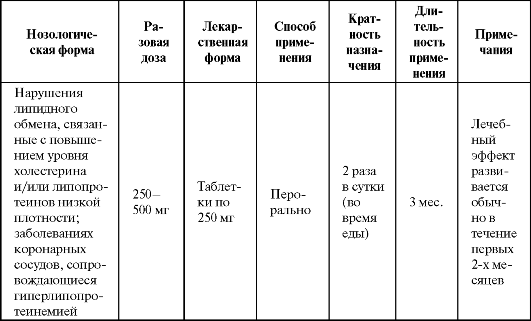 Хотя тирилазад показал высокую эффективность в эксперименте, его клиническое изучение в 6 клинических плацебоконтролируемых исследованиях не принесло ожидаемых результатов - он не снижал летальность пациентов с острым нарушением мозгового кровообращения, а у некоторых категорий больных увеличивал комбинированную конечную точку (смертность + инвалидность) почти на 20%. Кроме того, препарат имеет крайне высокую стоимость. Вследствие этого перспективы применения тирилазада представляются весьма сомнительными.
Эхинохром-а (гистохром) - хиноидный пигмент морских беспозвоночных, получаемый в настоящее время синтетически. Он обладает антирадикальными свойствами и нейтрализует основные инициаторы неферментного ПОЛ, накапливающиеся в зоне ишемического повреждения ткани. Помимо этого препарат стабилизирует клеточные мембраны и выступает как хелатор металлов переменной валентности (в первую очередь железа, играющего важную роль в инициации свободнорадикальных процессов). По антиоксидантной активности эхинохром-а значительно превосходит ионол. Основными областями применения препарата являются кардиология и офтальмология (табл. 9.12). Эхинохром-а оказывает кардиопротективное действие; при его применении у пациентов с успешной тромболитической терапией инфаркта миокарда (ИМ), снижая частоту реперфузионных аритмий, в том числе угрожающих жизни пароксизмальных желудочковых и наджелудочковых тахикардий, не оказывая существенного влияния на атриовентрикулярную и внутрижелудочковую проводимость. Препарат замедляет формирование очага и ограничивает зону некроза в течение первых 2-3 суток после ИМ. При этом улучшается сократительная способность левого желудочка и уменьшается частота развития острой сердечной недостаточности (ОСН) на протяжении первых суток заболевания. Эхинохром-а подавляет агрегацию эритроцитов и тромбоцитов. В офтальмологии эхинохром-а является средством для лечения воспалительных заболеваний роговицы, сосудистой оболочки и сетчатки глаза; патологии, связанной с нарушением трофики тканей глаза и для резорбции крови в стекловидном теле и сетчатке. Побочные эффекты препарата представлены в табл. 9.3. NXY-059 (Церовив) стал новой попыткой использования антиоксидантов в терапии ишемического инсульта. Препарат представляет собой дисульфонильное производное фенилбутилнитрона, обладает выраженной антирадикальной активностью и вводится пациентам с ишемичесим инсультом в виде непрерывной инфузии на протяжении 72 ч. В отличие от исследовавшихся ранее препаратов, время, в течение которого церовив является эффективным, составляет не 3, а 6 ч после развития инсульта.
Полученные к настоящему времени в исследованиях SAINT и SAINT I клинические данные свидетельствуют, что применение NXY- 059 в течение 6 ч после начала острого ишемического инсульта хотя и не снижает смертность, но статистически значимо улучшает восстанов- ление больных в срок 90 суток и снижает уровень их инвалидности. Так, больные, получавшие препарат, восстанавливались после инсульта без каких-либо видимых последствий на 4,4% чаще, чем больные, получавшие плацебо, а число пациентов, способных самостоятельно ходить и обслуживать себя без посторонней помощи, оказалось пос- Таблица 9.12. Основные показания к применению и схемы назначения эхинохрома-а 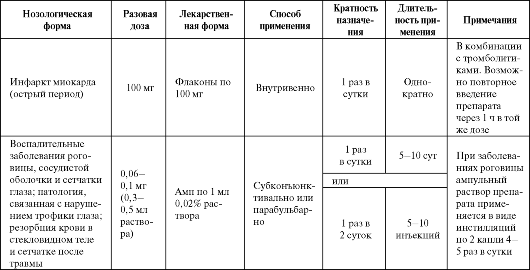 ле лечения NXY-059 на 3,7% выше, чем в контрольной группе. Кроме того, у пациентов, получавших исследуемый препарат, наблюдался меньший риск развития внутричерепного кровоизлияния - 6,4% случаев; в группе контроля этот показатель составил 20,9%. Дополнительным важным преимуществом препарата является и отсутствие видимых побочных эффектов. Разница между числом побочных явлений (запоров, гипертермии) в исследованиях не имела статистичес- кой значимости, кроме гиперкалиемии, которая отмечалась у 6,4% пациентов из группы лечения NXY-059 и в 4,4% случаев в группе плацебо. В то же время возможность улучшения нейрофункциональных исходов, оцененных по шкале инсульта Национальных институтов здоровья (National Institutes of Health Stroke Scale (NIHSS), не подтвердилась. К сожалению, такая возможность не подтвердилась и в исследовании SAINT II, что привело к приостановке дальнейшей разработки этого препарата. Ацетилцистеин (NAC, АЦЦ) является тиолсодержащим соединением, в основном применяющимся в качестве муколитика. Препарат обладает заметной антиоксидантной активностью, наиболее активно взаимодействуя с гидроксильным радикалом и перекисью водорода:
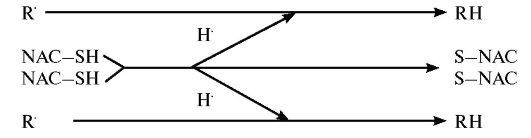 Экспериментальные работы на животных выявили его высокий антиоксидантный потенциал, однако клинические перспективы при- менения ацетилцистеина в качестве антиоксиданта пока до конца не определены. К сожалению, препарат не проникает через гематоэнцефалический барьер, что делает невозможным его применение при ишемических поражениях ЦНС. Прямая антиоксидантная активность ацетилцистеина, а также его способность участвовать в синтезе глутатиона, имеет важное значение в реализации его антиоксидантного и муколитического эффекта, например, при хронической обструктивной болезни легких (ХОБЛ). Он доказанно снижает уровень легочных оксидантов (в частности, уровня перекиси водорода) в конденсате выдыхаемого воздуха у больных с ХОБЛ. На фоне длительной терапии АЦЦ снижение числа обострений ХОБЛ показано как минимум в 12 рандомизированных клинических исследованиях (включавших более 2000 больных), результаты которых были проанализированы в трех независимых метаанализах. Так, по данным крупного исследования BRONCHUS, которое длилось около 3 лет, АЦЦ, назначаемый ежедневно в дозе 600 мг/сут, приводил к уменьшению частоты развития обострений у больных ХОБЛ, не получающих ингаляционные глюкокортикоиды, на 22%. Одновременно АЦЦ оказывал положительное влияние на выраженность легочной гиперинфляции: терапия препаратом позволяла снизить функциональную остаточную емкость легких на 374 мл, в то время как на фоне плацебо данный параметр увеличивался на 8 мл. При этом следует отметить, что достоверный положительный эффект наблюдается только у больных, получающих АЦЦ в дозах более 400 мг/сут в течение длительного периода (до 3-х лет) и увеличивается с повышением дозы АЦЦ. Установлена профилактическая эффективность АЦЦ для предупреждения развития контраст-индуцированной нефропатии (КИН) у пациентов с острым инфарктом миокарда (с подъемом сегмента ST), которым выполняется первичное чрескожное коронарное вмешательство (ЧКВ).
Участники исследования были рандомизированы в соотношении 1:1:1 на получение стандартной дозы АЦЦ (внутривенный болюс 600 мг перед ЧКВ и по 600 мг внутрь дважды в сутки в течение 48 ч - общая доза 3000 мг), высокой дозы АЦЦ (1200 мг внутривенным болюсом с последующим пероральным приемом по 1200 мг дважды в сутки в те же сроки - общая доза 6000 мг) или плацебо. После ЧКВ всем участникам проводилась гидратация изотоническим раствором на- трия хлорида из расчета 1 мл/кг массы тела в час или 0,5 мл/кг в час при наличии явной сердечной недостаточности в течение 12 ч. Первичной конечной точкой испытания считалось развитие КИН, определенной как повышение уровня креатинина сыворотки крови на 25% от исходного уровня и более в течение 72 ч после ЧКВ. Применение АЦЦ у больных инфарктом миокарда, подвергаемых первичному ЧКВ, значительно снижает риск развития КИН (в контрольной группе КИН отмечена у 33% участников, в группе стандартной дозы - у 15% и в группе высокой дозы - у 8% больных (р < 0,001); при определении КИН как повышения уровня креатинина на ≥ 44 мкмоль/л, она встретилась у 18, 6 и 3% пациентов соответственно (р < 0,001)). Эта профилактическая эффективность препарата выглядит дозозависимой и сопровождается лучшими госпитальными исходами. При этом АЦЦ предупреждал развитие КИН не только у лиц с исходной почечной дисфункцией, но также и без нее. Кроме того, отмечена меньшая частота КИН среди пациентов с умеренным или выраженным снижением систолической функции левого желудочка. При рассмотрении комбинированной конечной точки (смерть, острая почечная недостаточность, требующая гемодиализа, искусственная вентиляция легких) неблагоприятные события также отмечены чаще в контроле (18%), чем в группе стандартной (7%) и высокой (5%) дозы АЦЦ (р = 0,002).
Показана эффективность АЦЦ в комбинации с витамином Е, деферроксамином и селеном при неонатальном гемохроматозе (см. выше). Антирадикальной активностью обладают ряд антигипоксантов, в частности, флавоноидсодержащие соединения, некоторые природ- ные и синтетические адаптогены. Следует отметить, что в целом синтетические антиоксиданты характеризуются более частыми нежелательными эффектами по сравнению с эндогенными соединениями. Для определения показаний и противопоказаний к назначению синтетических антиоксидантов, безусловно, требуются дальнейшие исследования. |
