КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИОКСИДАНТОВ. Клиническая фармакология антиоксидантов
 Скачать 3.89 Mb. Скачать 3.89 Mb.
|
|
9.2. АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ И ИХ АКТИВАТОРЫ Препараты супероксиддисмутазы • Эрисод. • Орготеин (Пероксинорм). К настоящему времени создано несколько препаратов на основе антиоксидантного фермента супероксиддисмутазы (СОД) - эрисод и орготеин. Действие супероксиддисмутазы заключается в превращении супероксиданион-радикала в перекись водорода, а далее каталаза способствует распаду перекиси водорода до молекул воды. Основные показания к применению эрисода представлены в табл. 9.13. Орготеин (пероксинорм) является препаратом СОД животного про - исхождения. В отличие от эрисода, может вводиться внутримышечно и подкожно, нейтрализуя активные кислородные радикалы в меж- клеточном пространстве, которые образуются при воспалительных процессах или реакциях под действием ионизирующего облучения. Период полувыведения препарата зависит от пути введения и может варьировать от 0,5 до 6 ч. Показано, что при введении орготеина в пораженные артритическим процессом суставы в периартикулярных тканях и синовиальной жидкости происходит значительное снижение уровня супероксидных радикалов, продуцируемых фагоцитирующими клетками. Это приводит к уменьше-
Таблица 9.13. Основные показания к применению и схемы назначения эрисода 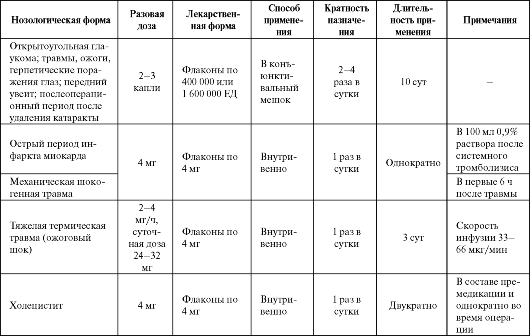 нию деполимеризации гиалуроновой кислоты и коллагена, снижению деградации протеогликанов и предотвращению повышения уровня простагландинов. Последний эффект также может быть связан с уменьшением орготеином активации фосфолипазы А2. В результате происходит уменьшение боли, восстановление функции у больных с дегенеративными заболеваниями суставов (остеоартрит, ревматоидный артрит, артрозы). При этом показано, что эффекты при внутрисуставном введении препарата сопоставимы с таковыми при применении глюкокортикоидов (бетаметазона, метилпреднизолона). Впрочем, при лечении ревматоидного артрита клиническая эффективность орготеина уступает препаратам золота (эффективность соответственно 86% против 52%), однако количество побочных эффектов при применении орготеина значительно меньше. У пациентов с раком мочевого пузыря орготеин предотвращает или уменьшает побочные эффекты, вызванные облучением. Снижаются боли, дизурия, явления цистита, эпизоды диареи, при этом применение препарата не препятствует реализации противоопухолевого эффекта лучевой терапии. При болезни Пейрони (хроническое уплотнение соединительной ткани в области полового члена) введение орготеина может умень- шить симптомы болезни. Однако возможные побочные эффекты (болезненность инъекции, гематомы, анафилактические реакции) ограничивают использование препарата при данной патологии. Основные показания к применению препарата представлены в табл. 9.14. Достоинством препаратов СОД является их малая токсичность как эндогенных соединений. К недостаткам относится возможность развития аллергических реакций из-за белковой природы препаратов (требуется введение пробных доз) (см. табл. 9.3), небольшой период полужизни в плазме при внутривенном введении (около 5 мин), а также их довольно высокая стоимость. Кроме того, не всегда отмечается выраженная эффективность данных средств вследствие их недостаточной биодоступности, обусловленной большим размером молекулы фермента. Для увеличения биодоступности и эффективности делаются попытки создать липосомальную лекарственную форму СОД (так называемые СОД-наночастицы). Другим путем повышения эффективности препаратов СОД является пролонгирование длительности их действия с помощью конъюгации с полиэтиленгликолем - так называемая ПЭГ-СОД. Первое клиническое исследование по применению такой формы препарата (в дозе от 5000 до 10 000 ЕД/кг) у паци- ентов с черепно-мозговой травмой дало обнадеживающие результаты.
Теоретически наиболее оправданным представляется сочетанное применение как супероксиддисмутазы, так и каталазы, поскольку они Таблица 9.14. Основные показания к применению и схемы назначения орготеина 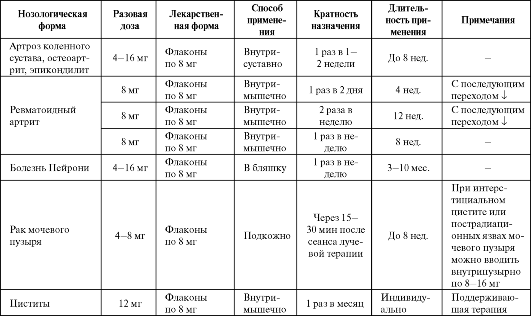 катализируют последовательно протекающие реакции нейтрализации активных форм кислорода. Препараты ферроксидазы (церулоплазмина) • Церулоплазмин. Церулоплазмин - медьсодержащий гликопротеид, относящийся к α2-глобулиновой фракции плазмы крови. В состав молекулы ЦП входит по различным данным 6-7 ионов меди. Благодаря способности ЦП окислять Fe2+ до Fe3+ белок получил также систематическое название - ферроксидаза.  В то же время в присутствии гомоцистеина ЦП способен ускорять окисление липопротеидов низкой плотности за счет восстановления ионов Cu2+ в ЦП до Си+. Альдегидная группа глюкозы также способна усилить действие ЦП в процессе окисления ЛПНП. Окисление ЛПНП зависит также от интактности молекулы ЦП и количества ионов меди, связанных с ЦП. Таблица 9.15. Основные показания к применению и схемы назначения церулоплазмина 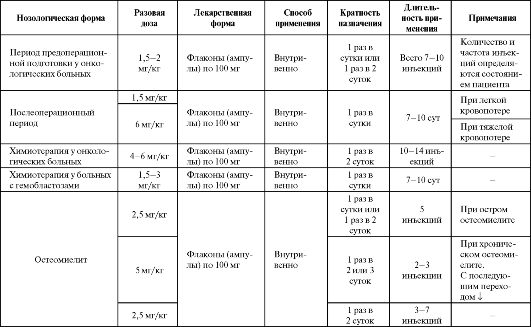 Установлено, что у больных, перенесших тяжелый гипоксический эпизод, активность ЦП в крови снижена до 15-20% от нормального уровня. Резкое снижение активности ЦП в раннем послеоперационном периоде - один из признаков развития полиорганной недостаточности. В качестве лекарственного препарата ЦП используется как антиоксидант и стимулятор гемопоэза, уменьшающий интоксикацию и иммунодепрессию (табл. 9.15). Включение ЦП в комплекс предоперационной подготовки и в раннем послеоперационном периоде позволяет снизить степень тканевой гипоксии и эндогенной интоксикации, улучшить внутриклеточные окислительно-восстановительные процессы, состояние системы гемостаза, функции дыхания и кровообращения. У онкологических больных препарат дает возможность расширить показания к оперативным вмешательствам по поводу рака легкого, кардиального отдела желудка и пищевода с низкими функциональными резервами дыхания и одновременно снизить число послеоперационных осложнений и летальность.
После внутривенного введения изменение концентрации ЦП в сыворотке крови происходит в несколько фаз. В первые часы его содержание резко повышается, затем вследствие распределения между сосудистым и внесосудистым руслом снижается и далее стабилизируется. Через 144 ч после введения препарат не обнаруживается в сыворотке. Период полужизни ЦП 72 ч. Побочные эффекты ЦП достаточно редки и в значительной мере определяются скоростью введения препарата (см табл. 9.3). Активаторы антиоксидантных ферментов • Натрия селенит (Селеназа). К модуляторам активности антиоксидантных ферментов может быть отнесен селенит натрия, действие которого связывают с активацией глутатионпероксидазы, в состав которой входит атом селена и недостаток которого может привести к снижению активности данного фермента. Кроме того, селензависимыми ферментами являются тиоредоксинредуктаза и 5-дейодиназа. Помимо этого селен входит в состав селенопротеинов Р и W, содержащихся в плазме. Под влиянием селена и селенсодержащих ферментов происходит ингибирование активности протеинкиназы С, 5-липоксигеназы, циклооксигеназы и НАДФ-оксидазы, а также обнаружено синергич- ное действие с а-токоферолом. В виде монопрепарата селенит натрия широкого применения не получил, однако в клинических исследованиях он показал неплохой результат у пациентов с острым нарушением мозгового кровообраще- ния (табл. 9.16), значимо уменьшая размеры очага инфаркта мозга, но не влияя на явления вазоспазма. Таблица 9.16. Схема назначения селена при остром нарушении мозгового кровообращения (по данным клинических исследований)
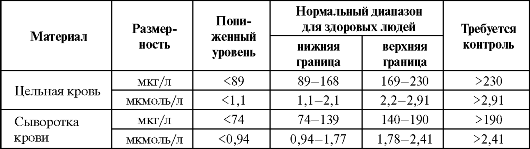
Эффект был более выражен при возможно более раннем начале терапии или если препарат назначался парентерально (внутривенно). Однако окончательного ответа на вопрос о безопасности и эффективности применения высоких доз селена пока не получено. Показана эффективность селена в комбинации с АЦЦ, витамином Е и деферроксамином при неонатальном гемохроматозе (НГ) - тяже- лом, часто фатальном нарушении метаболизма железа у новорожденных, приводящем к развитию острой печеночной недостаточности. Кроме печени органами-мишенями при данной патологии являются поджелудочная железа, сердце и эндокринные железы. Антиоксидантная и комплексная терапия при данном заболевании включает специфически связывающий ионы железа деферрок- самин (30-40 мг/кг в сут), а также антиоксиданты - селен (3 г/кг в сут), а-токоферол (20 мг/кг в сут) и N-ацетилцистеин (50 мг/кг 3 раза в сутки). Лечение продолжается до достижения уровней ферритина не ниже 500 г/л или пока не выполняют трансплантацию печени. При НГ раннее лечение антиоксидантами и трансплантация печени в дополнение к оптимальному медицинскому обслуживанию позволяют достичь достаточно благоприятного результата (частота выживания пациентов с НГ после 1-го года может составлять 75%, после 2 лет - 70%). Показана эффективность дополнительного назначения селена при состояниях, характеризующихся выраженной активацией процессов свободнорадикального окисления и сопровождающихся развитием дефицита по этому микроэлементу (табл. 9.17). При этом следует ориентироваться на референтные диапазоны уровня селена в крови (табл. 9.18). Таблица 9.17. Рекомендации по применению селена при патологических состояниях, сопровождающихся развитием его дефицита 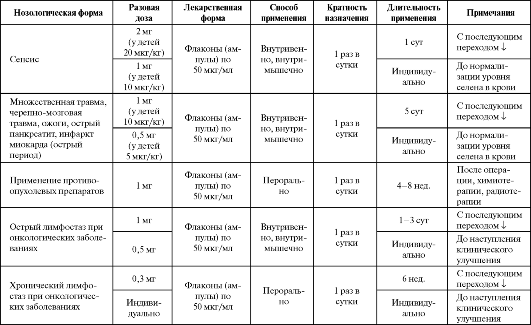 Таблица 9.18. Референтные значения уровня селена в крови (Neve J., 1991; Winnefeld K. et al., 1995; Clark L. C. et al., 1996; Thomas L., 2000)
 Вопрос о дополнительном использовании селена в качестве средства профилактики гастроинтестинальных опухолевых заболеваний окончательно не решен, но, по-видимому, в этом нет необходимости, поскольку селен и так в достаточном количестве содержится в продуктах питания, а многочисленные клинические исследования не подтвердили его антираковых свойств. Более того, появились данные о существовании рисков, связанных с избыточным приемом селена (повышение более чем в полтора раза частоты развития сахарного диабета второго типа при регулярном на- значении препарата ежедневно по 200 мкг в течение 8 лет). Эти сведения требуют проведения дополнительных исследований, тем более, что ранее в экспериментах на животных были получены данные о благотворном влиянии селена на метаболизм глюкозы. Достаточно широкое применение селен нашел как компонент ряда поливитаминных препаратов, содержащих различные витамины с ан- тиоксидантным действием (табл. 9.19). Таблица 9.19. Состав некоторых селенсодержащих поливитаминных препаратов 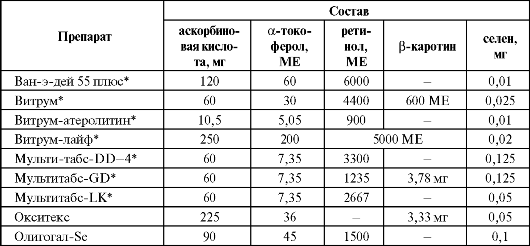 Окончание табл. 9.19 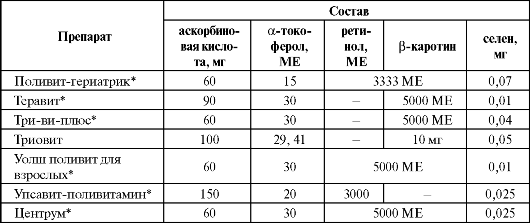 Примечание: * - препараты содержат другие витамины и/или микроэлементы, помимо указанных в таблице. Изучению эффективности витаминных комбинаций было посвящено несколько исследований. Так, дополнительное введение в рацион плохо питающегося китайского населения β-каротина, α-токоферола и селена уменьшало частоту развития рака желудка, летальность от него и общую онкологическую летальность от 13 до 21%. В небольшом французском исследовании дополнительное назначение комбинации витамина C, витамина Е, β-каротина, селена и цинка уменьшало частоту развития онкологической патологии у мужчин на 31% (у женщин аналогичного эффекта получено не было). В то же время поливитаминные и минеральные добавки не оказывали никакого существенного эффекта на сердечно-сосудистую забо- леваемость или риск развития катаракты.
Таким образом, на сегодняшний день получено недостаточно данных, доказывающих наличие или отсутствие пользы от использования поливитаминных и минеральных препаратов с антиоксидантным действием для предотвращения онкологических и других хронических заболеваний. Выраженность и клиническая значимость антиоксидантного действ\ия компонентов в данных комбинациях не ясна и требует убедительных доказательств. 9.3. БЛОКАТОРЫ ОБРАЗОВАНИЯ СВОБОДНЫХ РАДИКАЛОВ • Аллопуринол (Милурит). • Оксипуринол. • Антигипоксанты (см. лекцию «Клиническая фармакология антигипоксантов»). Вторичная антиоксидантная активность характерна для всех антигипоксантов, поскольку эти препараты при гипоксии предотвращают или уменьшают образование свободных радикалов благодаря нормали- зации функций митохондрий (уменьшается накопление высокоактивных форм кислорода) и энергостабилизирующему действию (предотвращается распад и усиливается ресинтез антиоксидантных ферментов, уменьшается разрушение фосфолипидов как источников субстратов для перекисного окисления). Во многих ситуациях использование антиоксидантной активности антигипоксантов является более рациональным, чем применение антиоксидантов, поскольку профилактика заболевания (в данном случае предотвращение образования свободных радикалов антигипоксантами) обычно эффективнее его лечения (нейтрализации образовавшихся радикалов антиоксидантами). Способность предотвращать возникновение свободных радикалов свойственна противоподагрическому препарату аллопуринолу (милурит). Этот эффект обусловлен ингибированием препаратом ксан- тиноксидазной реакции (схема 9.5), активно протекающей в ишемизированных тканях. В ходе этой реакции происходит превращение гипоксантина в ксантин, а затем в мочевую кислоту и активно образуется супероксиданион-радикал. При этом аллопуринол окисляется ксантиноксидазой до оксипуринола, который и блокирует активный центр фермента.
Это сопровождается снижением концентрации мочевой кислоты и ее солей в жидких средах организма и моче, что способствует растворению имеющихся уратных отложений и предотвращает их образование в тканях и почках, уменьшает оксидативное повреждение тканей. Есть данные об эффективности препарата в комплексном лечении острого панкреатита, как средства ограничения оксидативного стресса при радио- и химиотерапии опухолей. В экспериментах продемонстрировано, что супероксид анион, образующийся под действием миокардиальной ксантиноксидазы, играет важную роль в развитии дисбаланса между необходимой сократительной активностью левого желудочка и потреблением миокардом кислорода, который возникает при прогрессировании сердечной недостаточности (СН). В доклинических исследованиях у животных с сердечной недостаточностью эти препараты увеличивали сократительную активность миокарда, не влияя на потребность в кислороде. Этот эффект достигался путем увеличения чувствительности миофибрилл 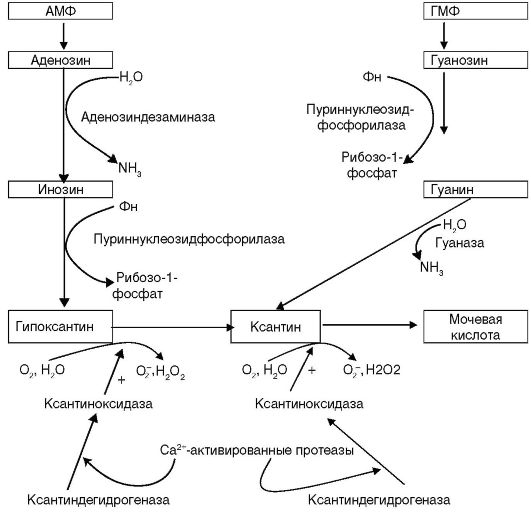 Схема 9.5. Образование высокоактивных форм кислорода ксантиноксидазой к кальцию. Результаты первых клинических исследований показали, что у больных с СН аллопуринол и оксипуринол на 40% увеличивают сократимость миокарда. При этом они обладают лучшим профилем безопасности, чем амринон и милринон, и могут использоваться как внутривенно, так и внутрь для лечения острой и хронической сердечной недостаточности. Основные показания к назначению аллопуринола как антиоксиданта представлены в табл. 9.20. Детям до 15 лет назначают внутрь по 10-20 мг/кг массы тела или 100-400 мг/сут. У пациентов с нарушением функции почек доза препарата не должна превышать 100 мг. Таблица 9.20. Основные показания к применению и схемы назначения аллопуринола в качестве антиоксиданта
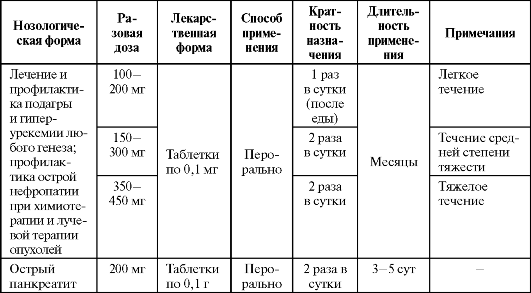 Побочные эффекты аллопуринола представлены в табл. 9.3. Таким образом, основными показаниями к применению антиоксидантов являются избыточно активированные процессы свободнорадикального окисления, сопровождающие различную патологию. Выбор конкретных препаратов, точные показания и противопоказания к их применению пока недостаточно разработаны и требуют дальнейших экспериментальных и клинических исследований. |
