Лекции для ТО. Конспект лекций по учебной дисциплине Материаловедение
 Скачать 3.21 Mb. Скачать 3.21 Mb.
|
|
Лекция 2 Формирование структуры литых материалов. План: Сущность процессов кристаллизации металлов и сплавов. Особенности строения слитков. Понятие о ликвации. Аллотропические превращения железа при нагреве и охлаждении. Гистерезис. Магнитные превращения Получение монокристаллов. Свойства аморфных металлов. Сущность процессов кристаллизации металлов и сплавов. Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии. С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 3.1. 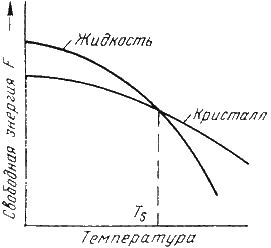 Рис.3.1. Изменение свободной энергии в зависимости от температуры В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом. При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная или теоретическая температура кристаллизации. Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называется фактической температурой кристаллизации. Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения (): Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждени). Рассмотрим переход металла из жидкого состояния в твердое. При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое. Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров. Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии. Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 3.2.  Рис.3.2. Кривая охлаждения чистого металла – теоретическая температура кристаллизации; . – фактическая температура кристаллизации. Процесс кристаллизации чистого металла: До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии. Механизм и закономерности кристаллизации металлов. При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется. Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым. Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.3. Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию. 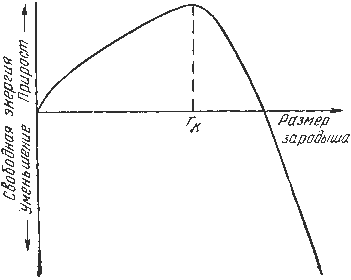 Рис.3.3. Зависимость энергии системы от размера зародыша твердой фазы Механизм кристаллизации представлен на рис.3.4.  Рис.3.4. Модель процесса кристаллизации Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело. Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.3.5). 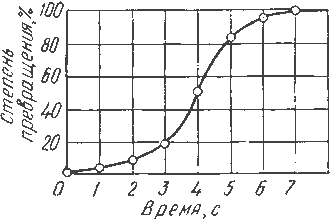 Рис. 3.5. Кинетическая кривая процесса кристаллизации Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться. Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров. В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 3.6). 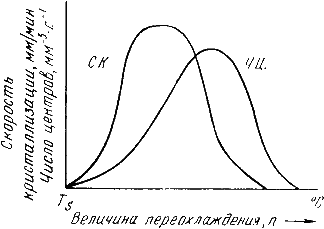 Рис. 3.6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации. При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит. Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая). При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая). Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело. Для металлов, обладающих малой склонностью к переохлаждению, экспериментально обнаруживаются только восходящие ветви кривых. Условия получения мелкозернистой структуры Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов. Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды. Чем больше частичек, тем мельче зерна закристаллизовавшегося металла. Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации. Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы, По механизму воздействия различают: Вещества не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации. Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту. Особенности строения металлического слитка Схема стального слитка, данная Черновым Д.К., представлена на рис.3.7. 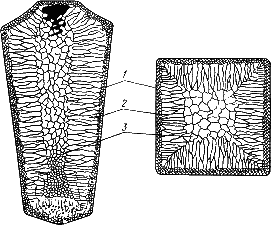 Рис. 3.7. Схема стального слитка Слиток состоит из трех зон: мелкокристаллическая корковая зона; зона столбчатых кристаллов; внутренняя зона крупных равноосных кристаллов. Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелкозернистая структура. Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера. Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты (рис. 3.8). Растут дендриты с направлением, близким к направлению теплоотвода. 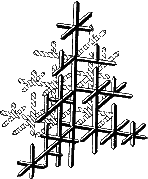 Рис.3.8. Схема дендрита по Чернову Д.К. Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией. Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией. Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка. В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15…20 % от длины слитка) Методы исследования металлов: структурные и физические Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа. Структурные методы исследования. Применяют макроскопический и микроскопический анализ, рентгеноструктурный анализ. Определение химического состава. Используются методы количественного анализа. 1. Если не требуется большой точности, то используют спектральный анализ. Спектральный анализ основан на разложении и исследовании спектра электрической дуги или искры, искусственно возбуждаемой между медным электродом и исследуемым металлом. Зажигается дуга, луч света через призмы попадает в окуляр для анализа спектра. Цвет и концентрация линий спектра позволяют определить содержание химических элементов. Используются стационарные и переносные стилоскопы. 2. Более точные сведения о составе дает рентгеноспектральный анализ. Проводится на микроанализаторах. Позволяет определить состав фаз сплава, характеристики диффузионной подвижности атомов. Физические методы исследования 1. Термический анализ основан на явлении теплового эффекта. Фазовые превращения в сплавах сопровождаются тепловым эффектом, в результате на кривых охлаждения сплавов при температурах фазовых превращений наблюдаются точки перегиба или температурные остановки. Данный метод позволяет определить критические точки. 2.Дилатометрический метод. При нагреве металлов и сплавов происходит изменение объема и линейных размеров – тепловое расширение. Если изменения обусловлены только увеличением энергииколебаний атомов, то при охлаждении размеры восстанавливаются. При фазовых превращениях изменения размеров – необратимы. Метод позволяет определить критические точки сплавов, температурные интервалы существования фаз, а также изучать процессы распада твердых растворов. 3 .Магнитный анализ. Используется для исследования процессов, связанных с переходом из паромагнитного состояния в ферромагнитное (или наоборот), причем возможна количественная оценка этих процессов. Понятие о ликвации. Слитки сплавов имеют неоднородный состав. Например, в стальных слитках по направлению от поверхности к центру и снизу вверх увеличивается концентрация углерода и вредных примесей – серы и фосфора. Химическая неоднородность по отдельным зонам слитка называется зональной ликвацией. Она отрицательно влияет на механические свойства. В реальных слитках помимо зональной встречаются и другие виды ликвации. Дендритная ликвация свойственна сплавам с широким температурным интервалом кристаллизации. Гравитационная ликвация образуется в результате разницы в плотностях твёрдой и жидкой фаз: например, в антифрикционном сплаве олова с сурьмой - твёрдая фаза ( кристаллы сурьмы ) опускаются на дно слитка, а эвтектика всплывает вверх. Аллотропические превращения железа при нагреве и охлаждении. Гистерезис. Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию. Примером аллотропического видоизменения в зависимости от температуры является железо (Fe). Fe: – ОЦК - ; – ГЦК - ; – ОЦК - ; (высокотемпературное ) Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла. Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз. Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки. Магнитные превращения Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы. При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко, и при определ¨нной температуре (точка Кюри) исчезают (точка Кюри для железа – ). Выше этой температуры металлы становятся парамагнетиками. Магнитные превращения не связаны с изменением кристаллической решетки или микроструктуры, они обусловлены изменениями в характере межэлектронного взаимодействия. Получение монокристаллов. Монокристаллы отличаются минимальными структурными несовершенствами. Получение монокристаллов позволяет изучать свойства металлов, исключив влияние границ зёрен. Применение в монокристаллическом состоянии германия и кремния высокой чистоты даёт возможность использовать их полупроводниковые свойства и свести к минимуму неконтролируемые изменения электрических свойств. Монокристаллы можно получить, если создать условия для роста кристалла только из одного центра кристаллизации. Свойства аморфных металлов. При высоких скоростях охлаждения из жидкого состояния (более 10 -6 С/сек) диффузионные процессы настолько замедляются, что подавляется образование зародышей и рост кристаллов. В этом случае образуется аморфная структура. Материалы с такой структурой получили название аморфные металлические сплавы (АМС), или металлические стёкла. Затвердевание с образованием аморфной структуры принципиально возможно практически у всех металлов. Контрольные вопросы. В чём разница между первичной и вторичной кристаллизацией металлов? Что показывают кривые охлаждения и как они строятся? Что характеризует горизонтальный участок на кривой охлаждения простых металлов? Почему на кривых охлаждения аморфных веществ нет горизонтального участка? Каков механизм процесса кристаллизации? При каком строении металлов обеспечивается высокая прочность и сопротивляемость ударным нагрузкам? Почему перегорает нить лампочки накаливания?(..с ростом зерна..) Как получить мелкозернистое строение металлов и сплавов? Что представляют из себя дендриты? Охарактеризуйте монокристаллы. Что такое гистерезис? Аллотропия? Полиморфизм? Что такое аморфные металлы? Какие процессы характеризует точка Кюри? |
