Контрольная по микробиологии. Контрольная работа Асептика. Микрофлора воды, воздушной среды и объектов производственных помещений аптек. Вопрос 1
 Скачать 191 Kb. Скачать 191 Kb.
|
|
Контрольная работа № 2. Асептика. Микрофлора воды, воздушной среды и объектов производственных помещений аптек. Вопрос 1. Химическая стерилизация: виды, область применения. Ответ: Стерилизация (обеспложивание) – полное уничтожение живых микроорганизмов и их покоящихся форм на объектах внешней среды (на медицинских инструментах, оборудовании, в лекарственных препаратах, аптечной посуде). Растворами химических препаратов нельзя стерилизовать изделия из влагонестойких материалов Химические методы стерилизации делятся:
для стерилизации разовых медицинских инструментов, крупного оборудования, которое невозможно стерилизовать другими методами (аппараты искусственной вентиляции лёгких, искусственно кровообращения), лекарственных препаратов, которые нельзя стерилизовать другими методами, бактериальных фильтров. Пары окиси этилена обладают высокими бактерицидными свойствами, легко проникают через различные ткани и материалы, не портят их, но являются взрывоопасными. Стерилизация окисью этилена осуществляется в течение 960 ± 5 мин. Взрывоопасность окиси этилена значительно уменьшается в смеси ее с бромистым метилом в весовом соотношении 1:2,5 (смесь ОБ). Бромистый метил не горит, но также обладает высокими бактерицидными свойствами. Смесь ОБ в 5 раз эффективнее каждого из компонентов, входящих в ее состав. Для стерилизации формальдегидом используют 16% раствор формалина (по формальдегиду). С. осуществляют в течение 300 ± 5 мин при температуре 75 ± 5° и относительной влажности воздуха 96 ± 2%. С окисью этилена и смесью ОБ выполняется в стационарных газовых стерилизаторах и микроанаэростате, формальдегидом — в стационарном формалиновом стерилизаторе. В качестве упаковочного материала используют полиэтиленовую пленку, пергамент, мешочную влагопрочную бумагу. Изделия, простерилизованные газовым методом, применяются после их выдержки в вентилируемом помещении:
Для нейтрализации формальдегида изделия перед применением погружают на 1 ч в 23—25% раствор аммиака. Метод требует проведения дегазации стерильного объекта.
перекись водорода. Используется преимущественно для стерилизации медицинских инструментов, которые нельзя стерилизовать термическими и другими методами. Стерилизация растворами химических препаратов выполняется в закрытых емкостях, покрытых неповрежденной эмалью, а также сделанных из стекла или пластмассы. Стерилизуемые объекты погружают в раствор при температуре 18 ± 2°. Время стерилизационной выдержки в 6% растворе перекиси водорода — 60 ± 5 мин, дезоксоне-1 — 45—50 мин. После С. изделия промывают стерильной водой в асептических условиях. Имеет ограниченное применение. Вопрос 2. Зависимость вида, режима, времени воздействия стерилизующего фактора от физико-химических параметров стерилизуемого объекта. Примеры. Ответ: Механизм стерилизующего действия этого метода не до конца ясен, но основной причиной губительного воздействия считается нарушение определенной физико-химической структуры оболочки и протоплазмы микроорганизмов применяемыми химическими агентами. Основные пути воздействия химических веществ:
Химическая стерилизация осуществляется:
Для стерилизации растворами чаще других применяются дезоксон-1 (надкислота) и водорода пероксид. Проводится стерилизация в неповрежденных эмалированных, стеклянных, пластмассовых сосудах. При стерилизации учитывается концентрация действующего химического агента, температура стерилизующего раствора, время стерилизационной выдержки. Например: 1. при стерилизации дезоксоном-1 температура стерилизующего раствора должна быть не менее 18 °С, время стерилизационной выдержки - 45 мин; 2. при стерилизации 6%-ным раствором водорода пероксида, температура стерилизующего раствора должна быть не менее 18 °С, время стерилизационной выдержки - 6 ч (при температуре 50 °С время выдержки сокращается до 3 ч). Необходимо полностью погружать изделия в стерилизующий раствор, а после стерилизации промывать в стерильной воде в асептических условиях. Для стерилизации газами и аэрозолями используются оксиды этилена и пропилена, полиэтиленоксиды, смеси этилена оксида с углерода диоксидом или метилом бромистым. Режим стерилизации газами зависит от многих факторов - свойств стерилизуемого материала, его толщины, проницаемости упаковки, а также индивидуальной чувствительности различных микроорганизмов к воздействию газов. Газы подаются в стерилизуемую среду при давлении до 2 кгс/см2, время стерилизации составляет от 4 до 20 ч. Например: для уничтожения стафилококков концентрация газа (этилена оксида) в воздухе должна составлять до 1000 мг/м3 в течение 6 ч, а для стрептококков концентрация газа снижается до 500 мг/м3 в течение того же времени. Метод химической стерилизации применим для резиновых, стеклянных, полимерных (коррозионно-стойких) изделий. Параметры стерилизации контролируются измерением температуры рабочего раствора и химическим определением концентрации активного химического агента. Вопрос 3. Предстерилизационная обработка оборотной аптечной посуды: цель, методы, химические реагенты. Обосновать необходимость проведения данного мероприятия. Ответ: 1.Освобожденную от упаковочного материала новую посуду и посуду, бывшую в употреблении ополаскивают снаружи и внутри проточной водопроводной водой для удаления механического загрязнения, остатков лекарственных веществ, а затем замачивают в растворе с 0,5 % раствором моющего средства, подогретом до температуры (50 ± 10)° С, в течение 15 минут. Сильно загрязненную посуду замачивают более продолжительное время (2 -3 часа). 2. После замачивания, посуду моют в этом же растворе с помощью ерша или моечной машины, затем ополаскивают не менее 5-7 раз в проточной водопроводной воде при температуре (50 ± 10) С и окончательно промывают водой очищенной. При машинном ополаскивании, в зависимости от типа моечной машины, время выдержки в режиме ополаскивания 5-10 минут. Чистота вымытой посуды и полнота смываемости моющих средств должна контролироваться по методикам, изложенным в приложении 6 к настоящим санитарным правилам. 3. Аптечную посуду, бывшую в употреблении, поступившую от населения или из инфекционных отделений больниц в аптеку, дезинфицируют свежеприготовленным раствором пероксида водорода 3 % или 0,25% раствором нейтрального гипохлорита кальция с экспозицией 30 минут. 4. Раствор пероксида водорода 3 % с моющим средством готовят на водопроводной воде. Для приготовления 10 л 3 % раствора пероксида водорода берут 1200 мл пергидроля, добавляя его к соответствующему количеству воды. В этом растворе посуду выдерживают в течение 80 минут. 5. Хранение приготовленных дезинфицирующих растворов должно быть не более 24 часов. 6. Повторное использование одного и того же дезинфицирующего раствора не допускается. После дезинфекции посуду промывают проточной водопроводной водой до исчезновения запаха дезинфицирующего средства и моют с моющим средством, согласно методике, изложенной в пункте 2 данного приложения. Контроль качества вымытой посуды 1. Определение степени чистоты вымытой посуды Контроль качества вымытой посуды проводят визуально по отсутствию посторонних включений и по равномерности отекания воды со стенок флаконов после их ополаскивания. При необходимости, полноту смываемости синтетических моющих и моющих и дезинфицирующих средств определяют по величине рН потенциометрическим методом (рН воды после последнего ополаскивания посуды должен соответствовать рН исходной воды). После ополаскивания каждый флакон и бутылку накрывают алюминиевой фольгой для предотвращения её загрязнения. 2. Определение полноты смываемости моющих средств Испытуемый вымытый флакон ополаскивают очищенной водой (флакон наполняется водой полностью). Промывной водой смачивают ватный тампон, наносят на него 1-2 капли спиртового раствора фенолфталеина. Наличие остатка моющих средств дает розовое окрашивание ватного тампона. Вопрос 4. Обосновать необходимость территориального разграничения производства воды для инъекций и других технологических процессов в аптеке. Ответ: Вода относительно благоприятная среда для жизни, роста и размножения микроорганизмов, так как в ней находится достаточное количество питательных веществ (источников азота, углерода, кислорода, водорода), что позволяет микроорганизмам не только сохраняться, но и размножаться в водной среде. Микрофлора воды открытых водоёмов подразделяется на резидентную и транзиторную. 1. Резидентная микрофлора состоит из сапрофитов – так называемая, автохтонная микрофлора водоемов. 2. Транзиторная (аллохтонная) микрофлора поступает из почвы, воздуха, живых организмов. Она может содержать и патогенную для человека микрофлору (как результат попадания фекальных хозяйственно-бытовых стоков в водоёмы): возбудителей дизентерии, брюшного тифа и паратифов, сальмонеллезов, холеры, энтеропатогенные кишечные палочки, энтеровирусы, вирусы гепатита А. Наличие в воде большого количества органических веществ значительно увеличивает степень микробной обсемененности. Численность микроорганизмов в воде различных водоемов
Основным источником фекального загрязнения водопроводной воды является подсос из окружающей среды при нарушении герметичности водопроводных труб; открытых водоёмов – городские хозяйственно-бытовые стоки, не очищенные предварительно, стоки с ферм и личных хозяйств в сельской местности. Водопроводная вода проходит несколько этапов очистки: а) очистка от взвешенных примесей, б) очистка от превалирующей массы микроорганизмов, в) дезинфекция воды: проводится обработкой воды газообразным хлором, озоном, ультрафиолетовыми лучами, после чего ее микробная обсемененность доходит до нормативной – не более 50 сапрофитных микробов в 1 мл. В технологии изготовления многих лекарственных форм используются растворители, одним из основных среди них является вода. Качество воды, используемой для аптечной и промышленной технологии, регламентируется ФС 42-2619-97 «Вода очищенная», ФС 42-2620-97 «Вода для инъекций». Воду очищенную и воду для инъекций в настоящее время получают чаще всего из воды водопроводной. От её качества будет зависеть качество воды очищенной и воды для инъекций. Санитарно-микробиологические показатели водопроводной воды регламентируются СанПиНом 2.1.4.1070-01: Общее микробное число воды – количество микроорганизмов в 1 мл воды – 50 КОЕ/мл, не должны обнаруживаться возбудители инфекционных заболеваний, кишечная палочка не должна обнаруживаться в 100 мл. Вода из любого источника очищается от примесей, которые подразделяются на 4 группы: а) механические, б) растворимые органические вещества, в) растворимые неорганические вещества, г) бактерии и пирогенны. Методы получения воды очищенной 1.Ионный обмен. Используются колонки с ионно-обменными смолами, которые делятся на 2 группы:
Недостатки: Используемые для деминерализации воды, ионно-обменные смолы являются прекрасным субстратом для размножения бактерий, поэтому данным методом нельзя пользоваться для получения воды для инъекций 2. Принцип обратного осмоса. Основан метод на использовании полупроницаемых мембран. Эти мембраны удерживают до 100% взвешенных коллоидных и растворенных веществ с молекулярной массой 200, и 95% веществ с более низкой молекулярной массой. Суть обратного осмоса: под давлением, превышающим осмотическое, высокоминерализованная вода диффундирует через полупроницаемую мембрану в отсек чистой воды. Недостатки: Нельзя контролировать наличие микроскопических дефектов (уже имеющихся или возникающих под давлением фильтруемой воды), что ведет к попаданию микроорганизмов в чистую воду. 3. Дистилляция. Самый широко применяемый и эффективный метод получения воды для любого назначения: как очищенной, так и для инъекций. Этапы дистилляции: а) нагрев исходной воды до кипения и парообразования; б) поступление пара в конденсатор и конденсация; в) поступление конденсата в водоприемник: хранение и использование путем подачи через систему трубопроводов или иных механизмов доставки на рабочие места. Недостатки: Теоретически, дистиллят, полученный с соблюдением всех технологических правил перегонки воды, не должен содержать химических примесей выше допустимых пределов, должен быть стерильным и апирогенным. На практике это не всегда получается. Причины: а) неравномерная скорость кипения приводит к забросу капель исходной воды в конденсатор; б) санитарное состояние дистиллятора, водоводов, водоприемников: нарушение правил подготовки к работе указанных объектов способствует проникновению и накоплению микроорганизмов на внутренних поверхностях аппаратуры и труб (Приказ №309 от 21 октября 1997 г.) Для предотвращения размножения микроорганизмов в полученной воде рекомендовано хранить её в одном из двух температурных режимов: а) +5- +100С (холодовый режим), б) +80- +950С (тепловой режим) Вода очищенная, используемая для приготовления растворов, не подлежащих стерилизации в конечной упаковке, должна быть стерильной. Это растворы следующего назначения: а) глазные капли, б) офтальмологические растворы для орошения в микрохирургии глаза; в) растворы для внутреннего и наружного применения для новорожденных. Если данные растворы стерилизуются в конечной упаковке, то воду предварительно не стерилизуют. Нормативы санитарно-микробиологического состояния воды очищенной регламентируются ФС 42-2619-97: 100 микроорганизмов суммарно (бактерии и грибы) в 1 мл, отсутствие энтеробактерий, синегнойной палочки и золотистого стафилококка; срок хранения не более 3 суток. Вода для инъекций используется для изготовления инъекционных и инфузионных растворов, которые вводятся парентерально (минуя защитные кожно-слизистые барьеры). Поэтому к ней предъявляются более строгие санитарно-микробиологические требования. Согласно ФС 42-2620-97, вода для инъекций должна соответствовать требованиям, предъявляемым к воде очищенной и должна быть апирогенной. Срок хранения не более 24 часов, в асептических условиях при температурном режиме 5-100С (холодовый) или 85-950С (тепловой). Вопрос 5. Пирогенная реакция организма: патогенез, клинические проявления. Экзогенные пирогенны - бактериальной и небактериальной природы. Ответ: Пирогеннами называют такие вещества, которые, попадая в организм извне или образуясь внутри его, вызывают лихорадку. Пирогенны разделяют на бактериальные и небактериальные (экзогенные). Экзогенные пирогенны, представлены в основном микроорганизмами, их токсинами и продуктами жизнедеятельности. Типичный пример экзогенного пирогенна - эндотоксин . Он представляет собой липополисахарид наружной мембраны грамотрицательных бактерий и состоит из липида A, полисахаридного ядра и боковой цепи - O-полисахарида. Последовательность олигосахаридов в боковой цепи у всех бактерий разная. Компоненты клеточной стенки грамположительных бактерий (липотейхоевые кислоты и пептидогликаны ) - это тоже мощные пирогены. Патологические штаммы стрептококков и стафилококков могут вырабатывать экзотоксины и энтеротоксины, которые действуют как бактериальные суперантигены. Они связываются с антигенраспознающими рецепторами Т-лимфоцитов за пределами антигенраспознающего центра и активируют многие клоны Т-лимфоцитов, что приводит к высвобождению медиаторов и повреждению тканей. Эти токсины отвечают за развитие токсического шока. Доза эндотоксина, способная вызвать у человека лихорадку, составляет 1 нг/кг. Доза компонентов клеточной стенки грамположительных бактерий, необходимая для выработки эндогенных пирогенов in vitro, на 2-3 порядка больше (эксперименты in vivo у людей не проводились). Большинство экзогенных пирогенов вызывают лихорадку, стимулируя образование эндогенных пирогенов клетками микроорганизма (обычно это моноциты и макрофаги). Но из этого правила есть исключения. Так, эндотоксин вызывает лихорадку без участия эндогенных пирогенов, воздействуя на эндотелиальные клетки в головном мозге. пирогенные вещества и вирусы. Бактериальные пирогенны – продукты жизнедеятельности и распада бактерий. По химической природе бактериальные пирогенны – полисахариды и полипептиды с молекулярной массой 8х106, размером от 50 нм до 1 мкм. Пирогенными свойствами обладают практически все бактерии: патогенные и сапрофитные, грамотрицательные и грамположительные. Но пирогенность грамотрицательных бактерий почти в 100 раз выше за счет липидных компонентов клеточной стенки (ЛПС и ЛПП). Например: пирогенность извлечений из Bac. subtillis для кролика проявляется при введении дозы 0,08мкг/кг и выше; ЛПС из возбудителей брюшного тифа (S.typhi) вызывает пирогенную реакцию у кролика в дозе 0,06 мкг/кг, а из протея (Pr. vulgaris) – в дозе 0,012 мкг/кг. У грамположительных бактерий пирогенность обусловлена преимущественно пептидогликаном. Практически нет ни одного органа или ткани, системы, в которых не отмечалось бы функциональных сдвигов после введения в организм бактериальных пирогенов. Клиника пирогенной реакции проявляется в следующих симптомах: озноб, повышение температуры; нарушение деятельности сердечно-сосудистой системы, падение артериального давления, рвота, диарея, развитие коматозного состояния. Вопрос 6. Механические примеси в воздушной среде производственных помещений аптек: характеристика, значение в микробной контаминации воздуха. Ответ: Гигиеническую оценку чистоты воздуха помещений производят на основании определения общего количества микроорганизмов, содержащихся в 1 м3 воздуха. Кроме того, оценку воздуха можно дать по содержанию санитарно-показательных микроорганизмов (гемолитических стрептококков и стафилококков) - обычных обитателей слизистых оболочек дыхательных путей. К рекомендуемым нормативам чистоты воздуха помещений относят окисляемость воздуха. Воздух считается чистым, если окисляемость его не превышает 6 мг/м3, умеренно загрязненным - до 10 мг/м3, загрязненным — более 12 мг/м3. Загрязненность воздуха микроорганизмами, особенно в помещениях аптек, имеет большое значение не только с точки зрения возможности инфицирования персонала возбудителями различных инфекционных болезней, но и опасности попадания микроорганизмов в лекарства. Одним из главных источников бактериального загрязнения аптечного инвентаря, оборудования, лекарств является воздушная среда, содержащая бактериальные аэрозоли, выделяемые посетителями и работниками аптек. Через воздух могут распространяться такие патогенные микроорганизмы, как стафилококки, стрептококки, пневмококки, менингококки, возбудители туберкулеза, дифтерии, сибирской язвы, туляремии, чумы, вирусы гриппа, оспы, кори, эпидемического паротита, ветряной оспы. Попавшая в лекарства микрофлора приводит к изменению их физико-химических свойств, снижению терапевтической активности, уменьшению сроков хранения, а также может явиться причиной развития заболеваний и осложнений у больного. Основными причинами высокого бактериального загрязнения воздуха непатогенными микроорганизмами, а также распространения аэрогенных инфекций в аптеках являются нарушение санитарно-гигиенического режима (плохая уборка помещений, недостаточная дезинфекция воздуха, предметов и оборудования, несоблюдение мер личной гигиены), неудовлетворительная планировка помещений, низкая эффективность работы вентиляционной системы. Наиболее интенсивное бактериальное загрязнение воздуха наблюдается в торговом зале, моечной и вспомогательных помещениях. В связи с этим провизоры должны знать возможные пути бактериального загрязнения лекарств и уметь организовать мероприятия по оздоровлению воздушной среды. С целью предупреждения микробного загрязнения воздуха в аптеках проводят комплекс мероприятий по обеспечению правильной планировки основных и вспомогательных помещений, организации эффективной приточно-вытяжной вентиляции, ультрафиолетового облучения воздуха, регулярной уборке помещений с применением дезинфицирующих средств, соблюдению мер личной гигиены. Одним из лучших и весьма распространенных в настоящее время способов обеззараживания различных предметов и воздуха является облучение УФ-лучами. Известно, что наиболее выраженным бактерицидным действием обладают УФ-лучи с длиной волны 254—257 нм, источником таковых являются бактерицидные увиолевые лампы (БУВ). В настоящее время выпускается три типа бактерицидных ламп: мощностью 15 и ЗО Вт-БУВ-15, БУВ-30 и БУВ-30П. В аптеках используется настенный бактерицидный облучатель (НБО), который имеет две лампы БУВ-30П, одна из них экранирована и служит для облучения верхней зоны в присутствии персонала, другая открыта и направляет свой лучистый поток вниз (включается в момент отсутствия людей в помещении). В потолочном бактерицидном облучателе (ПБО) размещены две экранированные лампы БУВ-15 и две открытые лампы БУВ-ЗОП. Облучатели в аптеках необходимо устанавливать в следующих помещениях: в асептическом блоке, ассистентской, моечной, торговом зале и дистилляционно-стерилизационной. Средняя удельная мощность устанавливаемых экранированных ламп должна быть на уровне 1 Вт на 1 м3, а для открытых - 3 Вт/м3. Эти мероприятия необходимо осуществлять для того, чтобы уберечь организм человека от неблагоприятных факторов. Вопрос 7. Обосновать необходимость обследования рук персонала аптек. Методика обследования, виды выявляемых микроорганизмов, их эпидемиологическое значение. Ответ: Производство стерильных растворов осуществляется в основном в аптеках и поэтому одним из возможных источников загрязнения стерильной продукции являются руки персонала. Необходимо подчеркнуть не только важность специальной обработки рук ассистента, как одного из условий профилактики пирогенности инфузионных растворов, но и необходимость поочередного использования дезинфицирующих средств через определенные промежутки времени. Однако ни в одной из проверенных аптек такая профилактика не проводится. Обычно, руки моют мылом и щеткой с последовательным ополаскиванием водой. Затем руки дезинфицируют (спирт или спиртовые растворы дезинфицирующих средств). Люди с заболеваниями кожи или дыхательных путей, а также с повышенной потливостью и сухостью кожи к работе в асептических условиях не допускаются. Руки персонала после дезинфекции должны быть стерильными. Сушка рук – не теплым воздухом, а путем вытирания бумажными салфетками. Микробиологический контроль лекарственных средств. Вопрос 8. Фазы роста и развития микробной популяции в лекарственном препарате; зависимость фаз от физико-химических параметров лекарственного препарата; влияние отдельных фаз на качество препарата. Ответ: Исходные субстанции и сырьё для приготовления нестерильных лекарственных препаратов могут быть контаминированы большим количеством микроорганизмов. Так, среди субстанций и препаратов высокую степень микробной загрязненности имеют: тальк, окись магния, папаверин, фенобарбитал (люминал), кофеин, порошки глюкозы, амидопирина. Таблица 1. Микробная обсемененность лекарственных препаратов, субстанций.
Кроме исходной контаминации субстанций и сырья, на микробиологическую чистоту лекарственного препарата влияют микроорганизмы, находящиеся на различном оборудовании, с помощью которого готовится препарат (весы, дозирующее устройство, устройство для закупорки флаконов). А также вспомогательные материалы и инструменты (фильтры, шпатели, прокладки), посуда, воздух производственных помещений, вода очищенная, одежда и руки персонала. В жидкой питательной среде (мясопептонный, сахарный бульон и пр.) рост микробной популяции подразделяют на несколько периодов или фаз, которые можно разделить на 4 и изобразить в виде графика : 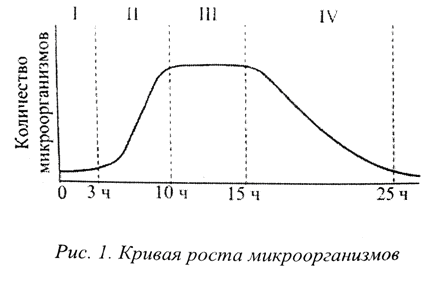 I ЛАГ-фаза – фаза адаптации микробов к новой среде. Размножения не происходит, происходи рост микробных клеток (увеличение размеров, накопления белка, удвоение ДНК, клеточных органелл); часть микробов может погибнуть, не приспособившись к новым условиям; II ЛОГ-фаза – фаза логарифмического роста. Происходит бурное размножение микробов в среде за короткий промежуток времени (через 1,5-3 часа от начала инкубации), количество клеток увеличивается в геометрической прогрессии. Микроорганизмы физиологически наиболее активны, выделяют в среду большое количество продуктов метаболизма. Гибели микробов в эту фазу практически не происходит. III Стационарная фаза – кривая размножения переходит в линию, параллельную нижней оси, т.е. количество жизнеспособных клеток, остается постоянным (устанавливается равновесие между вновь появляющимися клетками и гибнущими). Процессы метаболизма идут активно; постепенно снижается концентрация субстрата, среда насыщается продуктами обмена и распада клеток. IV Фаза гибели микробов – в среде практически не остается кислорода источников питания; высокая концентрация продуктов обмена и распада клеток. Микробные клетки гибнут. Эта кривая (скорость размножения и количество микроорганизмов) может видоизменяться в зависимости от вязкости, плотности субстрата, количества в нем воды, консервантов, температурного режима. Любой лекарственный препарат может служить питательной средой для микроорганизмов. И микробная популяция проходит все фазы своего развития, выраженность которых будет зависеть от указанных выше факторов. Указанные стадии характеризуют то или иное состояние системы «микроорганизм – лекарственный препарат» и, тем самым, определяет качество препарата. Размножение микробов в лекарственном препарате приводят к следующим результатам:
Процессы, происходящие в системе «микроорганизм – лекарственный препарат» могут быть видимыми и невидимыми. Если система «микроорганизм – лекарственный препарат» находится в III или IV стадии, то в зависимости от состава ингредиентов и попавшей в неё микрофлоры могут наблюдаться изменения вкуса, цвета или запаха, выделение газов, появление осадка, хлопьев, плесени или изменение консистенции. В этом случае выбраковка лекарственного средства не представляет затруднений и производится по органолептическим свойствам. Наиболее часто подобные изменения отмечается в водных настоях, отварах. При добавлении консервантов этот процесс может удлиниться во времени в несколько раз. Если происходит микробная контаминация вязких субстанций и лекарственных форм (мазей, мазевых основ), то микробная диффузия затрудняется, и формируются локальные (гнёздные) очаги: изменение цвета, консистенции, появление плесени. Сложнее обстоит дело с выбраковкой лекарственного средства, находящегося на I-II стадиях развития находящихся в нём микробов, так как они не успевают за короткое время значительно изменить органолептические характеристики препарата. Все процессы, происходящие в I-IV стадиях развития микроорганизмов в субстрате могут ускоряться на фоне нарушения санитарных нормативов, микроклимата помещений (температура, влажность, содержание пылевых частиц и т.д.). Например, повышение влажности и температуры воздуха способствуют отсыреванию порошков, таблеток с последующей активацией в них жизнедеятельности микроорганизмов; в мазевых основах при микрофлора может сохраняться длительное время Растворы в бюреточных установках (концентраты) почти всегда содержат значительное количество микроорганизмов (бациллы, клостридии, стафилококки, грибы, сарцины), что связано с нарушением правил санитарного режима и эксплуатации бюреточных установок. Для предотвращения микробной загрязнённости НЛС необходимо соблюдать:
Вопрос 9. Определение общего микробного числа (ОМЧ) бактерий и грибов в нестерильных лекарственных средствах: необходимость данного исследования, методики, трактовка результатов. Ответ: При исследовании лекарственных форм осуществляют:
Общее микробное число (ОМЧ) – количество микроорганизмов, содержащихся в 1 г (мл) препарата, определяют по числу выросших колоний. 1. Определение микробной обсемененности растительного лекарственного сырья В асептических условиях (в стерильной чашке Петри, обложенными ножницами и пинцетом) из листа или верхнего слоя корневища вырезают кусочек площадью 1 см2, который помещают в пробирку с 10 мл стерильного физиологического раствора и взбалтывают в течение 5 мин. Из полученного смыва готовят четыре десятикратных разведения (1:10, 1:100, 1:1000, 1:10000), для посева в связи с большой обсемененностью растительного сырья используют два последних (1: 1000 и 1: 10000) разведения. В стерильную чашку Петри вносят 1 мл смыва, после чего в нее наливают 15 мл расплавленного и остуженного до 450С МПА, перемешивают и после застывания агара посевы инкубируют при 370С 24 - 48 ч. Производят подсчет выросших колоний на поверхности и в глубине агара. Полученное число колоний следует умножить на степень разведения. 2. Бактериологическое исследование стерильных лекарственных средств. Инъекционные растворы, глазные капли, лекарственные средства для новорожденных, другие лекарственные препараты, стерилизуемые в процессе их изготовления, засевают неразведенными в тиогликолевую среду для определения микробной обсемененности и среду Сабуро для выявления дрожжевых и плесневых грибов. Посевы на тиогликолевой среде выдерживают 14 суток при 370С, на среде Сабуро 14 суток при 240С. Учет результатов посевов проводят по отсутствию видимых изменений в посевах. 3. Определение микробной обсемененности готовых лекарств. Жидкие лекарственные формы разводят стерильным физиологическим раствором 1:10 (или 1:100) и засевают в объеме 0,5 мл на МПА в чашке Петри. 1г порошка или таблеток помещают в пробирку с 10 мл физиологического раствора и после растворения производят посев на МПА. Мягкие лекарственные формы (мази, пасты) в количестве 1 г взвешивают в асептических условиях, переносят в пробирки с 10 мл стерильного 1,4% раствора натрия гидрокарбоната для диспергирования, которое производят вращательным движением пробирки между ладонями в течение 2-4 мин., 0,5 мл полученного раствора засевают на МПА в чашках Петри. Чашки с посевами помещают в термостат на 48 ч, затем подсчитывают число колоний и определяют количество бактерий в 1 мл или 1 г образца. 3. Определение общего количества грибов Определение общего количества грибов проводят на твердой среде Сабуро, на которую засевают 0,5 мл цельного или разведенного 1:10 препарата. Посевы инкубируют при 240С в течение 5 суток, затем подсчитывают число выросших колоний и определяют количество грибов в 1 мл (1 г) препарата. 4. Качественное определение условно - патогенных и патогенных микроорганизмов 1. Определение бактерий семейства Enterobacteriaceae (роды Escherichia, Salmonella, Shigella). Посев лекарственных средств производят на среду Эндо и висмут -сульфитный агар. Идентификацию энтеробактерий осуществляют следующим образом: если в образце обнаружены грамотрицательные неспоровые палочки, дающие отрицательную реакцию на цитохромоксидазу, ферментирующие глюкозу и восстанавливающие нитраты в нитриты, исследуемый препарат содержит бактерии семейства Enterobacteriaceae. 2. Определение патогенных стафилококков. Определение патогенных стафилококков производят посевом на желточно - солевой агар. На этой среде патогенные стафилококки вызывают расщепление лецитина, проявляющееся в образовании вокруг колоний зоны помутнения с радужным венчиком по периферии. Выделенную чистую культуру исследуют на наличие плазмокоагулазы. 3. Выявление Pseudomonas aeruginosa. Осуществляют на среде с глицерином. Синегнойная палочка на этой среде образует зеленоватые флуоресцирующие колонии, выделяющие в среду сине - зеленый пигмент. 4. Выявление протея. Производят посевом на МПА по Шукевичу. Наличие условно - патогенных и патогенных микроорганизмов в лекарственных препаратах недопустимо. В соответствии с требованиями Государственной фармакопеи XI издания приняты следующие критерии оценки микробной обсемененности лекарственных средств. Таблица Нормативы предельно допустимого содержания непатогенных микроорганизмов в лекарственных формах
Определение пирогенности Пирогенность (повышение температуры тела) обусловлена наличием в стерильных лекарственных препаратах продуктов распада бактерий (липополисахаридов). Стерильные инъекционные растворы должны быть апирогенны. Определение пирогенности проводят на здоровых кроликах обоего пола, не альбиносах, весом 2,5-3,0 кг, содержащихся на полноценном рационе. Испытуемую дистиллированную воду или лекарственные средства вводят трем кроликам в ушную вену в количествах и растворителях, предусмотренных соответствующими инструкциями. Воду для инъекций и раствор лекарственного средства считают непирогенными если сумма повышений температуры у 3 кроликов меньше или равна 1,40С. Если сумма превышает 2,20С, то испытуемые растворы считают пирогенными. В случаях, когда сумма повышений температуры у 3 кроликов находится в пределах от 1,5 до 2,20С, испытание проводят на 5 кроликах. В этом случае раствор считают непирогенным, если сумма повышений температуры у всех 8 кроликов не превышает 3,70С. Таблица Требования к микробиологической чистоте
*Интервал времени от начала изготовления раствора до стерилизации не должен превышать 3-х часов. Вопрос 10. Методика исследования на стерильность антибиотиков; необходимость проведения данного исследования. Ответ: Испытание предназначено для обнаружения загрязнения антибиотиков, предназначенных для парентерального введения или для других стерильных форм применения, живыми микроорганизмами. Условия испытания Испытание должно проводиться в асептических условиях в помещении, свободном от загрязнения в той мере, 'в какой этого возможно достичь с помощью дезинфицирующих агентов, бактерицидных ламп и воздушных фильтров. В процессе самого испытания бактерицидные лампы и дезинфицирующие аэрозоли применять не следует. Все манипуляции, предусмотренные испытанием, следует проводить в профильтрованном воздухе или под вытяжкой с ламинарным потоком; операторы должны ;быть одеты в стерильную антистатическую одежду, включающую колпак и бахилы. Давление воздуха в помещении, где проводится испытание, должно быть выше, чем во внешней среде. Работу вытяжки с ламинарным потоком следует контролировать при помощи счетчика частиц, фильтра или щелевого устройства для отбора проб воздуха; работу фильтров и бактерицидных ламп также следует постоянно проверять. Прибор для мембранной фильтрации Подходящий прибор состоит из закрытого резервуара и вместилища, разделенных тщательно укрепленной мембраной соответствующей степени пористости. Мембраны, обычно применяемые для испытания на стерильность, имеют номинальный размер пор 0,45 мкм, диаметр около 47 мм и обеспечивают скорость потока воды 55—75 мл в минуту при давлении 90 кПа (700 мм рт. ст). Желательно весь прибор до применения собрать и простерилизовать с укрепленной в нем мембраной. Если ожидается, 'что каждая мембрана будет загрязнена культурой, следует использовать установку, по меньшей мере, с 2 фильтрами. Весь воздух, входящий в фильтрующую установку, должен проходить через воздушный фильтр, удаляющий микроорганизмы. Взятие пробы Берут образец пробы таким образом, чтобы он был репрезентативным для испытуемого материала. Взятое количество должно быть достаточным для проведения испытаний и, в случае необходимости, повторения испытаний. При отборе пробы следует следить за тем, чтобы не нарушить стерильность материала. Культуральная среда Используемая для испытаний на стерильность грибов и бактерий культуральная среда должна поддерживать рост самых разнообразных микроорганизмов, аэробных и анаэробных; в том числе тех, которые обнаруживаются в производственных условиях. Для того чтобы удовлетворить этим критериям, обычно необходимо применять более чем одну культуральную среду. К средам, которые обычно дают удовлетворительные результаты, относятся жидкая меркаптоуксусная (тиогликолевая) среда (культуральная среда Кс4) и среда гидролизата соевой муки и казеина (культуральная среда Кс5). Однако можно применить любую другую среду, если подтверждена ее способность поддерживать рост микроорганизмов на том же уровне, что и указанные выше среды. Для проверки способности каждой культуральной среды поддерживать рост микроорганизмов необходимо использовать штаммы микроорганизмов с точно установленными питательными и аэробно-анаэробными потребностями в тест-культуре, содержащей лишь небольшое число организмов (менее 100). Среду следует инкубировать при той же температуре, при которой она будет использоваться в испытании на стерильность; наличие роста должно быть очевидным через 24 ч. Каждую партию обезвоженной среды, полученной от специализированной фирмы-изготовителя, или каждую партию среды, полностью приготовленной в лаборатории, следует проверять на способность поддерживать рост, так как не каждая партия оказывается способной поддерживать рост микроорганизмов в желаемой степени. Различия могут быть вызваны случайным присутствием в конкретной партии компонентов неудовлетворительного качества или разрушением некоторых компонентов при перегревании или чрезмерной стерилизации среды. Список литературы. 1. Воробьев А.А. Микробиология и иммунология. - М.: «Медицина», 2001г. 2. Методические рекомендации «фитопатогенная микрофлора. Микробиологические методы исследования лекарственного сырья и готовых лекарственных форм» для студентов фармацевтического факультета по предмету «микробиология». ОГМА, 2005 г. 3. Керашева С.И., Куклина С.В., Бутакова Л.Ю., Юрова В.А. Санитарная фармацевтическая микробиология. Учебно-методическое пособие для студентов I-II курсов фармацевтического факультета. – Барнаул : Изд-во ГОУ ВПО «АГМУ», 2010 г. |
