вариант 2. Контрольная работа 1 по дисциплине токсикологическая химия для студентов 4 курса фармацевтического факультета гбоу во оргму
 Скачать 287.07 Kb. Скачать 287.07 Kb.
|
|
7. Применение метода фотоколориметрии для количественного определения токсичных веществ. Краткая характеристика метода. Примеры использования. Фотометрический метод анализа основан на избирательном поглощении электромагнитного излучения анализируемым веществом и служит для иссле дования строения, идентификации и количественного определения светопоглощающих веществ. Фотометрические методы анализа подразделяются на визу альную колориметрию, фотоэлектроколориметрию, спектрофотометрию в видимой и ультрафиолетовой областях спектра. 1) Визуальная колориметрия основана на сравнении интенсивности окра сок растворов разных концентраций. Данный метод используется для количественного определения ртути по ок раске взвеси тетрайодомеркуроата меди, образующейся в деструктате при взаи модействии ртути с иодидом меди (I). Исследование проводят в колориметрических пробирках. Для определения берут 3 различных объема исследуемого раствора ртути. Одновременно с колориметрируемой пробой готовят стандартную шкалу. Для приготовления стан дартного раствора ртути используют дважды перекристаллизованный дихлорид ртути. Объемы исследуемых и стандартных растворов доводят до 6 мл 0,24 % раствором йода и во все пробирки одновременно прибавляют по 4 мл реактива, содержащего сульфат меди, сульфат натрия и гидрокарбонат натрия. Пробу и стандартную шкалу сравнивают через 10 мин. после их приготовления. Перед колориметрированием пробирки встряхивают. Количество ртути рассчитывают на 100 г органа, взятого на исследование. Граница определения — 0,01 мг. Зак лючение о количестве обнаруженной ртути дают по среднему значению трех оп ределений. Колориметрическое определение мышьяка основано на реакции Зангер-Блека. Используют 14 колбочек приборов Зангер-Блека. В первую колбочку по мещают минерализат, во вторую — серную кислоту, в двенадцать оставшихся — стандартный раствор мышьяковистого ангидрида в 4 М растворе серной кис лоты для приготовления колориметрической шкалы. Далее поступают, как ука зано при качественном обнаружении мышьяка данным методом. Через час сопоставляют окраску реактивной бумажки, полученной при ис следовании минерализата, с окраской стандартной шкалы. Граница определе ния — 0,04 мг. 2) Фотоэлектроколоримтрический метод основан, на способности анализи руемого вещества поглощать немонохроматический свет. Метод экстракцион ной фотоэлектроколориметрии используется для количественного определения ионов свинца, серебра, хрома, ртути, меди, таллия, сурьмы по цветным продук там взаимодействия с органическими комплексами (дитизон, диэтилдитиокарбаминат, малахитовый зеленый, дифенилкарбазид), которые экстрагируются в органический растворитель или реакциям окисления для марганца. Количественное определение свинца основано на измерении оптической плотности окрашенного в пурпурно-красный цвет раствора дитизоната свинца в хлороформе. Измерение оптической плотности проводят на фотоэлектроколориметре при длине волны520 нм в кювете с толщенной поглощающего слоя 10 мм и в ка честве раствора сравнения используют хлороформ. Расчет содержания свинца производят по калибровочному графику. Стандартный раствор для построения калибровочного графика готовят путем растворения соли свинца хлорида или свинца основного ацетата в воде очищенной, подкисленной раствором хлорис товодородной кислоты при кипячении. Метод позволяет определять свинец при содержании его в пределах 0,02—2 мг в 100 г объекта. Для количественного определения ртути используют дитизонат данного ме талла, который имеет золотисто-желтую окраску и экстрагируется хлороформом или четыреххлористым углеродом при рН = 1,0—2,0 (4—5 М раствора серной кислоты). Определению ртути по его дитизонату мешают ионы серебра, золота, платины и палладия, которые, однако, являются исключительно редкими объекта ми исследования в химико-токсикологическом анализе. Также мешать определе нию ртути могут продукты окисления дитизона (карбадиазон и др.), окрашенные в желтый цвет, сходный по окраске с дитизонатом ртути при небольшом содержа нии ртути (II). Они растворимы в четыреххлористом углероде и хлороформе. Максимум поглощения их (390—470 нм) лежит близко к дитизонату ртути (485 нм). Поэтому для определения ртути следует пользоваться свежеприготовленный ра створ дитизона. Раствором сравнения служит хлороформ или четыреххлористый углерод. Количество ртути определяют по калибровочному графику. Для постро ения графика готовят стандартные растворы ртути (II) в серной кислоте. Граница определения — 0,005 мг. Фотоколориметрическим методом, основанным на реакции образования однозамещенного дитизоната серебра, целесообразно проводить определение при небольших количествах осадка серебра хлорида. Измеряют оптическую плот ность раствора дитизоната серебра в хлороформе или четыреххлористом угле роде, при длине волны 462 нм в кювете с толщенной поглощающего слоя 10 мм. Раствором сравнения является органический растворитель. Определение количества серебра производят по калибровочному графику. Стандартный раствор для построения графика готовят из перекристаллизованного нитрата серебра. Граница определения — 1 мг серебра в 100 г объекта. Ион таллия может быть определен по дитизонату, полученному в условиях приведенных выше. Измеряют оптическую плотность при длине волны 505 нм, раствором сравнения является хлороформ. Расчет количественного содержания ведут по калибровочному графику, для построения которого используют стан дартный раствор таллия в серной кислоте. В основе количественного определения ионов марганца в минерализате лежит реакция окисления с калия периодатом, так как окраска получаемого перманганат аниона устойчива в течение длительного времени. В зависимости от интенсивности окраски полученного в результате реакции, раствора, его разбав ляют водой до 10 мл и измеряют оптическую плотность, при длине волны 525 нм в кюве те с толщиной поглощающего слоя 10 мм. Раствором сравнения служит опыт, в котором минерализат заменен 20 % раствором кислоты серной. Количество мар ганца определяют по калибровочному графику, который строят по стандартным растворам перманганата калия. Раствором сравнения служит вода. Граница оп ределения 0,1 мг марганца в 100 г объекта Хром количественно определяют по реакции с дифенилкарбазидом. Усло вия окисления хрома и проведения реакции описаны выше. Комплекс хрома с дифенилкарбазидом окрашивается полностью через 20—30 мин. Окраска со храняет устойчивость в течение 2—3 часов. При содержании хрома менее 0,5 мг в 100 г объекта (на границе чувствительности) окраска комплекса появляется в течение 5—10 мин и через 20—30 мин начинает желтеть. Оптическая плотность окрашенных растворов измеряется на фотоэлектроколориметре, при длине вол ны 546 нм и в кювете с толщенной поглощающего слоя 20 мм. Определение хрома проводят в минерализате и в осадке, в случае образования окрашенного в серо-зеленый цвет осадка сульфатов. Результаты определения суммируются. Для расчета количественного содержания хрома используют калибровочный график, построенный по стандартным растворам бихромата калия. Граница определе ния — 0,1 мг хрома в 100 г объекта. Количественное определение висмута проводится после экстракции в виде диэтилдитиокарбамата из минерализата и последующей реэкстрации в водный слой кислотой азотной. Данный метод используется при слабоположительных результатах качественных реакций на висмут. Определение проводятся по тиомочевинному комплексу висмута. Оптимальные условия развития окраски комплекса: 1 М раствор кислоты азотной и 6—12 % раствор тиомочевины. Из меряют оптическую плотность окрашенного в желтый цвет раствора при длине волны 470 нм в кювете с толщенной поглощающего слоя 10 мм, раствором срав нения является вода очищенная. Определение количества висмута производят по калибровочному графику. Для построения графика используют стандартный раствор висмута (III) в 2 М растворе кислоты азотной. Граница определения — 0,1 мг висмута в 100 г объекта. Окрашенный раствор диэтилдитиокарбамата меди в хлороформе использу ют для ее количественного определения. Измерение оптической плотности ок рашенного раствора проводят на фотоэлектроколориметре, при длине= 435 нм в кювете с толщенной поглощающего слоя 10 мм. Раствор сравнения — хлоро форм. Для расчета количественного содержания меди используют калибровоч ный график, построенный по стандартным растворам соли меди (II). Граница определения — 0,1 мг меди в 100 г объекта. Фотоэлектроколориметрическое определение по реакции с малахитовым (бриллиантовым) зеленым возможно производить как, при раздельном присут ствии сурьмы и таллия, так и при их совместном присутствии. В последнем слу чае таллий определяют дополнительно по дитизонату как описано выше и затем по разности вычисляют количество сурьмы. Окрашенные соединения сурьмы и таллия с органическими комплексами количественно экстрагируются толуолом. Измеряют оптическую плотность окрашенного в голубой цвет раствора, при длине волны 610 нм для сурьмы и 640 нм для таллия в кювете с толщенной по глощающего слоя 10 мм. Раствором сравнения является толуол. Определение количества сурьмы и таллия производят по калибровочному графику, который строят отдельно по стандартным растворам катионов в растворе кислоты сер ной. Граница определения — 0,1 мг. 3) Спектрофотометрия в видимой области спектра. Для предложенных со единений может быть записан спектр поглощения в видимой области, определе на оптическая плотность в максимуме поглощения и рассчитано содержание вещества в растворе по калибровочным графикам. 8. Перегонка органических веществ с водяным паром. Особенности. Дистилляция с водяным паром широко применяется как в лабораторной практике, так и в химической промышленности для получения веществ в чистом виде. В ХТА данным методом достигается изолирование ядовитых и сильнодействующих веществ из объектов исследования биологической природы. Особенно удобно изолировать дистилляцией с водяным паром вещества, труднорастворимые или практически нерастворимые в воде. При нагревании двухкомпонентной смеси, состоящей из практически нерастворимых друг в друге веществ, каждое из них увеличивает упругость своих паров независимо от другого. Когда упругость паров смеси достигает атмосферного давления (точнее, превышает его на бесконечно малую величину), смесь закипает и оба вещества начинают перегоняться. Так как сумма упругости паров обоих веществ равна атмосферному давлению, температура перегонки каждого вещества в смеси будет ниже температуры кипения каждого компонента в чистом виде (рис.1). Температура кипения чистой жидкостей и их смеси соответствует точкам пересечения изобары с кривыми давления пара. 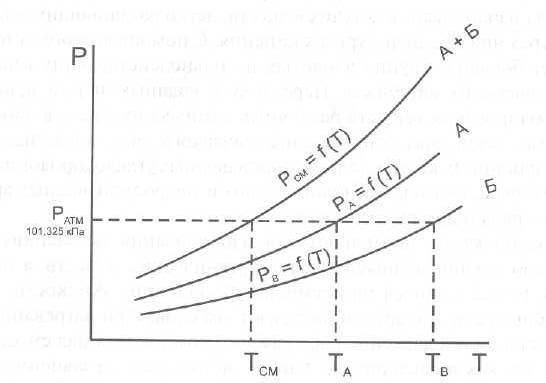 Рис.1. Диаграмма состояния (Р-Т) для двух несмешивающихся жидкостей (А и Б) и их смеси. Дистилляция с водяным паром особенно выгодна, когда изолируемое вещество кипит при очень высокой температуре или разлагается при температуре кипения. Связь между летучестью и молекулярным весом для веществ, нерастворимых друг в друге, выражается уравнением: 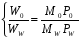 где W0 и WW – вес органического вещества и воды в дистилляте; М0 и МW – соответствующие молекулярные веса; Р0 и РW - упругости паров. В ряде случаев летучими с водяным паром оказываются вещества, растворимые в воде в том или ином соотношении. Для веществ, которые растворимы в воде, а вода оказывает влияние на упругость их паров, как, например, кислоты, фенолы, амины, также имеются свои закономерности. Более летучими с водяным паром являются вещества с большим молекулярным весом и более высокой температурой кипения, чем низшие члены гомологического ряда. Для многих органических веществ способность их перегоняться с водяным паром может быть объяснена образованием нераздельно кипящих (азеотропных) смесей их с водой. Азеотропная – смесь двух жидкостей, состав которой не изменяется при дистилляции. 9. Этиловый спирт. Изолирование, методы качественного и количественного определения. Этиловый спирт С2Н5ОН (этанол, этиловый алкоголь, винный спирт) — бесцветная, летучая жидкость с характерным запахом, жгучая на вкус (пл. 0,813—0,816, т. кип. 77—77,5 °С). Этиловый спирт горит синеватым пламенем, смешивается во всех соотношениях с водой, диэтиловым эфиром и многими другими органическими растворителями, перегоняется с водяным паром. Этиловый спирт получают путем брожения крахмалсодержащих продуктов (зерно, картофель), фруктов, сахара и т. д. Полученный брожением этиловый спирт отгоняют и получают спирт-сырец, который очищают путем ректификации. Сивушные масла относительно медленно метаболизируются в организме. Поэтому продолжительность действия их на организм большая, чем этилового спирта. Применениеэтилового спирта. Этиловый спирт широко используется в промышленности как растворитель и исходный продукт для получения многих химических соединений. Этот спирт используется в медицине как дезинфицирующее средство. В химических лабораториях он применяется как растворитель, входит в состав многих спиртных напитков. Действие наорганизмитоксичность.Этиловый спирт может поступать в организм несколькими путями: при приеме внутрь, при внутривенном введении, а также через легкие в виде паров с вдыхаемым воздухом. Поступивший в организм этиловый спирт действует на кору головного мозга. При этом наступает опьянение с характерным алкогольным «возбуждением». Это возбуждение не является результатом усиления возбудительного процесса, а возникает из-за ослабления процесса торможения. Таким образом, под влиянием алкоголя проявляется преобладание процессов возбуждения над процессами торможения. В больших дозах этиловый спирт вызывает угнетение функций как спинного, так и продолговатого мозга. При этом может наступить состояние длительного глубокого наркоза с потерей рефлексов и угнетением жизненно важных центров. Под влиянием этилового спирта может наступить смерть в результате паралича дыхательного центра. О токсичности этилового спирта свидетельствует наличие случаев острых отравлений этим спиртом. В последнее десятилетие острые отравления этиловым спиртом занимают первое место (около 60%) среди отравлений другими токсическими веществами. Алкоголь не только вызывает острые отравления, но и способствует скоропостижной смерти от других заболеваний (прежде всего, от заболеваний сердечно-сосудистой системы). Степень токсичности этилового спирта зависит от дозы, концентрации его в напитках, от наличия в них сивушных масел и других примесей, прибавляемых для придания напиткам определенного запаха и вкуса. Ориентировочно смертельной дозой для человека считается 6—8 мл чистого этилового спирта на 1 кг массы тела. В пересчете на всю массу тела это составляет 200—300 мл этилового спирта. Однако эта доза может изменяться в зависимости от чувствительности к этиловому спирту, условий его приема (крепость напитков, наполненность желудка пищей) и т. д. У одних лиц смерть может наступить после приема 100— 150 г чистого этилового спирта, в то время как у других лиц. смерть не наступает и после приема 600—800 г этого спирта. Реакция этерификации (образование этилацетата). 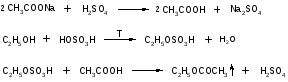 Чувствительность реакции 15-20 мг. Реакция окисления (образование ацетальдегида). 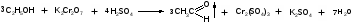 Чувствительность реакции 3 мг. Реакция образования йодоформа. 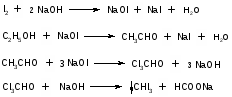 Реакция не специфична, ее дает ацетон. Чувствительность реакции 0,04 мг. 10. Женщина 56 лет, сотрудница завода по производству лаков, случайно разбила бутыль с хлороформом. Нарушилось дыхание и сердечный ритм. Смерть наступила в результате острой сердечно-сосудистой недостаточности. Привести схему химико-токсикологического анализа биологических объектов на содержание хлороформа. Хлороформ (трихлорметан) СНCl 3 — бесцветная прозрачная летучая жидкость с характерным запахом. Смешивается с диэтиловым эфиром, этиловым спиртом и другими органическими растворителями, слабо растворяется в воде (см. табл. 1). Под влиянием света, воздуха, влаги и температуры хлороформ постепенно разлагается. При этом могут образовываться фосген, муравьиная и соляная кислоты. Применение. Действие наорганизм. Хлороформ широко используется в химической промышленности и в химических лабораториях как растворитель. Раньше он применялся в медицине для наркоза. В настоящее время хлороформ в смеси с другими лекарственными препаратами используется для растирания. Пары хлороформа легко проникают в организм с вдыхаемым воздухом. Хлороформ действует на центральную нервную систему, вызывая наркоз. Он накапливается в тканях, богатых жирами. При больших количествах хлороформа, поступившего в организм, могут появляться дистрофические изменения во внутренних органах, особенно в печени. При отравлении хлороформом смерть наступает от остановки дыхания. Метаболизм. Хлороформ, поступивший в организм, быстро исчезает из крови. Через 15—20 мин с выдыхаемым воздухом в неизмененном виде выделяется 30—50 % хлороформа. В течение часа через легкие выделяется до 90 % хлороформа, поступившего в организм. Однако еще и через 8 ч в крови можно обнаружить незначительные количества хлороформа. Часть хлороформа подвергается биотрансформации. При этом в качестве метаболитов образуются оксид углерода (IV) и хлороводород. При химико-токсикологических исследованиях основными объектами анализа на наличие хлороформа в организме являются выдыхаемый воздух, богатые жирами ткани трупов и печень. Качественное определение хлороформа осуществляется с помощью ряда реакций.
Эта реакция является общей реакцией на галогенпроизводные. 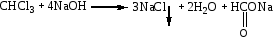 Отщепление галоида достигается нагреванием части дистиллята со спиртовым раствором едкой щелочи. Хлорид-ион обнаруживается реакцией с раствором нитрата серебра в азотнокислой среде. Образование мути или осадка говорит о наличии галогенпроизводных и необходимости проведения других реакций их обнаружения. Реакция не специфична. 2. Реакция образования изонитрила. В случае отсутствия осадка или мути в реакции №1, учитывая ее сравнительно невысокую чувствительность, нужно проделать реакцию получения изонитрила. CHCl3+3NaOH(спирт. р-р)+C6H5NH2 = C6H5N=C+3NaCl+3H2O Отрицательный результат этой сравнительно чувствительной реакции (0,01 мг) позволяет судить о ненахождении в исследуемом объекте этих веществ. При положительном результате проводят другие реакции. Реакция не специфична, ее дают все хлорпроизводные, за исключением дихлорэтана. 3. Реакция с резорцином в щелочной среде.  Появление розового или красного окрашивания в исследуемой пробе может указывать на наличие хлороформа. Параллельно выполняется «слепой» опыт, цель которого исключить ошибки за счет продуктов окисления резорцина, окрашенных в зеленый цвет и маскирующих розовое окрашивание. Реакция не специфична, ее дают все хлорпроизводные, кроме дихлорэтана, а также формальдегид. 4. Реакция с реактивом Фелинга. При значительных количествах хлороформа проводят реакцию восстановления Cu(OH)2 в Cu2(OH)2, переходящую далее в Cu2O при кипячении с реактивом Фелинга. При наличии хлороформа образуется желтый осадок гидрата закиси меди, переходящий в красный осадок закиси меди. 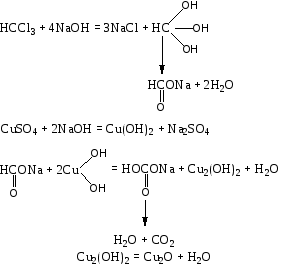 Реакция не специфична, ее дает хлороформ, хлоралгидрат и формальдегид. Не дают четыреххлористый углерод и дихлорэтан. 5. Реакция Фудживара. Реакция взаимодействия с пиридином в присутствии щелочи. На этой реакции основано предварительное обнаружение галогенпроизводных в моче. 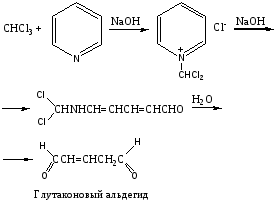 О наличии хлороформа судят по появлению красной окраски. Реакция не специфична, ее дают все хлорпроизводные. |
