вариант 2. Контрольная работа 1 по дисциплине токсикологическая химия для студентов 4 курса фармацевтического факультета гбоу во оргму
 Скачать 287.07 Kb. Скачать 287.07 Kb.
|
|
3. Правила производства судебно-химического анализа. Цель и объекты судебно-химической экспертизы (исследований): СХЭ (исследование) производят с целью выделения, идентификации и количественного определения или исключения ядовитых, наркотических и сильнодействующих веществ, продуктов их превращения, главным образом, в органах и биологических жидкостях организма человека, а также в фармацевтических препаратах, пищевых продуктах, напитках, окружающей человека среде и предметах. Важной частью является интерпретация полученных результатов СХА. Задачи судебно-химической экспертизы:
Основания для производства судебно-химической экспертизы (исследования):
Вместе с вещественными доказательствами направляют документы:
Обязанности и права лиц, допущенных к производству судебно-химической экспертизы:
4. Группа веществ, изолируемых из биоматериала минерализацией. “Металлические яды”, подлежащие ХТА. Общая характеристика группы. Группа веществ, изолируемых минерализацией, включает в себя так называемые «металлические яды» Важнейшими в токсикологическом отношении «металлическими ядами» являются соединения Ва, Bi, Cd, Mn, Cu, Hg, Pb, Ag, Tl, Cr, Zn, которые, попадая в организм человека, вызывают отравления. Правилами судебно-химического исследования при проведении ненаправленного анализа предусмотрено обязательное исследование на указанные элементы. Как известно, практически все металлы естественным образом содержатся в человеческом организме. Содержание элементов в норме в органах человека сильно варьируется: например, содержание мышьяка в 100 г печени равно 0,01 мг, а содержание цинка может достигать 14,5 мг. Поэтому при судебно-медицинской оценке результатов судебно-химического исследования на «металлические яды» особое значение придается их количественному определению. Ввиду незначительных количеств этих элементов их называют микроэлементами. Они играют важную роль в физиологических процессах в организмах людей и животных. Так, например, кобальт входит в состав витамина BI2 и некоторых ферментов, медь участвует в синтезе гемоглобина; медь, кадмий, цинк входят в состав около 60 ферментов. Содержание микроэлементов в организме можно прокомментировать следующими данными: магний обнаруживается в организме в количестве 0,04%, медь – 0,005%, марганец – 0,02%, молибден, цинк – в следовых количествах. В литературе не приведены данные о наличии и роли в организме соединений бария, висмута, сурьмы и таллия. Не всегда возможно установить различие между жизненно необходимыми и токсичными металлами. Все металлы могут проявить токсичность, если они потребляются в избыточном количестве. Несмотря на важную положительную роль, которую играют микроэлементы в жизнедеятельности человека, например медь или цинк, при избыточном поступлении их с пищей или какими-либо другими путями может наступить тяжелая интоксикация, признаками которой являет тошнота, рвота, диарея, боли в животе. Кроме того, токсичность металлов проявляется в их взаимодействии друг с другом. Например, физиологическое воздействие кадмия на организм, в том числе его токсичность, зависят от количества присутствующего цинка, селена, а функции железа в клетках определяются присутствием меди, кобальта и в некоторой степени молибдена и цинка. Негативное действие «металлических ядов» на организм человека проявляется в их выраженном нейротоксическом действии. Токсичность объясняется тем, что в организме они связываются с функциональными группами белков, аминокислот, пептидов и других жизненно важных веществ, в результате чего нарушаются нормальные функции клеток тканей. Образующиеся в организме комплексы металлов очень прочные, поэтому изолировать металлы и обнаружить их невозможно без предварительного разрушения органического вещества, с которым они связаны. Для этих целей и применяются методы минерализации. По вопросу металлических загрязнений существует несколько точек зрения. Согласно одной из них металлы периодической системы делят на 3 группы: – металлы как незаменимые факторы питания (эссенциальные макро- и микроэлементы); – неэссенциальные или необязательные для жизнедеятельности металлы; – токсические металлы. Согласно другой точке зрения все металлы необходимы для жизнедеятельности, но в определенных количествах. Эта точка зрения выражается формулой: «Все вещества токсичны, но отсутствие веществ также вредно». По воздействию на организм человека металлы классифицируют следующим образом: 1) металлы, необходимые при питании человека и животных (Со, Сu, Cr, Ge, Fe, Mn, Mo, Ni, Se, Si, V, Zn). 2) металлы, имеющие токсикологическое значение (As, Be, Cd, Cu, Co, Cr, Hg, Mo, Ni, Pb, Pd, Se, Sn, Ti, V, Zn). При этом следует отметить, что 10 из перечисленных элементов отнесено к обеим группам. Биологически эссенциальные металлы имеют пределы доз, определяющих их дефицит, оптимальный уровень и уровень токсического действия. Токсические металлы в низких дозах не оказывают вредного действия и не несут биологических функций, однако в высоких дозах оказывают токсическое действие. Тем не менее, существуют металлы, которые проявляют сильно выраженные токсикологические свойства при самых низких концентрациях и не выполняют какой-либо полезной функции. К таким токсичным элементам относят ртуть, кадмий, свинец, мышьяк. Они не являются ни жизненно необходимыми, ни благотворными, но даже в малых дозах приводят к нарушению нормальных метаболических функций организма. Ртуть, кадмий, свинец, мышьяк, медь, стронций, цинк, железо Объединенная комиссия ФАО/ВОЗ по пищевому кодексу (Codex Alimentarius) включила в число компонентов, содержание которых контролируется при международной торговле продуктов питания. В России и СНГ подлежат контролю еще 6 элементов (сурьма, никель, хром, алюминий, фтор, йод), а при наличии показаний могут контролироваться и некоторые другие металлы. Медико-биологическими требованиями СанПиН 1078-01 определены критерии безопасности для следующих металлов: свинец, кадмий, ртуть, медь, цинк, олово, железо. Несмотря на широкое распространение d-элементов в природе (в рудах, почве, воде и воздухе), их суммарное содержание в тканях и органах человека в норме не превышает 1-2 % массы тела. С точки зрения токсического воздействия металлов на организм наибольшую опасность представляет постоянно возрастающее антропогенное загрязнение окружающей среды, включая биоту. Элементы с неизвестной биологической ролью, но постоянно присутствующие в организме, называются примесными. Уровень примесных элементов может колебаться в пределах нескольких порядков. Для этих элементов, как правило, достоверно установлена токсичность. Деление элементов на необходимые и примесные в определенной мере условно. Это объясняется, прежде всего, тем, что неорганические соединения различных элементов имеют широкий спектр биологической активности. И дефицит, и избыток жизненно необходимого элемента наносят вред организму. При дефиците необходимого элемента организму наносится существенный ущерб, например, из-за неактивности ферментов. Оценка нормы содержания элементов, необходимость которых пока не доказана, возможна при определении примесных элементов в организме сельских жителей, меньше подвергающихся антропогенным влияниям окружающей среды. Полученные результаты используют как нормативные и сравнивают с ними токсическую нагрузку на организм в промышленных регионах. Например, были обнаружены близкие уровни свинца, бария, кадмия, стронция, мышьяка в костной ткани (эпифиз бедренной кости) жителей разного возраста и обоего пола, проживающих в одном из регионов Подмосковья. У жителей промышленных регионов с возрастом увеличивается содержание некоторых примесных элементов, особенно у рабочих крупных металлургических и гальванических предприятий. Например, содержание кадмия, бария, свинца и стронция в образцах костной ткани более чем у 3000 человек, проживавших в разных районах Российской Федерации, различалось в сотни раз. Наименьшие колебания и самый низкий уровень этих элементов отмечены у жителей сельской местности. Накопление металлов в организме может быть вызвано природными факторами (эндемические провинции) или техногенными загрязнениями. Исследование на «металлические яды» При попадании в организм человека или животного высоких доз соединений металлов, а также мышьяка и сурьмы, происходит их связывание со многими биологически активными веществами организма, что приводит к нарушению протекания биохимических и физиологических процессов. В ряде случаев это заканчивается не только тяжёлыми отравлениями, но и смертью пострадавшего. Как уже отмечалось выше, в организме «металлические яды» образуют с белками, пептидами, аминокислотами и некоторыми другими веществами очень прочные комплексы. Чтобы обнаружить металлы, необходимо: 1. Разрушить органические вещества, содержащиеся в исследуемых объектах, 2. Перевести «металлические яды» в ионное состояние. Для этой цели используется окисление (сжигание) органического вещества, составляющего объект исследования, которое приводит к освобождению искомых неорганических веществ. Вероятно, поэтому процесс окисления называется минерализацией. Объектами исследования на «металлические яды» являются органы и ткани организма человека, чаще всего это печень, почки, желудок и др. Количество исследуемого материала зависит от общей массы объекта, от обстоятельств дела и других факторов. В среднем навеска биоматериала составляет 100 г. Минерализацию разнохарактерных объектов проводят отдельно, не смешивая их. Это необходимо для получения объективных результатов анализа и правильной судебно-медицинской оценки. Методы минерализации Минерализация – это окисление (сжигание) органического вещества (объекта) для освобождения металлов из комплексов с белками и другими соединениями. Наиболее широко распространенные методы минерализации можно разделить на 2 большие группы: 1. Частные методы (методы сухого озоления) – минерализация путем простого сжигания или сплавления со смесью нитратов и карбонатов щелочных металлов. К числу частных методов относится и метод частичной минерализации (деструкция), служащий для изолирования ртути из биологических объектов. Метод простого сжигания основан на нагревании органического вещества (объекта) при высокой температуре при доступе воздуха. Сухое озоление проводят в фарфоровых, платиновых или кварцевых тиглях. На исследование берут небольшие навески (1-3 г), температура нагревания достигает 300-400°С. Метод применяется при специальных заданиях по обнаружению катионов марганца, меди, цинка, висмута, особенно в тех случаях, когда объект либо очень эластичен, трудноразрушаем, либо его количество ограничено. Метод имеет определенные недостатки: – при нагревании возможно улетучивание металлов в виде солей или в индивидуальном виде, т.к. при нагревании в условиях проведения сухого озоления не всегда удается контролировать температуру. Даже при относительно невысокой температуре улетучиваются соединения ртути и таллия, а при температуре свыше 400°С – хлориды кадмия, свинца, серебра, цинка, марганца, мышьяка. – возможно взаимодействие некоторых металлов с материалом тигля, например, цинк, свинец, серебро могут реагировать с кварцем и фарфором, а кобальт может сплавляться с платиной. Метод сплавления с нитратами щелочных металлов в химико-токсикологическом анализе применяется чаще, чем классическое сухое озоление. Биологический материал нагревают с расплавленными нитратами щелочных металлов. С чистыми нитратами окисление идет очень быстро, особенно при повышенных температурах, при этом может наблюдаться выбрасывание пробы из тигля. Поэтому для предотвращения бурного протекания реакции при сплавлении применяют смесь нитратов с карбонатами щелочных металлов. 2. Общие методы (методы мокрой минерализации) применяются при общем (ненаправленном) исследовании на группу металлических ядов, пригодны для изолирования всех катионов металлов, кроме ртути. Для минерализации используют смеси кислот-окислителей (серной и азотной, серной, азотной и хлорной), а также калия хлорат и пергидроль. Под действием окислителей происходит разрушение биологического материала с образованием более простых химических соединений. При этом связи между металлами и биологическими субстратами организма (белками, аминокислотами и др.) разрушаются, образуются соли этих металлов, которые можно обнаружить в минерализате при помощи соответствующих реакций и методов. Методы мокрой минерализации Первый метод минерализации биологического материала при химико-токсикологических исследованиях с использованием в качестве окислителя концентрированной азотной кислоты предложил русский ученый А.П. Нелюбин. Этот метод сыграл большую роль в развитии химико-токсикологического анализа. Однако разрушение биологического материала при нагревании с концентрированной HNO3 требует большой затраты времени, реагент слабо окисляет жиры. В дальнейшем в качестве окислителя использовалась концентрированная серная кислота, действующая одновременно и как дегидратирующий агент. Однако этот процесс тоже был весьма продолжительным по времени, и в ходе минерализации образовывались неразлагающиеся обуглившиеся остатки. Для устранения этих недостатков в 1821 г. М.Ж. Орфила предложил применять смесь концентрированных серной и азотной кислот. Этот метод был модифицирован и применен для целей химико-токсикологического анализа в 1908 г. П.К. Равданикисом. До настоящего времени этот метод находит широкое применение на практике и является по сути основным методом минерализации. При любом способе минерализации следует соблюдать меры предосторожности, т.к. возможны термические ожоги, выбрасывание горячих кислот из колб и даже взрывы (особенно при использовании в качестве окислителей пергидроля, хлорной кислоты и хлората калия). Поэтому следует пользоваться защитными очками, работать в вытяжных шкафах с хорошей тягой. 5. Соединения висмута. Токсикологическое значение. Изолирование. Методы качественного и количественного анализа минерализата. Применениеи токсичность соединений висмута. Отравление висмутом может наступить после приема его соединений внутрь и при вдыхании пыли, содержащей этот металл. Соединения висмута применяются для получения сплавов, имеющих низкую температуру плавления, светящихся составов, хрустального стекла и т. д. При изготовлении указанных предметов пыль, содержащая соединения висмута, может поступать в организм и вызывать отравление. Некоторые соединения висмута применяются в медицине (основной нитрат висмута, салицилат висмута и др.). Они применяются для приготовления мазей, косметических средств и т. д. Висмут входит в состав некоторых препаратов, применяемых в медицине для лечения сифилиса и ряда других заболеваний. Некоторые соединения висмута применяются в химических лабораториях в качестве реактивов. Ионы висмута, всосавшиеся в кровь, долгое время задерживаются в организме (в печени, почках, селезенке, легких и ткани мозга). Висмут выводится из организма через почки, кишки, потовые железы и др. В результате накопления висмута в почках возможно их поражение. При выделении висмута из организма потовыми железами может быть зуд кожи и появление дерматозов. Данные о наличии висмута как нормальной составной части клеток и тканей организма в литературе не приводятся. Исследование минерализатов на наличие висмута Для обнаружения висмута в минерализатах вначале выполняют предварительные реакции на ионы этого металла с тиомочевиной и оксином (8-оксихинолином). При положительном результате этих реакций висмут выделяют из минерализата в виде диэтилдитиокарбамата, который экстрагируют хлороформом. После прибавления кислоты к хлороформной вытяжке происходит разложение диэтилдитиокарбамата висмута. Образовавшиеся при этом ионы висмута переходят в водную фазу, которую используют для обнаружения указанных ионов при помощи соответствующих реакций. Реакция с тиомочевиной. При взаимодействии ионов висмута с тиомочевиной могут образовываться различного состава тиомочевинные комплексы, имеющие лимонно-желтую окраску: 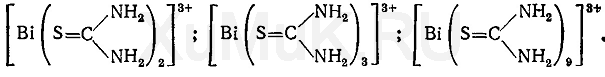 Реакции образования тиомочевинных комплексов висмута мешают окислители. Выполнение реакции. В пробирку вносят 5 мл минерализата и прибавляют 3—5 мл насыщенного водного раствора тиомочевины. При наличии ионов висмута раствор приобретает лимонно-желтую окраску. Предел обнаружения: 0,4 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала. Реакция с оксином основана на переведении ионов висмута в ацидокомплекс [ВiI 4 ] -, который при взаимодействии с оксином в кислой среде образует оранжево-красный осадок, представляющий собой ионный ассоциат (иодвисмутат оксина). Образование этого ионного ассоциата можно представить следующими уравнениями: 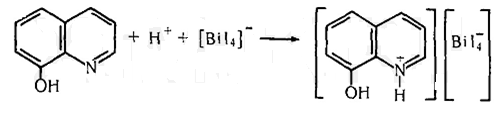 Этой реакции мешают окислители, которые выделяют иод из иодида калия, применяемого для получения ацидокомплекса [BiI 4 ] -. Кроме этого, реакции образования иодвисмутата оксина мешают катионы ряда металлов, которые дают осадки с оксином. Для маскировки мешающих ионов к смеси реагирующих веществ добавляют аскорбиновую кислоту, которая восстанавливает ионы железа (III), и сегнетовую соль, связывающую другие ионы, мешающие обнаружению висмута. Выполнение реакции. В пробирку вносят 10 мл минерализата, прибавляют по 0,5 г аскорбиновой кислоты, сегнетовой соли и иодида калия. При этом появляется интенсивно-желтая окраска (образуется иодвисмутат), которая не должна переходить в синюю от прибавления капли раствора крахмала. При появлении синей окраски к смеси реагирующих веществ по каплям прибавляют 10 %-й раствор тиосульфата натрия до исчезновения этой окраски. После этого по стенкам пробирки к смеси, имеющей желтую окраску, осторожно прибавляют 1—2 мл 2 %-го раствора оксина в 2 н. соляной кислоте. На границе соприкосновения раствора оксина и находящейся в пробирке жидкости через 1— 2 мин появляется оранжево-желтый осадок иодвисмутата оксина. Если в исследуемой пробе содержится незначительное количество ионов висмута, то указанный осадок может появиться только через 30—60 мин. Поэтому, не дожидаясь образования осадка, содержимое пробирки переносят в делительную воронку, в которую прибавляют 3 мл смеси равных объемов ацетона и амилацетата, а затем взбалтывают. При наличии ионов висмута в минерализате слой органических растворителей (ацетон— амилацетат) приобретает оранжево-розовую окраску. Предел обнаружения: 5 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала. Описанные выше реакции на висмут с тиомочевиной и оксином являются предварительными. Отрицательный результат этих реакций указывает на отсутствие ионов висмута в минерализате. При положительном результате указанных выше реакций производят дальнейшее исследование минерализата на наличие ионов висмута. С этой целью ионы висмута выделяют из минерализата в виде комплекса с диэтилдитиокарбаминатом натрия. Этот комплекс экстрагируют хлороформом, а затем разлагают кислотой. Выделение ионов висмута из минерализата. К минерализату прибавляют раствор диэтилдитиокарбамата натрия. При этом ионы висмута с этим реактивом образуют внутрикомплексное соединение: 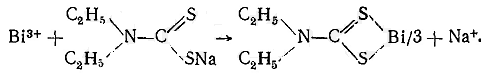 Кроме ионов висмута с диэтилдитиокарбаматом натрия дают внутрикомплексные соединения и некоторые другие ионы, которые могут содержаться в минерализате. Для маскировки этих ионов прибавляют растворкомплексона III (трилона Б). Образовавшийся комплекс диэтилдитиокарбамата висмута экстрагируют хлороформом, а затем разлагают азотной кислотой. В делительную воронку вносят 10 мл минерализата, 0,1 г комплексона III и несколько капель 0,1 %-го спиртового раствора нильского голубого (см. Приложение 1, реактив 24), являющегося индикатором. К этой смеси прибавляют 3 н. раствор гидроксида натрия до рН=12 (до перехода синей окраски индикатора в розовую). После доведения содержимого делительной воронки до необходимого рН к жидкости еще прибавляют 2—3 мл 3 н. раствора гидроксида натрия, а затем в делительную воронку вносят 3 мл 1 %-го раствора диэтилдитиокарбамата натрия (в смеси равных объемов этилового спирта и воды) и 5 мл хлороформа. Содержимое делительной воронки взбалтывают в течение 0,5 мин, а затем хлороформный слой отделяют в другую делительную воронку. Для промывания хлороформного слоя к нему прибавляют 5 мл 0,3 н. раствора гидроксида натрия и взбалтывают. После взбалтывания хлороформного слоя с растворомщелочи отделяют водную фазу. Хлороформный слой, содержащий диэтилдитиокарбамат висмута, переносят в делительную воронку, прибавляют 3 мл 4 н. раствора азотной кислоты. Содержимое делительной воронки взбалтывают в течение 1 мин и отделяют хлороформный слой, который в дальнейшем не исследуют. Водную фазу подвергают исследованию на наличие ионов висмута при помощи реакций с бруцином, хлоридом цезия и тиомочевиной. Реакция с бруцином и бромидом калия. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят каплю 2 н. раствора азотной кислоты, а затем прибавляют каплю насыщенного раствора бруцина в 1 н. серной кислоте и каплю 5%-го раствора бромида калия. При наличии ионов висмута сразу же или через несколько минут образуются желто-зеленые кристаллы, собранные в виде сфероидов. Реакция с хлоридом цезия и иодидом калия. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят 1—2 капли 3 н. раствора соляной кислоты. Затем с одной стороны жидкости на предметном стекле помещают кристаллик хлорида цезия CsCl, а с другой — кристаллик иодида калия. Нанесенные кристаллики реактивов с помощью тонкой стеклянной палочки соединяют с жидкостью. При наличии ионов висмута в растворе образуются оранжево-красные кристаллы Cs[BiI 4 ], имеющие форму шестиугольников или шестилучевых звездочек. Предел обнаружения: 0,1 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала. Реакция с тиомочевиной. В пробирку вносят 0,5 мл водной фазы, к которой прибавляют 0,5 мл насыщенного раствора тиомочевины. В присутствии ионов висмута появляется лимонно-желтая окраска. |
