Хомич В.А. - Основы химической термодинамики (2009) (1). Контрольные вопросы для самопроверки знаний по разделу дисциплины физической химии Химическая термодинамика
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
Министерство образования и науки РФСибирская государственная автомобильно-дорожная академия (СибАДИ) Кафедра «Инженерная экология и химия» Хомич В.А. ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИОмск Издательство СибАДИ 2009 УДК 541.1ББК 24.5Х 76 Рецензент Л.Н.Котова, канд. хим. наук, доц. ОГПУ. Работа одобрена методической комиссией факультета АДМ в качестве курса лекций по физической химии для студентов 2 курса специальности 280202 «Инженерная защита окружающей среды». Хомич В.А. Основы химическая термодинамика: Курс лекций для студентов специальности 280202. – Омск, 2009. – 40 с. Курс лекций включает основные вопросы химической термодинамики: первый и второй законы термодинамики, термохимия, термодинамика агрегатных превращений, термодинамические потенциалы. Изложение теоретического материала сопровождается примерами решения практических задач. Приводятся контрольные вопросы для самопроверки знаний по разделу дисциплины физической химии «Химическая термодинамика». Табл. 3. Библиогр.: 2 назв.  Ó Издательство СибАДИ, 2009 Л е к ц и я 1 ВВЕДЕНИЕ План лекции: Определение дисциплины. Основные понятия и определения химической термодинамики: система; закрытая, открытая и изолированная системы; термодинамические параметры состояние системы; интенсивные и экстенсивные параметры; термодинамический процесс; круговой (циклический) процесс; обратимый и необратимый процесс; функция состояния системы; равновесное и неравновесное состояния системы. Термодинамика изучает законы взаимных превращений различных видов энергии, связанных с переходами энергии между телами в форме теплоты и работы. Обычно она изучает только макроскопические системы. Химическая термодинамика изучает изменение энергии в результате процессов в системе, приводящих к изменению её состава и физико-химических свойств. Химическая термодинамика - это общенаучная дисциплина, которая представляет важнейший раздел физической химии. Химическая термодинамика - базовая дисциплина для студентов химико-технологических специальностей. Она дает знания, необходимые для глубокого изучения общенаучных дисциплин (физической, аналитической и коллоидной химии), а также специальных дисциплин. Объектами изучения химической термодинамики являются тепловые балансы физико-химических процессов, фазовые и химические равновесия. В результате изучения химической термодинамики студент должен знать: первый закон термодинамики; взаимосвязь теплоты, работы и изменения внутренней энергии в различных термодинамических процессах; законы Гесса и Кирхгофа, их применение для расчетов тепловых эффектов; второй закон термодинамики, его статистический характер; применение энтропии и термодинамических потенциалов как критериев равновесия и направления самопроизвольных процессов. Изучив химическую термодинамику, студент должен уметь: грамотно применять представления, законы и методы химической термодинамики для изучения закономерностей протекания и равновесия химических и физико-химических процессов; самостоятельно выполнять физико-химические расчеты; применять знания химической термодинамики при решении инженерных и технологических задач в процессе последующего обучения и в своей будущей профессиональной деятельности инженера химика-технолога. Рассмотрим основные понятия и определения химической термодинамики. Термодинамическая система – это любой изучаемый макроскопический материальный объект, отделённый от внешней (окружающей) среды реальной или воображаемой границей. Типы термодинамических систем: а) закрытая (замкнутая) система отличается постоянством общей массы, она не обменивается с внешней средой веществом. Обмен энергией в форме теплоты, излучения или работы возможен; б) открытая система обменивается энергией и веществом с внешней средой; в) изолированная система не обменивается энергией (теплотой или работой) и веществом с внешней средой и имеет постоянный объём; г) адиабатически-изолированная система лишена возможности только теплообмена с внешней средой, она может быть связана с внешней средой работой получаемой от неё и совершаемой над ней. Параметры состояния системы – это любые измеряемые макроскопические характеристики состояния системы. Различают: -интенсивные параметры – параметры, не зависящие от массы (температура T, давление р). -экстенсивные параметры (ёмкостные) – параметры пропорциональные массе вещества (объем V, теплоемкость C, масса m). Экстенсивные параметры станут интенсивными, если их отнести к единице массы вещества (удельный объем Vуд, плотность). Термодинамический процесс – это всякое изменение в системе, связанное с изменением хотя бы одного из термодинамических параметров. Изменение вследствие химического превращения называется химической реакцией. Виды процессов: T = const – изотермический или изотермный. P = const – изобарический или изобарный. V = const – изохорический или изохорный. Q = const – адиабатический или адиабатный. Круговым (циклическим ) процессом или циклом называется процесс, в течение которого система изменяла свои свойства и в конце которого вернулась к исходному состоянию. Обратимый процесс – это идеальное понятие. Он протекает как в прямом так и в обратном направлении без изменения работоспособности системы. Обратимый процесс протекает бесконечно медленно через одну и ту же последовательность состояния равновесия в обоих направлениях, чтобы после возвращения системы в первоначальное состояние ни в окружающей среде, ни в самой системе не было никаких изменений. В обратимых процессах совершается максимальная работа. При необратимом процессе возвращение системы в исходное состояние связано с изменением состояния внешней среды. Поэтому затрата работы на обратный процесс (возвращение в исходное состояние) значительно больше работы прямого процесса.. Функция состояния системы – это параметр, изменение которого зависит только от начального и конечного состояния системы и не зависит от пути процесса (внутренняя энергия U, энтальпияH, энергия ГиббсаG, энергия ГельмгольцаF, энтропияS, химический потенциалμ). Равновесное состояние системы – это состояние, при котором термодинамические параметры не изменяются со временем и сохраняют одинаковые значения в каждой фазе; при этом энергия системы минимальна. Неравновесное состояние системы – это состояние, при котором термодинамические параметры изменяются со временем. Л е к ц и я 2 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ План лекции: Термодинамическое определение внутренней энергии, энтальпии, теплоты и работы. Функции состояния и функции процесса. Формулировки первого закона термодинамики. Математическое выражение первого закона. Термохимия. Тепловые эффекты в процессах, протекающих при постоянном давлении и постоянном объеме. Теплоемкость, теплоемкости при постоянном давлении и постоянном объеме, связь между ними, уравнение Майера. Температурная зависимость теплоемкости. Расчет работы и теплоты в простейших термодинамических процессах. Внутренняя энергияU – этообщий запас энергии системы, который складывается из энергии движения и взаимодействия молекул, ядер и электронов в атомах, т. е. всех видов энергии системы кроме кинетической энергии системы как целого и её потенциальной энергии положения. Абсолютную величину U определить невозможно, можно определить только её изменение ∆U. Внутренняя энергия зависит от природы вещества, Т, р, агрегатного состояния и др. U – это функция состояния системы. Другая функция состояния системы - это энтальпия Н. H=U + pV ,гдеp∆V – работа расширения. Энтальпию называют энергией расширенной системы или теплосодержанием системы. Абсолютное значение H определить невозможно. Для описания процессов протекающих при V = const используется ∆U. Для описания процессов протекающих при P = const используется ∆H. Разница между ∆U и ∆H значительна для систем, содержащих вещества в газообразном состоянии. Для конденсированных, особенно кристаллических состояний, разница между ∆U и ∆H относительно невелика. Теплота и работа – это формы передачи энергии, величины которых характеризуют процесс и зависят от пути процесса; они функции процесса. Теплота Q – это неупорядоченная форма передачи энергии. Она всегда связана с тепловым (хаотическим) движением частиц. Теплота внутри системы считается положительной, Q > 0, если тепло поглощается системой (эндотермический процесс). Теплота внутри системы отрицательна, Q < 0, если тепло выделяется системой (экзотермический процесс). Тепловой эффект ∆Q > 0 → ∆Q < 0 → То есть Работа А – это упорядоченная форма передачи энергии. Работа считается положительной A> 0, если она совершается системой против внешних сил (например, расширение газа), и работа отрицательна A< 0, если она производится внешними силами над системой (например, сжатие газа). Работа представляет сумму здесь 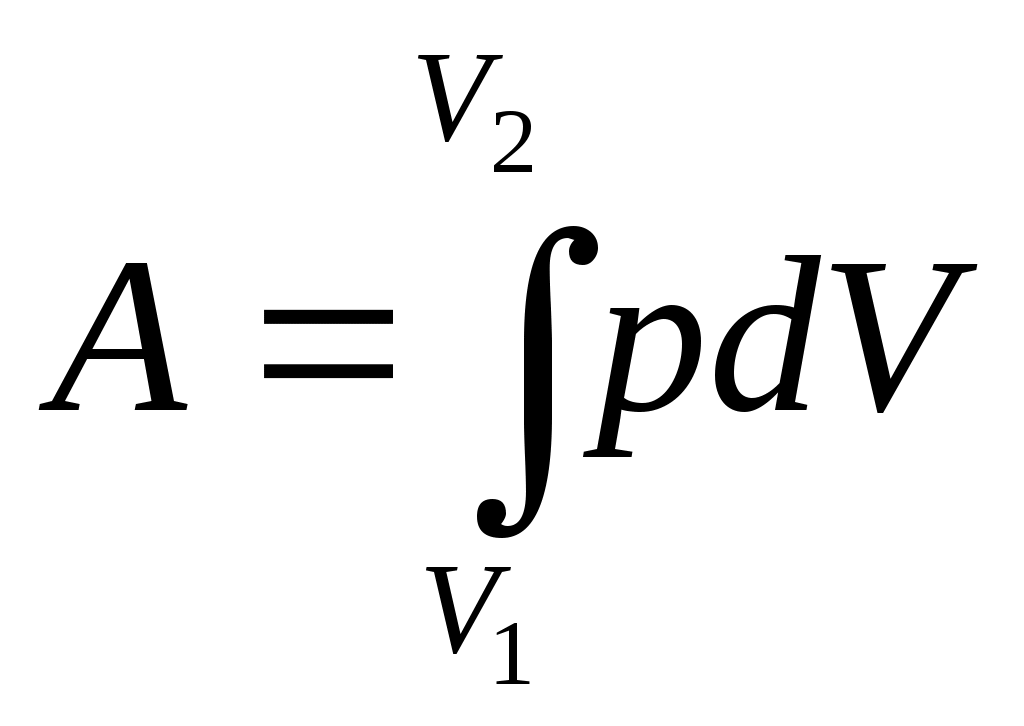 , ,здесь d– мгновенное изменение; δ – бесконечно малая величина; индекс 1 – начальное, а индекс 2 – конечное состояние системы. Первый закон термодинамики – это постулат. Известны следующие формулировки закона. Закон сохранения энергии, в применении его к термодинамическим процессам, является одним из выражений первого закона термодинамики: в изолированной системе общий запас энергии сохраняется постоянным. Энергия переходит из одного вида (формы) в другой в строго эквивалентных количествах. Вечный двигатель первого рода невозможен: получить работу не затрачивая энергию нельзя. Пусть система переходит из состояния 1 в состояние 2. При этом система поглощает теплоту Q, которая расходуется на изменение внутренней энергии системы ∆U и совершение работы А. 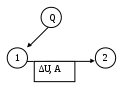 Q = ∆U + A или Q = ∆U + A или Это математическое выражение первого закона термодинамики. Рассмотрим изохорный процесс (V = const): Если V = const, то dV= 0, тогда pdV= 0 и, следовательно, Тепловой эффект реакции при изохорном процессе равен изменению внутренней энергии системы. Рассмотрим изобарный процесс (р = const): или Так как В изобарном процессе тепловой эффект реакции равен изменению энтальпии. Заменим выражение Согласно уравнению Клайперона-Менделева где Для конденсированных систем Qр = QV. Теплоёмкость – это количество тепла, необходимое для нагревания данного количества вещества на один градус. Удельная и молярная теплоёмкость – это отношение количества теплоты Q, поглощённое одним граммом (Суд - удельная) или одним моль (См - молярная) вещества к повышению температуры (∆T = T2 – T1), которым сопровождается его нагревание. Единицы измерения теплоемкости: [Cуд] = Дж/г·К, [Cм] = Дж/моль·К. Средняя теплоемкость Истинная теплоемкость определяется как При p = cons: Разница между теплоемкостью при изобарных и теплоемкостью при изохорных условиях равна газовой постоянной Rи описывается уравнением Майера: Cр – CV = R. Теплоемкость зависит от температуры. Зависимость C = f(T) выражается эмпирическими уравнениями, найденными опытным путём. Они имеют вид: где Применение первого закона термодинамики рассмотрим на примерах расчетов работы и теплоты в термодинамических процессах. Выражения зависимости работы и теплоты от параметров р, V, T системы в конечном (индекс 2) и начальном (индекс 1) состояниях системы в четырех основных процессах с идеальным газом приведены в табл. 1. Таблица 1 Расчеты величин работы и теплоты в процессах с идеальными газами
Примечание: * - Задача: СО2 в количестве 100 г находится при 0 °С и давлении 1,013· 105 Па. Определить Q, А, ∆U, ∆Н: а) при изотермном расширении до объема 0,2 м3; б) при изобарном расширении до того же объема; в) при изохорном нагревании до достижения давления 2,026 ·105 Па; г) при адиабатном сжатии до 2,026· 105 Па. Принять, что СО2 подчиняется законам идеальных газов, а истинная мольная теплоемкость СО2 при постоянном давлении постоянна и равна 37,1 Дж/моль·К. Решение: а) Для изотермного расширения Число молей СО2 в 100 г составляет: Первоначальный объем определяем по уравнению Количество теплоты равно б) Для изобарного процесса так как Работа расширения газа в изобарном процессе в) Для изохорного процесса: Отсюда г) Для адиабатного сжатия 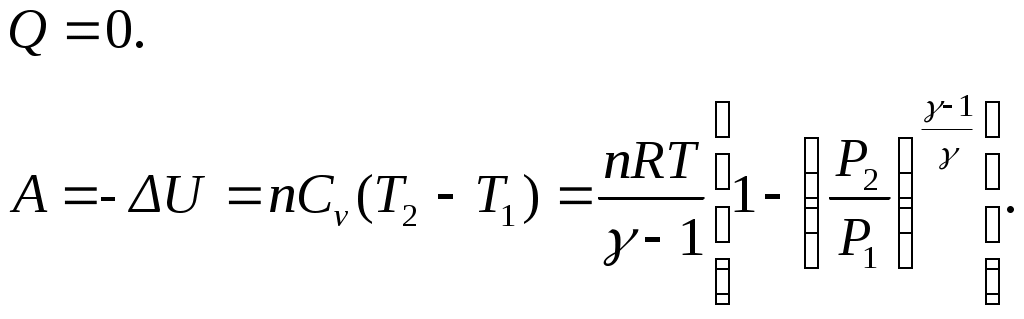 Коэффициент Выражая конечный объем V2 из уравнения адиабаты 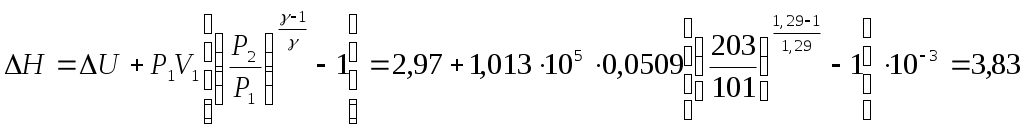 кДж. кДж.Л е к ц и я 3 ТЕРМОХИМИЯ План лекции: Термохимия. Закон Гесса. Основные следствия закона Гесса и использование их для расчета тепловых эффектов физико-химических процессов. Зависимость теплового эффекта от теплоемкости и температуры. Уравнение Кирхгофа. Развернутое уравнение Кирхгофа. Термохимия – это раздел термодинамики, который изучает тепловые эффекты процессов. В термохимии под тепловым эффектом Закон Гесса – это основной закон термохимии. Формулировка закона: тепловой эффект процесса не зависит от числа и характера промежуточных стадий, а определяется только начальным и конечным состоянием системы. |
