Контрольные вопросы к зачету Предмет физики. Связь физики с другими науками и техникой. Характеристики поступательного движения точки
 Скачать 1.81 Mb. Скачать 1.81 Mb.
|
34. Равновесие фаз. Кривая равновесия. Тройная точкаВажнейшим вопросом в учении о фазовых переходах является выяснение условий, при которых система, состоящая из двух или нескольких фаз, находится в равновесии. Для равновесия необходимо: 1) чтобы все фазы системы имели одну и ту же температуру T1 =T2 =T; 2) чтобы давление по разные стороны границы раздела соприкасающихся фаз было одинаково P1 =P2 =P; 3) чтобы массы всех фаз системы оставались неизменными, т.е. чтобы масса одной из фаз не росла за счет другой m1=const,m2=const;m1 +m2 =m =const. Рассмотрим процесс сжатия реального газа (пара). На рис. 17.1 процесс сжатия в координатахP-V, например, при температуреT1, представлен изотермой реального газа. При сжатии до точкиСдавление газа повышается и газ представляет собой газообразную однородную фазу. ТочкаС– состояние насыщенного пара. Насыщенным паром называется пар, находящийся в динамическом равновесии со своей жидкостью. При дальнейшем сжатии газа часть его превращается в жидкость. Участок изотермыВС – это участок, характеризующий состояние двухфазной системы – жидкость–пар. В сосуде одновременно существуют две фазы, находящиеся в равновесии и разделенные границей, являющейся поверхностью жидкости.Состояние динамического равновесиянаступает, если число молекул, вылетающих из жидкости в результате теплового движения, равно числу молекул, возвращающихся обратно в жидкость. В точкеВ весь сосуд полностью заполнен жидкостью (жидкой фазой). При дальнейшем уменьшении объёма производится сжатие жидкости. 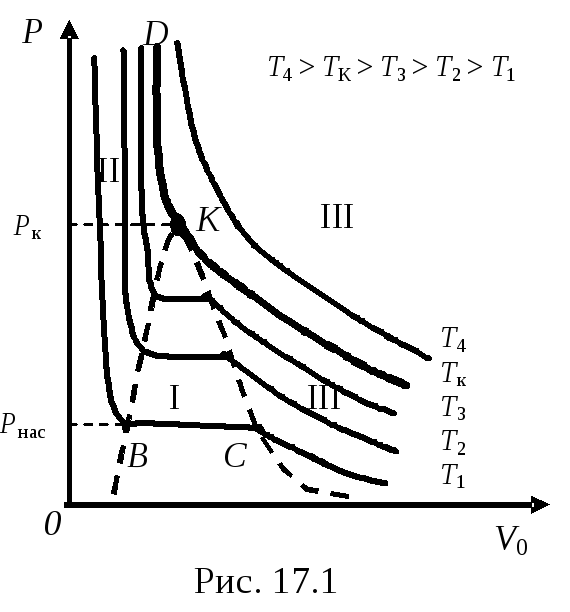 При повышении температуры участок изотермы, соответствующий двухфазному состоянию системы, участок ВС, уменьшается. При критической температуреTкэтот участок изотермы превращается в точку. В этой точке исчезает разница между жидкостью и газом. Жидкость и газ имеют одинаковые физические свойства. При температуре выше критическойTкгаз не может быть превращен в жидкость ни при каком давлении. Состояние системы в точкеКназывается критическим. При давлении большеPкизотермаTкразделяет жидкое и газообразное состояние реального газа. При пересечении этой изотермы (криваяKD) происходит непрерывный переход из газообразного состояния в жидкое. КриваяВК– это кривая, отделяющая жидкую фазу от двухфазного состояния. А криваяКС – это кривая, отделяющая газообразную фазу от двухфазного состояния. Значит областьIIна рисунке – это область жидкой фазы. ОбластьI– это область состояния системы в двух фазах (жидкость – пар), находящихся в состоянии равновесия. Область III – это состояние существования одной фазы – газообразной. Причем, если температура газа при этом ниже критическойTк– это пар – газообразное состояние, имеющее большую плотность. При высоких температурах (большеTк) плотность газа заметно меньше и пар имеет свойства газа. При фиксированной температуре (T = const) давление в термодинамической системе может принимать любое значение в пределах от нуля до бесконечности. Однако существует единственное значение давленияP = Pнас, при котором система является двухфазной. Это давление равно давлению насыщенных паровPнасжидкости и соответствует линииконденсацииВСна изотерме реального газа. При изменении температуры системы положение линии конденсации и соответственно равновесное давление двухфазной системы изменяется. Закон изменения давления с температурой в равновесной двухфазной системе устанавливает уравнение Клапейрона – Клаузиуса. Построим график изменения равновесного давления двухфазной системы с температурой – график кривой фазового равновесия или кривая кипения и конденсации в координатах P-T. Рассмотрим в качестве примера фазовый переход: жидкостьпар. Имеем закрытый сосуд, в котором при некоторой температуреТнаходится двухфазная система: жидкость (одна фаза) и ее насыщенный пар (другая фаза), рис. 17.2. Насыщенным паром называется пар, находящийся в динамическом равновесии со своей жидкостью.Состояние динамического равновесиянаступает, если число молекул, вылетающих из жидкости в результате теплового движения, равно числу молекул, возвращающихся обратно в жидкость. Давление насыщенного пара зависит только от температуры. На рисунке кривая ОК– этокривая равновесия жидкости и ее насыщенного параиликривая испарения (кривая конденсации). Любая точка этой кривой дает значения давления и температуры, при которых жидкость и пар находятся в динамическом равновесии друг с другом. ТочкаКсоответствует критической температуреТк, приТкпар становится неотличимым от жидкости (плотность пара равна плотности жидкости), поэтому кривая равновесия заканчивается в точкеК. ВточкеОжидкость охлаждается настолько, что начинается ее затвердевание. Точки лежащие левее кривойОК, изображают жидкое состояние вещества, а точки, лежащие правее кривойОК, – газообразное состояние вещества. Точки же самой кривойОКотвечают состояниям, в которых существуют одновременно обе фазы вещества, находящиеся в состоянии динамического равновесия. При дальнейшем отнятии теплоты, затвердевание жидкости, начавшееся в точкеО, будет продолжаться до тех пор, пока вся масса жидкости не перейдет в твердое состояние, причем давлениеP0и температураТ0будут оставаться неизменными все это время (рис. 17.3). 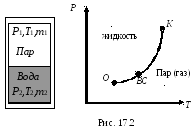 Когда вся жидкость перейдет в твердое состояние, то над твердым телом будет по-прежнему насыщенный пар. Если дальше отнимать тепло у этой системы, давление насыщенного пара будет падать.Кривая ОВ – это кривая равновесия фазового перехода: твердое тело пар (газ).Кривая равновесияОВтвердого тела с газом (паром) уходит в начало координат, т.к. при абсолютном нуле (Т= 0K) температуры, согласно представлениям классической физики, вещество при любом давлении находится в твердом состоянии. Исключение составляет только гелий, остающийся после своего сжижения жидким при всех температурах вплоть до абсолютного нуля. Необъяснимое с точки зрения классических представлений поведение гелия связано с квантовыми явлениями.  В точке Осомкнулись уже две кривые равновесия для двух фазовых переходов: кривая равновесияОКдля фазового перехода жидкостьпар (газ) и криваяОВдля фазового перехода: твердое телопар (газ). Кривая равновесия для последнего фазового перехода: жидкость твердое тело, тоже пройдет через точкуО. Этокривая плавления ОС, она может продолжаться неограниченно. В точкеОсомкнулись уже три кривые равновесия для трех фазовых переходов. ТочкаО–тройная точка, в ней все три фазы: жидкая, твердая и газообразная находятся в равновесии.P0иТ0различны для различных веществ, например, для водыP0= 4,62 мм рт.ст. иt= + 0,01оС. ПлоскостьТ-Рс указанными тремя кривыми равновесия называетсядиаграммой состояния. Диаграмма состояния позволяет судить о фазовых превращениях при том или ином процессе. |
