Доклад к курсовой работы. Доклад к курсовой. Котляр Светлана Ивановна Витебск, 2022 цель целью настоящей работы было разработка лабораторный регламент
 Скачать 65.68 Kb. Скачать 65.68 Kb.
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ УО «ВИТЕБСКИЙ ГОСУДАРСТВЕННВЙ ОРДЕНА ДРУЖБЫ НАРОДОВ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» КАФЕДРА ПРОМЫШЛЕННОЙ ТЕХНОЛОГИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ С КУРСОМ ФПК и ПК Доклад к теме Разработка лабораторный регламент производства раствора пиридоксина гидрохлорида 5% для инъекций (на 1000л в ампулах по 1 мл) Подготовил : студент 4 курса ФПИГ по специальности “Фармация” АЛДАЛИ ХОССАМ Научный руководитель: к.ф.н. доцент Котляр Светлана Ивановна Витебск, 2022 ЦЕЛЬ Целью настоящей работы было - разработка лабораторный регламент производства раствора пиридоксина гидрохлорида 5% для инъекций (на 1000л в ампулах по 1 мл  Охарактиризовать лекарственный препарат пиридоксина гидрохлорида 5 % -1 мл для инъекций; Начертить технологическая схема производства раствора пиридоксина гидрохлорида 5 % для инъекций; Составить материальннй баланс с учетом потерь на производства 1000 литров пиридоксина гидрохлорида для инъекций; Привети расходную пропись; ЗАДАЧИ Введение В данной работе составлен лабораторный регламент на производство раствора пиридоксина гидрохлорид 5% -1 мл для инъекций. Технологические регламенты производства разрабатываются на производство фармацевтической и микробиологической продукции. Лабораторный регламент является технологическим документом, которым завершаются научные исследования в лабораторных условиях при разработке технологии производства нового вида продукции или нового технологического метода производства серийно выпускаемой продукции. Лабораторный технологический регламент является основой для разработки опытно-промышленного регламента и составления исходных данных на проектирование опытно-промышленной установки, контрольно-измерительного и испытательного оборудования. Инъекционные лекарственные средства -стерильные растворы, эмульсии или суспензии. Их готовят путем растворения, эмульгирования или суспендирования действующего вещества или вещества и вспомогательных веществ в воде для инъекций или в подходящей стерильной неводной жидкости, или в смеси этих растворителей. Растворы для инъекций в соответствующих условиях наблюдения должны быть прозрачными и практически свободными от частиц. Характеристики лекарственного препарата Пиридоксин был открыт в 1934 г. Гиорги, в 1938 г. он был выделен из рисовых отрубей, идентифицирован как витамин В6 в 1939 г., в этом же году американцы Гаррис и Фолькерс разработали его синтез. Его строение было установлено Е. Стиллером и Г. Вендтом. Торговое название препарата: Раствор пиридоксина гидрохлорида 5% для инъекций . МНН: Пиридоксина гидрохлорида - Pyridoxini hydrochloridum Лекарственная форма: Раствор для инъекций Описание: Прозрачная бесцветная или слегка желтоватая жидкость . Водные растворы имеют pH 3,2–3,0, устойчив в кислых и щелочных растворах . Назначение Препарат пиридоксина гидрохлорида 5 % назначают для парентерального применения ( Подкожно (п/к), внутривенно (в/в), внутримышечно (в/м)) Раствор пиридоксина гидрохлорида 5% для инъекций. Solutio Pyridoxini hydrochloridi 5% pro injectionibus Состав: пиридоксина гидрохлорида - 50 мг; воду для инъекций - до 1,0 л . Технологическая схема производства раствора пиридоксина гидрохлорида 5% для инъекций
Таб.1. Аппаратурная схема производства и спецификация оборудования
Таб.2. Характеристика сырья
Описание технологического процессаВодоподготовка В промышленных условиях получение воды для инъекций и воды очищенной осуществляют методом дистилляции с помощью высокопроизводительных корпусных аппаратов, термокомпрессионных дистилляторов различных конструкций или установок обратного осмоса. ВР-1 Подготовка помещений, оборудования, персонала, воздухаВР-1.1 Подготовка помещений Стерильную продукцию необходимо производить в чистых зонах, доступ в которые персонала и поступление оборудования и материалов должны осуществляться через воздушные шлюзы. Чистые зоны следует обслуживать таким образом, чтобы они отвечали стандарту; в них необходимо поставлять воздух, который прошел через фильтры требуемой эффективности. Чистые зоны (помещения) при производстве стерильных лекарственных средств подразделяются на четыре класса. Класс А: Локальная зона для проведения операций, представляющих высокий риск для качества продукции. Класс B: Зона, непосредственно окружающая зону класса А, и предназначенная для асептического приготовления и наполнения. Классы C и D: Чистые зоны для осуществления менее критичных стадий производства стерильной продукции. Таблица 1 - Классификация зон по загрязнению воздуха частицами
Таблица 2 - Примеры операций для продуктов, подлежащих финишной стерилизации, примеры операций для асептического приготовления
Таблица 3 - Рекомендуемые пределы микробного загрязнения.
ВР-1.2 Подготовка оборудования ВР-1.3 Подготовка персонала В чистых зонах должно находиться минимальное количество необходимого персонала, что особенно важно для асептического производства. Проверки и контрольные операции, по возможности, следует осуществлять, находясь за пределами чистых зон. ВР-1.4 Подготовка воздуха Во всех производственных помещениях предусматривается устройство приточно-вытяжной вентиляции с механическим и естественным побуждением воздуха. Воздухообмены в помещениях должны быть рассчитаны на ассимиляцию выделяющихся загрязнений, а также нормируемой кратности воздухообменаظ ВР-2 Подготовка фармацевтических субстанций , вспомогательных материалов, фильтров и фильтрующих материаловВР-2.1. Отвешивание пиридоксина гидрохлоридаНа весах электронных напольных КП-2-1 отвешивают 55 715 г (55,715 кг) пиридоксина гидрохлорида. ВР-2.2 отмеривание воды для инъекций Воды для инъекций отмеривают 1 074 742,3500 мл (1 074,74 л) . ВР-2.3 Подготовка фильтров и фильтрующих материалов к работе Фильтрование раствора осуществляется через друк-фильтры. ТП-1 Приготовление и фильтрация раствораТП-1.1 Растворение пиридоксина гидрохлорида в воде для инъекций приготовления в специальных помещениях с соблюдением правил асептики. В реактор помщают 55,715 кг пиридоксина гидрохлорида и добавляют воду для инъекций до 1000 литров (1 074,74 л) . компоненты перемещивают до полного растворения . ТП-1.2 Фильтрация раствора После перемешиания и полного растворения порошка , его фильтуют через друк-фильтры. ТП-2. Ампулирование раствораТП-2.1 Подготовка ампул к наполнению Это может производиться различными методами. Наиболее простой способ - ручная отрезка капилляров. Второй способ отрезки капилляров -механический, с помощью дискового ножа. ТП-2.2 Укладка ампул в кассеты ТП. 2.3 Мойка и сушка ампул: Наружная мойка Наружная мойка происходит в полуавтоматах АП-2М-2. Внутренняя мойка Внутреннюю мойку осуществляют шприцевым способом. После мойки ампулы достаточно быстро, чтобы предотвратить вторичное загрязнение, передаются на сушку или стерилизацию (за исключением тех способов мойки, которые включают в себя эти процессы) в зависимости от условий ампулирования. Сушка Сушка может проводиться в специальных (сухожаровых) сушильных шкафах при температуре 120-130°С 15-20 минут. Если необходима стерилизация, то обе операции объединяются и ампулы выдерживают в суховоздушном стерилизаторе при 180°С в течение 60 минут. ТП.2.4 Наполнение и запайка ампул Наполнение ампул Наполнение ампул осуществляют шприцевым способом. Наполнение производится в помещениях А класса чистоты с обязательным соблюдением всех правил асептики. Запайка ампул ТП-3. Стерилизация и проверка на герметичностьТП.3.1. Стерилизация Наиболее широко используется для стерилизации автоклавирование. Раствор стерилизуют текучим паром при 1200С в течение 2 часов. ТП-3.2 Проверка на герметичность после автоклавирования бюксы с горячими ампулами помещают в ванну с холодной водой, подкрашенной 0,0005% метиленовым синим. ТП-4. Просмотр ампулВизуальный контроль . ТП-5. СтандартизацияРаствор пиридоксина гидрохлорида 5% для инъекций подвергаются испытаниям на: отсутствие механических включений; стерильность; аномальная токсичность; бактериальные эндотоксины-пирогенность; однородность дозированных единиц; определение извлекаемого объема парентеральных лекарственных средств; УМО 1. Упаковка, маркировка, отгрузка УМО-1.1. Первычная упаковка УМО-1.2. Вторичная упаковка УМО-1.3. Групповая упаковка УМО-1.4 Маркировка УМО-1.5 Отгрузка на склад Материальный балансРаствор пиридоксина гидрохлорида 5% (на 1000 л в ампулах по 1 мл). Solutio Pyridoxini hydrochloridi 5%-1ml 50,0 г – 1 л Х г – 1000л Пиридоксина гидрохлорида: х=1 000*50,0 =50 000,0 г Объем ампулы – 1,0 мл. Объем наполнения ампулы – 1,10 мл. Масса пиридоксина гидрохлорида: 1,1*50 000,0 =55 000 ,0г V(раствора)=1,1* 1 000 000=1 100 000 мл V(H2O)= V(раствора) – KYO* m(ПГ) =1 100 000 -0.71* 55 000 =1 100 000 – 39 050 =1 060 950 мл
Материальные потери на стадиях производства, %
ТП 1.1 Приготовление раствора Пиридоксина гидрохлорид: 55 000г – 100% х=82,5 г х – 0,15% 55 000 – 82,5 = 54917,5 г Вода для инъекций: 1 060 950 мл – 100% у=1 591,4250 мл у – 0,15% 1 060 950 – 1 591,425 = 1 059 358,5750 мл ТП 2. Ампулирование Пиридоксина гидрохлорид: 54917,5 г– 100% х=137,2938 г х – 0,25% 54917,5 – 137,2938 = 54780,2062 г Вода для инъекций: 1 059 358,575 мл – 100% у=2 648,3964 мл у – 0,25% 1 059 358,575 – 2 648,3964 = 1 056 710,1790 мл Ампулы: 1 000 000шт. – 100% z=2 500 шт. z – 0,25% 1 000 000 – 2500 = 997 500 шт. ТП 3.1 Стерилизация Пиридоксина гидрохлорид: 54780,206 г – 100% х=164,3406 г х – 0,3% 54780,2062 – 164,3406 = 54615,8656 г Вода для инъекций: 1 056 710,1790 мл – 100% у=3 170,1305 мл у – 0,3% 1 056 710,1790 – 3 170,1305 = 1 053 540,0490мл Ампулы: 997 500 шт. – 100% z=2 992шт. z – 0,3% 997 500 – 2 992 = 994 508 шт. ТП 5. Контроль качества Пиридоксина гидрохлорид: 54615,8656 – 100% х=273,0793 г х – 0,5% 54615,8656 – 273,0793= 54342,7863 г Вода для инъекций: 1 053 540,0490 мл – 100% у=5 267,7002 мл у – 0,5% 1 053 540,0490 – 5 267,7002 = 1 048 272,3490мл Ампулы: 994 508 шт. – 100% z=4 972 шт. z – 0,5% 994 508 – 4972 = 989536шт. УМО 1.1 Этикетирование Пиридоксина гидрохлорид: 54342,7863 г – 100% х=54,3428 г х – 0,1% 54342,7863 – 54,3428 = 54288,4435 г Вода для инъекций: 1 048 272,3490 мл – 100% у=1 048,2723мл у – 0,1% 1 048 272,3490 – 1 048,2723 = 1 047 224,0770мл Ампулы: 989536шт. – 100% z=989шт. z – 0,1% 989536 – 989 = 988547 шт. Содержание веществ в %: Пиридоксина гидрохлорид: (54288,4435/55 000)*100% = 98,71% Вода для инъекций: (1 047 224,0770 /1 060 950)*100% = 98,71% % Потерь: Пиридоксина гидрохлорид: ((55 000 – 54 288,4435)/11 000*100% = 1,29% Вода для инъекций: ((1 060 950 – 1 047 224,0770)/ 1 060 950)*100% = 1,29% Ампулы: ((1 000 000 – 988547)/1 000 000)*100% = 1,15% Расходный коэффициент: Пиридоксина гидрохлорид: 55 000/54288,4435 = 1,013 Вода для инъекций: 1 060 950/1 047 224,0770= 1,013 Ампулы: 1000000/988547 = 1,012 Расходная пропись: Пиридоксина гидрохлорид: 55 000*1,013 = 55 715 г Вода для инъекций: 1 060 950 *1,013 = 1 074 742,3500 мл Ампулы: 1000000*1,012 = 1 012 000 шт
В настоящее время проводится большая работа по совершенствованию изготовления инъекционных растворов. Разрабатываются новые способы и аппараты для получения воды для инъекций высокого качества. Изыскиваются возможности обеспечения необходимых асептических условий изготовления, позволяющих выполнить требования стандарта GMP. Расширяется ассортимент моющих , дезинфицирующих и моюще-дезинфицирующих средств . Совершенствуется технологический процесс , используются современные производственные модули , разрабатываются новые современные приборы и аппараты (мерники-смесители , фильтрующие упаковки , установки ламинарного потока воздуха, стерилизующие аппараты, приборы для контроля отсутствие механических включений и других). 5. Совершенствуется качество исходных субстанции, растворителей, расширяется ассортимент стабилизаторов различного назначения. 6. Расширяются возможности внутриаптечной заготовки растворов . 7. Совершенствуются методы оценки качества и безопасности инъекционных растворов . 8. Внедряются новые вспомогательные материалы упаковочные и укупорочные материалы. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


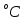 в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды и защищающих ее от инородных частиц и микробиологических загрязнений, в постоянно циркулирующем состоянии не более 24 часов.
в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды и защищающих ее от инородных частиц и микробиологических загрязнений, в постоянно циркулирующем состоянии не более 24 часов.