Краткий обзор строения и химических свойств углеводородов, спиртов, фенолов, тиолов и аминов
 Скачать 2.06 Mb. Скачать 2.06 Mb.
|
  22. По кислотно-основным свойствам аминокислоты делятся на несколько групп. Укажите аминокислоту, относящуюся к основным: 22. По кислотно-основным свойствам аминокислоты делятся на несколько групп. Укажите аминокислоту, относящуюся к основным:Аланин. Валин. Глицин. *Лизин. Серин. 23. Аминокислоты вступают в реакции с альдегидами. Укажите класс соединений, образующийся при этом: Спирты *Имины Альдегиды Кислоты Сложные эфиры 24. По кислотно-основным свойствам аминокислоты делятся на несколько групп. Укажите аминокислоту, относящуюся к кислым: Гистиди. Фенилаланин *Глутаминовая кислота Аргинин. Оксипролин 25. Аминокислоты биологически активные соединения, для которых характерна стереоизомерия. Укажите количество ассиметрических атомов углерода в молекуле -аминопропионовой кислоты: Один. Два. Три. Четыре Пять 26. Аминокислота гистидин в своей структуре содержит гетероциклический радикал. Укажите гетероцикл, радикал которого входит в структуру данной аминокислоты: Пиридин Индол Пиразол Пиримидин *Имидазол 27. По кислотно-основным свойствам аминокислоты делятся на несколько групп. Укажите аминокислоту, относящуюся к нейтральным: Лизин. Аланин Глутаминовая кислота. Серин Аспаргиновая кислота 28. В организме человека глутаминовая кислота подвергается дезаминированию. Укажите продукт ее дезаминировании: *α-Оксокислота и аммиак Альдегид и вода Кетон и аммиак β-Оксикислота и вода Е. Молочная кислота и азот 29. Белки состоят из аминокислотных фрагментов и обладают различными уровнями структурной организации. Укажите определение, описывающее первичную структуру белка: Полинуклеотидная цепь *Полипептидная цепь Полисахаридная цепь Смесь аминокислот Полиамидная цепь 30. α-Аминокислоты, являющие структурными компонентами клеток, классифицируют по природе радикала, входящего в ее структуру. Классифицируйте аминокислоту аланин: 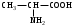 Дикарбоновая, полярный радикал; Алифатическая, полярный радикал; Серусодержащая, полярный радикал; Кислородсодержащая, полярный радикал; Алифатическая, неполярный радикал. 31. Практические все природные аминокислоты принадлежат к L-ряду. Укажите L- форму аспарагиновой кислоты: 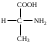 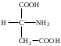 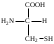 С. 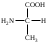 D. D.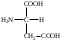 Е. 32. α-Аминокислоты классифицируют в зависимости от признака, положенного в основу деления на группы. Классифицируйте приведенную аминокислоту в зависимости от количества амино- и карбоксильных групп: 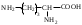 А. Моноаминомонокарбоновая В. Моноаминодикарбоновая С. *Диаминомонокарбоновая D. Диаминодикарбоновая Е. Моноаминотрикарбоновая 33. При кислотном гидролизе РНК были получены: гетероциклическое основание, углеводный остаток и остаток неорганической кислоты. Укажите моносахарид, входящий в состав данной нуклеиновой кислоты: А. D-глюкоза В. D-фруктоза С. *D-рибоза D. Дезокси-D-рибоза Е. D-галактоза. 34. Аминокислоты могут взаимодействовать между собой и образовывать длинные пептидные цепи. Укажите функциональные группы, участвующие в этом процессе: Гидроксильные а аминогруппы Гидроксильные группы Карбоксильные группы Аминогруппы и карбонильные *Аминогруппы и карбоксильные 35. Биологические катализаторы – ферменты являются полипептидными веществами. Укажите при помощи, какой реакции можно определить наличие пептидной связи в белках и пептидах: *Биуретовая реакция; Ксантопротеиновая реакция; Метод Ван-Слайка Реакция формольного титрования; Реакция серебряного зеркала. 36. При ферментативном гидролизе нуклеиновых кислот были получены гетероциклические основания, углеводный остаток и остаток неорганической кислоты. Укажите пуриновые основания, входящие в состав этих кислот: Урацил, тимин, цитозин; Пиррол, индол; Имидазол, пиразол; *Аденин, гуанин; Пиридин, пиримидин. 37. В организме -аминокислоты подвергаются окислительному дезаминированию под действием ферментов оксидаз и окислительного агента кофермента НАД+. Укажите продукт этой реакции: 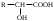 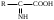 * 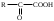 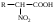 D. 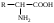 Е. 38.L-Аспарагиновая кислота в организме под действием фермента аспартазы подвергается неокислительному дезаминированию. Укажите конечный продукт реакции: А. Янтарная кислота В. Щавелевоуксусная С. Этиламин D. *Фумаровая кислота Е. Ацетоуксусная 39. В лаборатории методом Ван-Слайка проводили окислительное дезаминирование аминокислоты аланин. Укажите конечный продукт реакции: А. Пировиноградная кислота В. Этиламин С. *Молочная кислота D. Пропионовая кислота Е. Этаноламин 40. -Аминокислоты могут взаимодействовать с альдегидами. Укажите конечный продукт реакции: А. Карбоновые кислоты В. Ангидриды С. *Имины D. Сложные эфиры Е. Оксокислоты 41. -Аминокислоты относительно легко декарбоксилируются. Укажите конечный продукт при проведении этой реакции с аланином: 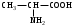 А. Метиламин В. Этиламин С. Молочная кислота D. Формальдегид Е. Ангидрид 42. В живом организме -аминокислота гистидин под влиянием фермента декарбоксилазы подвергаются декарбоксилированию. Укажите, какой биогенный амин образуется при этом: 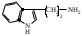 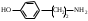 В. 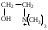 С. 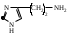 D*.  Е. |
