лекции кристаллография. Кристаллография наука, изучающая процессы образования, формы, структуру и физикохимические свойства кристаллов
 Скачать 0.89 Mb. Скачать 0.89 Mb.
|
|
Классификационная схема пространственных групп симметрии. В качестве определяющего признака принято использовать порядок оси, либо метрику трансляционной группы. Н 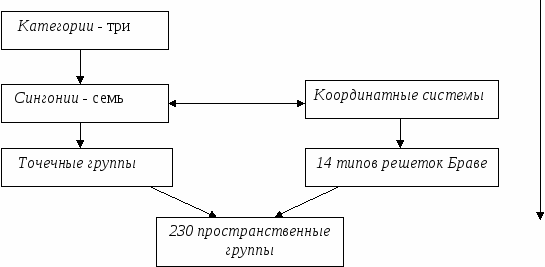 а основе порядка На основе метрики а основе порядка На основе метрикиоси трансляционной группы детализация признаков Международные символы точечных групп. Пишутся только порождающие элементы симметрии ( предпочтение отдается плоскостям). n – ось n-го порядка; _ n – инверсионная ось n-го порядка; m – плоскость симметрии; nm – ось симметрии n-го порядка и m плоскостей симметрии проходящих через нее; n/m – ось симметрии n-го порядка и плоскость симметрии ей перпендикулярная; n2 – ось симметрии n-го порядка и n осей второго порядка, которые будут перпендикулярны ей; n/m*m – ось симметрии n-го порядка, плоскость ей перпендикулярная и плоскость ей параллельная. Важно соблюдать правило установки кристаллов и порядок записи. При этом различают «координатные» элементы симметрии, проходящие вдоль координатной плоскости и «диагональные», проходящие по биссектрисам углов между ними. Пример, средняя категория L66P 6m 1 позиция – главная ось; 2 позиция – координатные элементы симметрии; 3 позиция – диагональные элементы симметрии. Правила записи символа пространственной группы. (в интернациональных символах) На первом месте ставится большая латинская буква, обозначающая решетку Браве или группу чистых трансляций. P A,B,C I F +R - ромбоэдрическая После этой записи следует запись, отвечающая точечной группе. Т. е. следует совокупность порождающих элементов, отвечающая формуле того вида симметрии разновидностью которой является данная пространственная группа. Символ группы содержит 4, 3 или 2 позиции. Отсутствие элемента на соответствующей позиции обозначается цифрой 1. Сингонии: 1.триклинная: Р1 – две пространственные группы. 2.моноклинная: относятся 13 пространственных групп ( с 3..15). ось второго порядка 2 или винтовая линия есть плоскость перпендикулярная оси второго порядка (р2/m) 3.ромбическая (с 16..74) – 59 пространственных групп. плоскость перпендикулярная оси ОХ или ось симметрии параллельная оси OX. плоскость перпендикулярная оси ОY или ось симметрии параллельная оси OY. плоскость перпендикулярная оси ОZ или ось симметрии параллельная оси OZ. 4.тригональная (с 75..99) тетрагональная (с 100..167) гексагональная (с 168..194) главная ось; плоскость перпендикулярная главной оси; плоскость параллельная главной оси; диагональные плоскости. 5.кубическая (с 195..230) координатные плоскости симметрии (оси); ось третьего порядка; диагональные элементы симметрии. Pm3m Im3m Пояснение:
Распределение пространственных групп по классам симметрии, сингониям и категориям.
Группа высшей симметрии в данной сингонии называется голоэдрической. Лекция 8 Основы кристаллохимии. Под радиусами атомов и ионов, входящих в кристаллическую структуру, следует понимать размер сфер их действия. При этом размер ионных радиусов подчиняется следующим правилам:
Li Na K Rb Cs радиус катиона
rкат Fe Fe2+ Fe3+
Эффективный радиус иона зависит от атомного номера элемента и степени его ионизации. Существует лантанидное и актинидное сжатие. GaAs rAs>rGa; Ga будет занимать место внутри пустот. Объемные характеристики кристаллического материала
Число атомов, принадлежащих элементарной ячейке, подсчитывается с учетом доли принадлежности каждого атома данной элементарной ячейке. Структура ГЦК ( 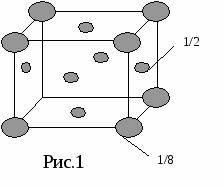 Ag, Au, Pt, Cu, Al, Ir) Ag, Au, Pt, Cu, Al, Ir)Данной ячейке принадлежит 4 атома. Это элементарная ячейка, в которой атомы расположены наиболее плотно, так как, чем больше атомов, тем упаковка плотнее. Решетка ОЦК менее плотно упакована. Если атомы разного сорта, то говорят о числе не атомов, а структурных единиц.
Э 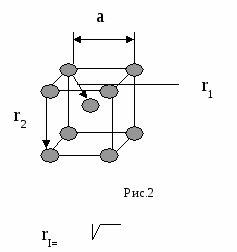 то число ближайших однотипных соседей, окружающих данный атом. то число ближайших однотипных соседей, окружающих данный атом.Решетка ОЦК rI — ближайшее расстояние между атомами, первая координационная сфера. rII — вторая координационная сфера. В данном случае, координационное число К8, где К — вид кристалла (кубический), а 8 — координациционное число. (а 3 )/2 r2=а
Характеризуется коэффициентом заполнения пространства. = Vат/ Vяч = (4/3*r3*nат)/ Vяч Vат — объем, который занимают атомы. Vяч — объем элементарной ячейки. r — радиус атомов. куба 0,52 Пример П  К — примитивная кубическая ячейка. К — примитивная кубическая ячейка.а а=2r =(4/3*r3)/ 8r3=/60,52, то есть, 52 % объема заполнено атомами. В решетке ГЦК (кубической гранецентрированной) и ГПУ (гексагональной плотно упакованной, например, Zn, Mg) =0,72 Чем больше атомов в элементарной ячейке, тем больше , тем выше координационное число, тем более плотная кристаллическая структура. Примеры
nат (hkl) S(hkl) n — число атомов плоскости S — площадь плоскости Пример:у алмаза (октаэдр) 8 плоскостей {111}, они наиболее плотно упакованы. Для нахождения плоскости с наибольшей плотностью берут плоскости с малыми индексами, например (100), (110), (111) и сравнивают их ретикулярные плотности. Пример Р 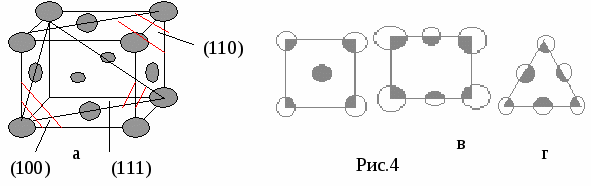 ешетка ГЦК ешетка ГЦКб На рисунке 4б изображена плоскость (100), квадрат со стороной а, площадью а2, принадлежность плоскости атомов в узлах — ¼, в центре — 1. d*(100) = (4*1/4+1)/a2=2/a2 Н   а рисунке 4в изображена плоскость (110), прямоугольник со сторонами а и а2 площадью а22, принадлежность плоскости атомов в узлах — ¼, в серединах сторон — ½. а рисунке 4в изображена плоскость (110), прямоугольник со сторонами а и а2 площадью а22, принадлежность плоскости атомов в узлах — ¼, в серединах сторон — ½.d   *(110) = (4*1/4+2*1/2)/a22=2/a22 *(110) = (4*1/4+2*1/2)/a22=2/a22Н   а рисунке 4г изображена плоскость (111), треугольник со стороной а22, площадью (а23)/2, принадлежность плоскости атомов в узлах — 1/6, в серединах сторон — ½. а рисунке 4г изображена плоскость (111), треугольник со стороной а22, площадью (а23)/2, принадлежность плоскости атомов в узлах — 1/6, в серединах сторон — ½.d   *(111) = ((3*1/6+3*1/2)*2)/a23=4/a23 *(111) = ((3*1/6+3*1/2)*2)/a23=4/a23Самая большая ретикулярная плотность у последней плоскости, она наиболее плотно упакована. Р d*[uvw]= етикулярная плотность атомов данного направления nат [uvw] L[uvw] n — число атомов направления L — длина направления Пример Решетка ОЦК А 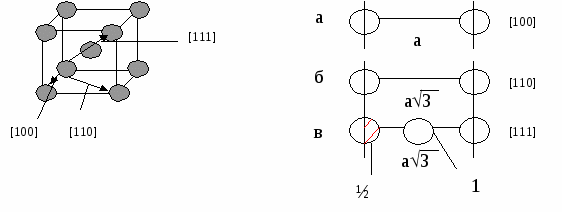 налогично выбираем направления [100], [110], [111]. налогично выбираем направления [100], [110], [111].а Рис.5 По аналогии из этих трех направлений наиболее плотно упакованное последнее. Разность плотности упаковки вдоль плоскостей и направлений обуславливает анизотропию кристалла. Структурный тип объединяет различные химические элементы и их соединения с одинаковым расположением атомов в пространстве и обычно носит название наиболее известного химического элемента. Пример ГЦК — структурный тип меди. ОЦК — структурный тип вольфрама. ГПУ — структурный тип магния. Факторы, влияющие на кристаллическую структуру
Понятие о плотнейших упаковках Плотнейшая упаковка — максимальное сближение структурных единиц. 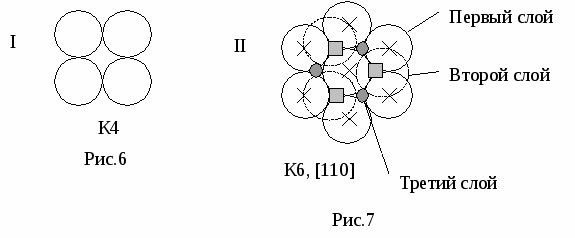 Первые 2 слоя образуют плотнейшую упаковку АВ, если добавить третий слой — АВС, четвертый слой повторяет первый и так далее. Получается мотив …АВСАВС… Это мотив чередования слоев для ГЦК плотнейшей упаковки (=0,74, К12). Для ГПУ …АВАВ…(=0,74, Г12) Лекция 9 Отличия плотнейших упаковак.
ГПЦ – ось 6 порядка (L6) ГЦК – 4L3 Общее плотнейших упаковок:
Т 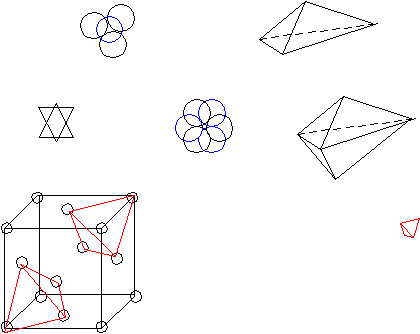 етраэдрическая пустота образуется, когда в плоскости 3 атома. етраэдрическая пустота образуется, когда в плоскости 3 атома.Октаэдррическая пустота: ГЦК – плотнейшая упаковка. n=4; 8 тетраэдрических пустот ( ) 4 октаэдрические пустоты. (1/4,1/4,1/4) ( 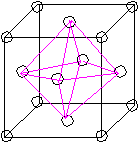 3/4,3/4,3/4) 3/4,3/4,3/4)Центр тетраэдрической пустоты находится на ¼ пространственной диагонали <111> от узла 8 вершин => 8 тетраэдрических пустот. 12 ребер * ¼ + 1(целая внутри)= 4  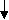 на каждом ребре находится ¼ окраэдрической пустоты. П  осчитаем атомы какого размера могут занимать пустоты. осчитаем атомы какого размера могут занимать пустоты.ГЦК а2 (100) а2=4R <110> a=2R+2r Для ГЦК наиболее плотно упакованное направление <100> r=0,41R – максимальное соотношение радиусов. Тетраэдрическая пустота: r=0,225R. Г 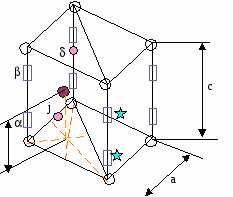 ПУ – плотнейшая упаковка. (не решетка Бравэ). ПУ – плотнейшая упаковка. (не решетка Бравэ).Рассмотрим ромбическую призму. ca с/2  Д  елим ромбическую призму на 2 тригональные призмы. Из цетра нажнего основания одной тригональной призмы (из точки пересечения медиан, биссектрис) восстанавливаем ось Z; на с/2 находится атом ( ) елим ромбическую призму на 2 тригональные призмы. Из цетра нажнего основания одной тригональной призмы (из точки пересечения медиан, биссектрис) восстанавливаем ось Z; на с/2 находится атом ( )рядом тригональная призма пустая. Такую структуру имеют CdSe (кадмий-селен) – загрязнены, т. к. есть место для диффундирования. Различают 4 типа тетраэдрических пустот:  j j пустоты имеют координаты |[0,0,3/8]| пустоты имеют координаты |[0,0,5/8]| j пустоты имеют координаты |[2/3,1/3,1/8]| пустоты имеют координаты |[2/3,1/3,7/8]| Суммарное количество пустот :4, т. к.  4*1/3 + 4*1/6 +2(целиком)=4 пустоты 4*1/3 + 4*1/6 +2(целиком)=4 пустотывырезается угол в 1200 Ч  исло атомов, приходящихся на эту упаковку n=2. исло атомов, приходящихся на эту упаковку n=2.
Ч  ередование слоев может быть и другим. Слои будут укладываться также, но чередование АВАСАВАС ередование слоев может быть и другим. Слои будут укладываться также, но чередование АВАСАВАСчетырехслойная плотнейшая упаковка Типичные структуры материалов используемых в микроэлектронике. Рассматриваться будут кристаллы, относящиеся к кубическим и гексагональным сингониям. П 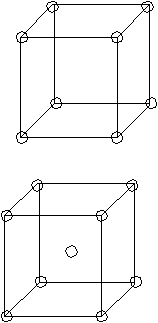 К - -Ро(полоний) –полиморфизм (состоит в разных кристаллических состояниях). К - -Ро(полоний) –полиморфизм (состоит в разных кристаллических состояниях).n=1 K6 =0,52 Наиболее плотно упакованная плоскость {100} Наиболее плотно упакованное направление <100> ОЦК W – вольфрам, молибден,Na,K,Li. -Fe хром, ванадий. n=2; =0,68 К8 <111> {110} Чем больше атомов приходится на элементарную ячейку, тем более пластичен материал (хорошая тепло- и электропроводность, ковкость). Г 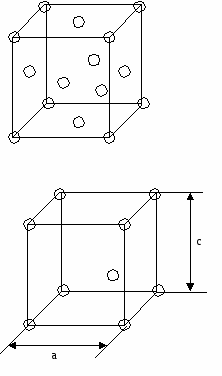 ЦК Cu Au;Ag;Pd;Al;Pt. ЦК Cu Au;Ag;Pd;Al;Pt.n=4 {111} K12 <110> =0,74 Структурный тип магния. Mg; Zn; -Cu; Be. c/a=1,633(соотношение близко к идеальному) Для Zn: с/а=1,86. Имеют более низкую симметрию, чем кристаллы кубической сингонии. Ярко выражены анизотропные свойства. L  6 – логарифмическое направление. 6 – логарифмическое направление.{0001} _ _ _ <1120> или <2110> Типичные структуры полупроводниковых материалов. Описать структуры полупроводниковых материалов можно 4-мя способами:
Базис - …
Лекция 10 Структурный тип алмаза Структурным типом алмаза обладают такие модификации углерода как Si, Ge, -Sn. Описание структурного типа алмаза
Плотнейшая упаковка типа ГЦК, образованная атомами углерода, в половине тетраэдрических пустот которой находятся также атомы углерода.
Рис 1
Тип решетки Бравэ — ГЦК; одна подрешетка образована атомами углерода С с координатами [000]; вторая — атомами углерода в центре тетраэдрических пустот с координатами [ ¼ , ¼, ¼ ].
Одна ГЦК решетка , состоящая из атомов углерода, проникает во вторую ГЦК решетку, состоящую из атомов углерода, и смещена относительно нее на ¼ в направлении <111>. ГЦКсГЦКс ¼ <111> Основные кристаллохимические характеристики
Рис.2
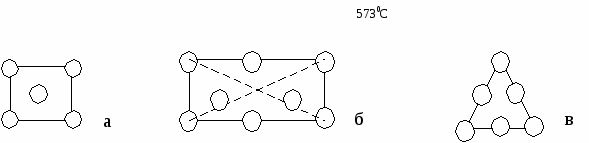
{100} {110} {111} По расчетам, наиболее плотно упакованы плоскости {110} Р 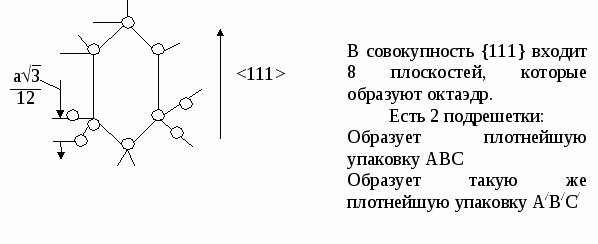 еально: {111} еально: {111}Причины Рис.4 П  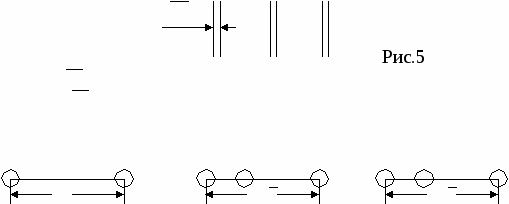 олучается чередование АА/ВВ/СС/. За счет того, что атомные плоскости из совокупностей {111} двух подрешеток находятся на расстоянии (а3)/12 и оно мало за счет малости а , то ретикулярная плотность плоскости {111} фактически удваивается. олучается чередование АА/ВВ/СС/. За счет того, что атомные плоскости из совокупностей {111} двух подрешеток находятся на расстоянии (а3)/12 и оно мало за счет малости а , то ретикулярная плотность плоскости {111} фактически удваивается.(а3)/12 А А/ В В/ С С/ {110}=4/(а2 2) {111}=(4/(а2 3))*2
<100> <110> <111> а а2 а3 а б в Рис.6 Наиболее плотно упакованные направления <110>. Вывод: наиболее плотно упакованные направления <110> и плоскости{111}. По ним происходит деформация скольжения, они образуют систему скольжения материала. Полупроводниковые соединения AIIIBV; AIIBVI; AIVBVI
Табл.1 AIIIBV: соединения Al, Ga, In с P, As, Sb. Они образуют ряды катионного и анионного замещения. A  l P l PG   a As a AsIn Sb катионное анионное (фосфиты) (фосфит, арсенид, антимонид) У  этих соединений разные электрофизические характеристики, но есть одно общее — структура сфалерит. этих соединений разные электрофизические характеристики, но есть одно общее — структура сфалерит.ZnS сфалерит вюрцит (кубический) (гексагональный) При разных температуре и давлении может возникать либо кубическая, либо гексагональная модификация. AIIIBV — сфалерит. Описание ZnS (для AIIIBV аналогично)
Плотнейшая упаковка типа ГЦК, образованная атомами серы, в половине тетраэдрических пустот которой находятся также атомы цинка.
Рис 7
ГЦК S [000] ГЦК Zn [ ¼ , ¼, ¼ ].
ГЦКZnГЦКS ¼ <111> Основные кристаллохимические характеристики
S Zn В одной элементарной ячейке содержится 4 формульные единицы (4(S):4(Zn)).
K Совпадение произошло из-за стехиометрического соотношения 1:1 Zn по Zn12 K Zn по S 4 K S по S 12 K S по Zn 4
{100} {110} {111} Рис.8 По расчетам, наиболее плотно упакованы плоскости {110} Реально: {111} Причины те же 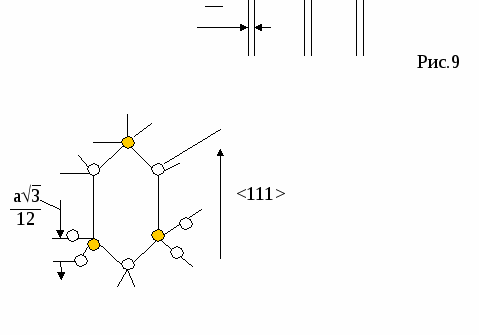 (а3)/12 А А/ В В/ С С/ AВС — S A/B/C/ — Zn Zn S Рис.10
<100> <110> <111> а а2 а3 а б в Рис.11 Вывод: наиболее плотно упакованные направления <110> и плоскости{111}. Лекция 11 Вюрцит – это -модификация ZnS. Такую структуру имеют: AIIBVI AIVBVI Появляется аксиальная симметрия: П 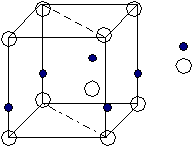 лотнейшая упаковка типа ГПУ образована атомами S, половина тетраэдрических пустот которых заполнены атомами Zn (заполняются и j пустоты). лотнейшая упаковка типа ГПУ образована атомами S, половина тетраэдрических пустот которых заполнены атомами Zn (заполняются и j пустоты).Из их пустот заполнены две пустоты. - Zn - S гегсагональная ГПУZn ГПУS смещена на 1/3 по направлению <0001> Ч  исло атомов в элементарной ячейке подсчитывается соответствующим образом: исло атомов в элементарной ячейке подсчитывается соответствующим образом:n= 4*1/12 + 1*1/6 + 1 + 2*1/6 +2*1/3 +1 =4 2S 2Zn Две формульные единицы. Упаковка атомами плоскостей: Н 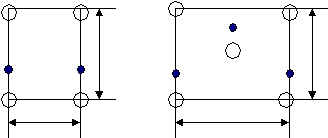 аиболее плотно упакованное направление – любое ребро. (<0001>) аиболее плотно упакованное направление – любое ребро. (<0001>)_ _ (1010) (1120) c c a a3 a=bc Структурный тип поваренной соли (NaCl). Кристаллизуются полупроводниковые соединения AIIBVI и AIVBVI в зависимости от температуры и давления свойства меняются. Здесь тип плотнейшей упаковки – ГЦК, образуется атомами Cl во всех октаэдрических пустотах – атомы Na. 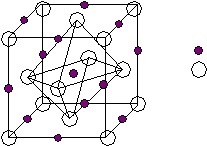 - Na - Cl Тип решетки: ГЦК Cl|[0,0,0]| ГЦК Na|[1/2,0,0]| Взаимо проникающие подрешетки: ГЦКNaГЦКCl*1/2<100> Ч  исло структурных единиц: исло структурных единиц:n= 8*1/8 + 6*1/2 + 12*1/4 +1 = 8 структурных единиц принадлежит данной ячейки. (или 4 формульные) 4Cl 4Na Координационные числа: КNa по Cl 6 КNa по Na 12 КCl по Na 6 КCl по Cl 12 Упаковка атомами плоскостей: Н 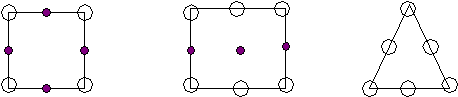 аиболее упакованная плоскость – грани. аиболее упакованная плоскость – грани.(100) (110) (111) d*(100) – max – ретикулярная плотность максимальна. И такое же направление. Флюрит (полевой сипат) CaF2 – используется для некоторых оптических изделий. В терминах плотнейших упаковок элементарная ячейка ГЦК образованна атомами Ca, но во всех тетраэдрических пустотах которой находятся атомы F. 8 тетраэдрических пустот. 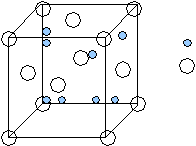 - Ca - F Здесь три подрешетки: 1-ая из атомов Ca 2-ая из атомов F 2-я из атомов F смещена на ¾ ГЦК Ca |[0,0,0]| ГЦК F |[1/4,1/4,1/4]| ГЦК F |[3/4,3/4,3/4]| ГЦКCaГЦКFГЦКF на ¼, ¾ <111> Число структурных единиц: n  = 8*1/8 + 6*1/2 + 8 = 12 = 8*1/8 + 6*1/2 + 8 = 12 Са F Са FКоординационные числа: КCa по F 8 КCa по Ca 12 КF по Ca 4 КF по F 12 Наиболее плотно упакованные плоскости и направления: 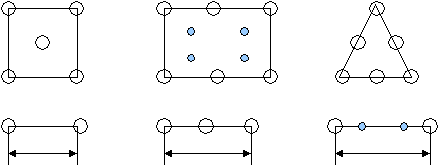 (100) (110) (111) (100) (110) (111)[100] [110] [111] а а2 а3 Структура цезий хлор (СsCl). ( 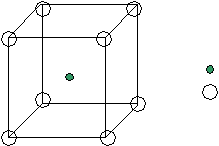 нет плотнейшей упаковки) нет плотнейшей упаковки)- Zs - Cl Решетка Бравэ – примитивная, структура состоит из двух примитивных решеток. ПКCsПКCl ½ <111> Структурный тип халькопирита (CuFeS2) (или двойной сфалерит) АIIВIVСV2 C 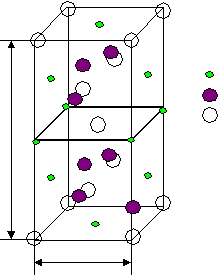 dSnAs2 dSnAs2- Fe - Cu - S c Cu и Fe совместно в соотношении 1:1 образуют две ГЦК, в половине тетраэдрических пустот находятся атомы серы. Каждый атом серы окружен тетраэдрически двумя атомами железа и двумя меди. a Элементарная ячейка – тетрагональная. При этом параметр с=2а; 0 а=3,24 А 0 с=10,3А Ч  исло структурных единиц: исло структурных единиц:n= 8*1/8+1 + 4*1/2 + 8 + 4*1/4 +6*1/2 = 16 4 формульные единицы 4Сu 8S 4Fe Лекция 12 Структурный тип перовскита Формула: CaTiO3 К этому структурному типу относятся диэлектрические фазы, обладающие в определенном интервале температур спонтанной самопроизвольной электрической поляризацией. Соединения, изоморфные данному: BaTiO3 PbTiO3 и др. I 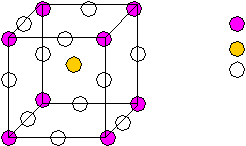 . .
Рис.1 Ч  исло структурных единиц: исло структурных единиц:n= 8*1/8+1+12*1/4=5 1 формульная единица. Ti Ca O O вместе с Ca образует плотнейшую упаковку ГЦК, в одной октоэдрической пустоте которой находится 1 атом Ti (все тетраэдрические пустоты свободны). I 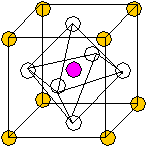 I. К O по Ca = К Ca по O=12 I. К O по Ca = К Ca по O=12К Ti по O =6 Рис.2 Элементарная ячейка — примитивная. Кристаллическая структура SiO2. В зависимости от температуры и давления может кристаллизоваться в разные кристаллические структуры, но все они построены из кремниево-кислородных тетраэдров, которые по-разному ориентированы в пространстве. Пример: 1.При 14700С и нормальном давлении — кристобалит.  2.Тригональная модификация с осью третьего порядка (- кварц). 2.Тригональная модификация с осью третьего порядка (- кварц).
Рис.3 2 соседних тетраэдра сопрягаются вершинами. С 5730С пленочные 14700С 17050С хема перехода основных модификаций. -кварц кварц тридимит кристобалит расплав. Существуют промежуточные модификации. В  кварце тетраэдры завиваются по спирали вокруг оси третьего порядка (рис.4). кварце тетраэдры завиваются по спирали вокруг оси третьего порядка (рис.4).m 3 Рис.4 Рис.5 В тридимите происходит отражение тетраэдров относительно плоскости (зеркальное расположение) (рис.5). В кристобалите происходит отражение (инверсионное) тетраэдров относительно точки (инверсионное расположение) (рис.6).  С Рис.6 -кварц — пъезоэлектрик. Расплав используется в микроэлектронике в качестве контейнерного материала. -кварц: тригональная структура, устойчив при t<5730C. O-Si тетраэдры расположены в структуре на трех уровнях вследствие действия винтовых осей третьего порядка. -кварц: гексагональная структура, атомы Si также находятся на трех уровнях (0, 1/3 С, 2/3 С), но кроме осей третьего порядка действуют оси шестого порядка, при этом различие между структурами и кварца основаны на незначительном смещении атомов Si в плоскостях, перпендикулярных вертикальной оси. -тридимит: существует в интервале 8700С14700С, структура гексагональная, атомы Si находятся в таком же положении, как и атомы Zn и S в вюрците. Атомы О расположены на середине расстояния Si- Si. -кристобалит: кубическая структура, существует в интервале 14700С t пл. Атомы Si находятся в тех же положениях, что и атомы С в структуре алмаза. На половине расстояния Si- Si находятся атомы О. Кристаллическая структура Al2O3. Еще ее называют - Al2O3 или лейкосапфир. Используется как материал для изготовления подложек в полупроводниковых технологиях. Модификация безводна, чистые кристаллы прозрачны и бесцветны. Если атомы Al замещаются атомами Cr, то цвет становится малиновым, получается рубин, который используется для изготовления лазеров. Если атомы Al замещаются атомами Ti, то цвет становится синим, получается сапфир, атомы Al замещаются атомами Fe, то цвет становится желтым. Это ромбоэдрически деформированная структура поваренной соли, где позиции ионов Na и Cl замещены группой Al2О3. Двухвалентные ионы кислорода образуют приблизительно плотнейшую гексагональную упаковку с мотивом чередования слоев АВАВ, а ионы Al симметрияно заполняют 2/3 октоэдрических пустот. Это сложная структура, ей присущи винтовые оси, повторение структуры происходит через 6 слоев ионов О с шестью промежуточными слоями Al. К Al по O =6 Лекция 13 Полиморфизм, изоморфизм и политипия. Полиморфизм это способность элемента или химического соединения существовать в разных кристаллических формах, отличающихся по симметрии структуры и свойствам. Аллотропия – сера моноклинная и сера ромбическая. Термин “полиморфия” относится к химическим элементам. При этом каждая полиморфная модификация является устойчивой фазой в соответствующих физико-химических условиях. Переход из одной модификации в другую осуществляется при определенном соотношение между давлением и температурой. Количество тепла, поглощаемое или выделяемое в результате полиморфного превращения, отнесенного к единице массы называется теплотой полиморфного поглощения. При это процесс полиморфного превращения из одной полиморной модификации в другую называется: энантиотропный, если процесс обратимый; монопропный, если процесс необратимый. Пример:    алмаз графит (процесс монотропный) алмаз графит (процесс монотропный) |


 нутри одного вертикального ряда периодической системы радиус ионов с одинаковым зарядом увеличивается с увеличением атомного номера.
нутри одного вертикального ряда периодической системы радиус ионов с одинаковым зарядом увеличивается с увеличением атомного номера. рафически
рафически
 етикулярные плотности
етикулярные плотности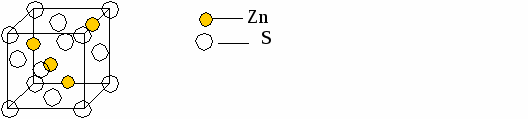 рафически
рафически анной ячейке принадлежит n=8*1/8+6*1/2+4=8 структурных единиц.
анной ячейке принадлежит n=8*1/8+6*1/2+4=8 структурных единиц.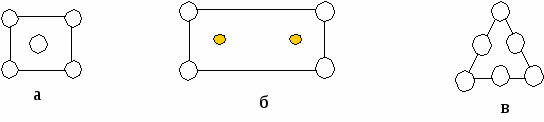 лоскостей
лоскостей аправлений
аправлений