Кристаллогра́фия — наука о кристаллах, их структуре, возникновении и свойствах. Она тесно связана с минералогией, физикой твёрдых тел и химией. Исторически кристаллография возникла в рамках минералогии, как наука, описывающая идеальные кристаллы.
Аморфные вещества
Главный признак аморфного (от греческого "аморфос" - бесформенный) состояние вещества - отсутствие атомной или молекулярной решетки, то есть трехмерной периодичности структуры, характерной для кристаллического состояния.
При охлаждении жидкого вещества не всегда происходит его кристаллизация. при определенных условиях может образоваться неравновесное твердое аморфное (стеклообразное) состояние. В стеклообразном состоянии могут находиться простые вещества (углерод, фосфор мышьяк, сера, селен), оксиды (например, бора, кремния, фосфора), галогениды, халькогениды, многие органические полимеры.
В этом состоянии вещество может быть устойчиво в течение длительного промежутка времени, например, возраст некоторых вулканических стекол исчисляется миллионами лет. Физические и химические свойства вещества в стеклообразном аморфном состоянии могут существенно отличаться от свойств кристаллического вещества. Например, стеклообразный диоксид германия химически более активен, чем кристаллический. Различия в свойствах жидкого и твердого аморфного состояния определятся характером теплового движения частиц: в аморфном состоянии частицы способны лишь к колебательным и вращательным движениям, но не могут перемещаться в толще вещества.
Существуют вещества, которые в твердом виде могут находиться только в аморфном состоянии. Это относится к полимерам с нерегулярной последовательностью звеньев.
Аморфные тела изотропны, то есть их механические, оптические, электрические и другие свойства не зависят от направления. У аморфных тел нет фиксированной температуры плавления: плавление происходит в некотором температурном интервале. Переход аморфного вещества из твердого состояния в жидкое не сопровождается скачкообразным изменением свойств. Физическая модель аморфного состояния до сих пор не создана.
Кристаллические вещества
Твердые кристаллы - трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз.
Геометрически правильная форма кристаллов обусловлена, прежде всего, их строго закономерным внутренним строением. Если вместо атомов, ионов или молекул в кристалле изобразить точки как центры тяжести этих частиц, то получится трехмерное регулярное распределение таких точек, называемое кристаллической решеткой. Сами точки называют узлами кристаллической решетки.
2/ Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с элементами симметрии.
Элементарная ячейка — в кристаллической решётки, минимальная ячейка, отвечающая единичной решёточной точке структуры с трансляционной симметрией в 2D, 3D или других размерностях. Фактически это минимальный воображаемый объём кристалла, параллельные переносы (трансляции) которого в трёх измерениях позволяют построить трёхмерную кристаллическую решётку в целом.
Низшая категория (все трансляции не равны друг другу)
Триклинная: 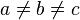 , , 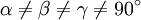
Моноклинная: 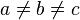 , , 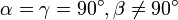
Ромбическая: 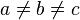 , , 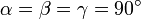
Средняя категория (две трансляции из трёх равны между собой)
Тетрагональная: 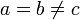 , , 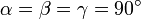
Гексагональная: 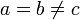 , , 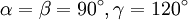
Высшая категория (все трансляции равны между собой)
Кубическая: 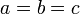 , , 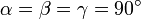
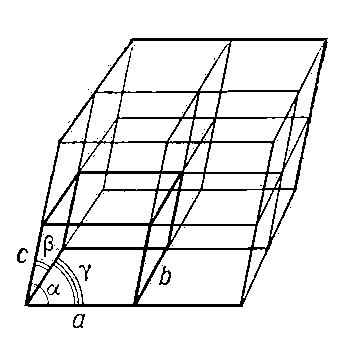
3)Элементы симметрииКлассификация по группам симметрии основана на существовании или отсутствии определенных элементов симметрии, а именно простых осей, зеркально-поворотных осей, центров или плоскостей симметрии.
Осью симметрии n-го порядка называется ось, проходящая через молекулу таким образом, что при повороте вокруг нее на угол, равный 360°/n, молекула возвращается в положение, не отличимое от исходного. В качестве примера можно привести равносторонний треугольник, который имеет ось третьего порядка, проходящую через его центр перпендикулярно плоскости треугольника, n может принимать любые целые положительные значения (например, 8 для правильного восьмиугольника) или быть неопределенным (например, для круга).
Плоскостью симметрии называется плоскость, проходящая через молекулу таким образом, что половина молекулы по одну сторону от плоскости представляет собой зеркальное изображение другой (плоскость симметрии играет роль зеркала). Так, для книги плоскость, проходящая посредине между двумя обложками и разрезающая корешок переплета пополам, будет плоскостью симметрии (если пренебречь текстом).
Центром симметрии называется точка внутри предмета, характеризующаяся тем, что проведенная через нее прямая от любого элемента при продолжении на равное расстояние от этой точки встречает идентичный элемент. Так, центр шара является центром симметрии.
Направления В Кристаллах Единичные — единственные, не повторяющиеся направления, напр. ось шестого порядка в гекс. к-лах. В низших синг. их множество (в трикл. и мон.) или 3 (в ромб.), единичных направлений в средних синг. — одно, совпадающее с осью высшего порядка; в куб. кристаллах они отсутствуют.
Единичным направлением в кристалле называется единственное не повторяющееся направление (например: показатель преломления). Физические свойства по единичным направлениям особенно специфичны. В кристаллах может быть одно единичное направление, три, множество единичных направлений и ни одного.
Единичное направление может совпадать с осью симметрии, может проходить по плоскости симметрии, может вмещать центр инверсии. Например, одно ед.направление может быть в средней категории и совпадать с осью высшего порядка. Три ед.напр. – в ромбической сингонии. Множество – в кристаллах триклинной и моноклинной сингонии. Любое направление будет иметь своё физическое свойство.
В кубической сингонии нет единичных направлений.
Симметрично-равными направлениями в кристалле, называются направления, связанные элементами симметрии. Физические свойства по симметрично-равным направлениям одинаковы. Единичные и симметрично-равные направления используются для вывода 32 видов симметрии.
4)
Сингони́я (от греч. σύν, «согласно, вместе, рядом», и γωνία, «угол» — дословно «сходноугольность») — классификация кристаллографических групп симметрии, кристаллов и кристаллических решёток в зависимости от системы координат (координатного репера). Группы симметрии с единой координатной системой объединяются в одну сингонию.
Кристаллические системы также разбиваются на три категории, в зависимости от числа осей высшего порядка (осей выше второго порядка).
Возможные в трехмерном пространстве кристаллические системы с определяющими их элементами симметрии, то есть элементами симметрии, наличие которых необходимо для отнесения кристалла или точечной группы к определенной кристаллической системе:
Низшая категория (нет осей высшего порядка)
Триклинная: нет симметрии или только центр инверсии 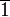
Моноклинная: одна ось 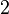 -го порядка и/или плоскость симметрии -го порядка и/или плоскость симметрии 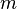
Ромбическая: три взаимно-перпендикулярных оси 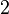 -го порядка и/или плоскости симметрии -го порядка и/или плоскости симметрии 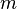 (направлением плоскости симметрии считается перпендикуляр к ней) (направлением плоскости симметрии считается перпендикуляр к ней)
Средняя категория (одна ось высшего порядка)
Тетрагональная: одна ось 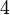 -го порядка или -го порядка или 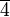
Тригональная: одна ось 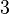 -го порядка -го порядка
Гексагональная: одна ось 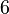 -го порядка или -го порядка или 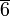
Высшая категория (несколько осей высшего порядка)
Кубическая: четыре оси 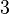 -го порядка -го порядка
5)
Простая форма- это совокупность граней кристалла одинакового размера и формы, связанная эл-тами симметрии
Комбинированная форма- совокупность простых форм.
Формы: открытые, закрытые
Открытые: не образуют замкнутого пространства со всех сторон ( призмы, пирамиды)
Замкнутые, обр замкнутое пространство(куб, октаэдр)
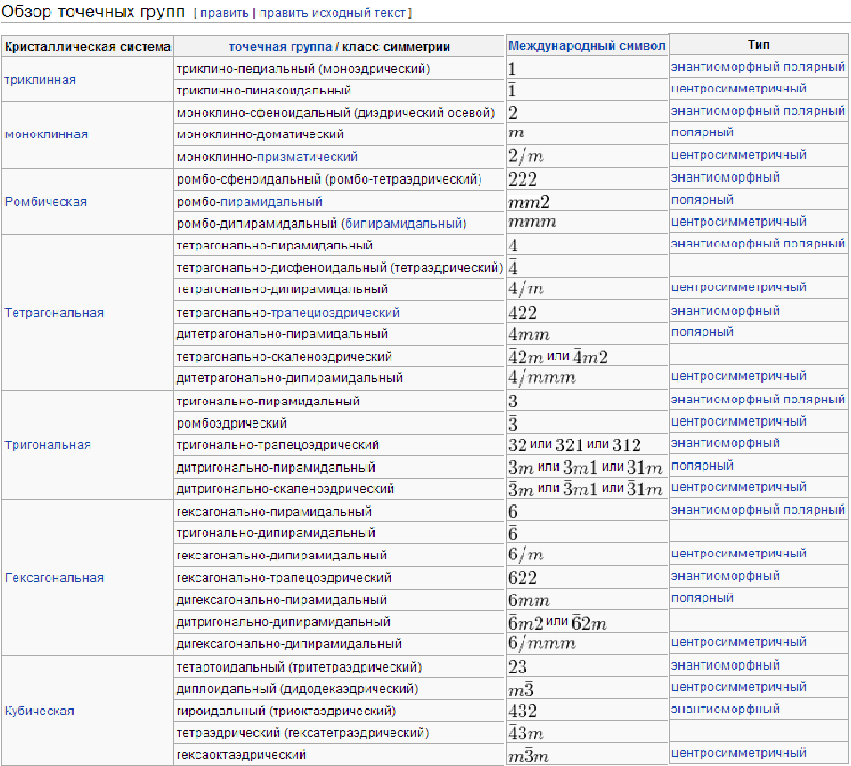
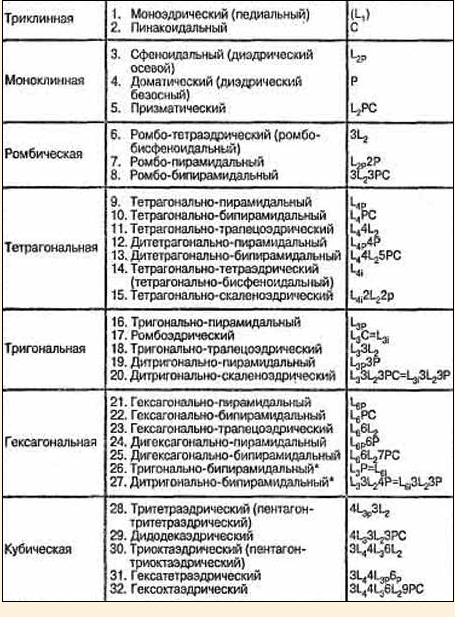
6) Вывод 32 классов симметрии
7)
Распределение эл.яч. по сингониям. Разбивка 32-х классов симметрии кристаллов на группы по признаку сходства симметрии приводит к очень важному для минералогии и кристаллографии понятию сингонии, или кристаллографической системы. Кристаллы одной сингонии объединяются одинаковой совокупностью характерных углов и наличием одного или нескольких одинаковых элементов симметрии (в частности, главной оси или набора осей одного порядка).Всего выделяют семь сингонии; в порядке повышения симметрии это триклинная, моноклинная, ромбическая, тетрагональная, тригональная и гексагональная (часто, особенно за рубежом, объединяются в одну —гексагональную), а также кубическая сингонии.
Координационное числа структурных единиц. Координационным числом называют число атомов лигандов, непосредственно присоединенных к центральному атому.(число ближайших соседей)
К.Ч=3- треугольник К.Ч=2-диэдр К.Ч=4-тэтраэдр К.Ч=6-октаэдр К.Ч=8-куб К.Ч=12-кубооктаэдр.
Координационный многогранник-если центры соседних атомов соеденить прямыми линиями получиться к.м.(диэдр, треугольник, тэтраэдр, октаэдр, куб, кубооктаэдр).
Число атомов в ячейке. Число атомов подсчитывается с целью написания стехиометрической формулы.
вершина- 1/8, ребро-1/4, грань-1/2, внутри эл. яч.-целиком.
8)Степень заполнения пространства структурными единицами- Av-степень заполнения материальными частицами эл. яч. (коэффициент компакности).
Av=(4/3пr3*z)/(Vэл.яч.)*100%
z- число материальных единиц
Типы пустот в решетках. При наложении двух плотноупакованных слоев А и В образуется 2 типа пустот: тетраэдрические к.ч=4 и октаэдрические к.ч=6
9) Размеры атомов и ионов. Эффективные и действительные размеры. Зависимость их положения в группах периодической системы. Поляризация атомов.
В группах периодической системы размеры возрастают за счет роста количества орбиталей в периодах радиус уменьшается с увеличением их зарядов, так как по мере роста числа удаленных электронов ядро с большей силой притягивает электроны. В кх принято пользоваться не орбитальным радиусами(показывают расстояние от ядра до максимума орбитальной оболочки) а эффективными радиусами(это есть сфера действия атома то есть минимальное расстояние на которое центры сфер атомов могут приблизиться к поверхности сфер соседних атомов).
Величина радиуса меняется в зависимости от поляризационной способности атомов. Поляризационная способность это способность иона под действием внешнего электростатического поля деформироваться, смещая положение ядра относительно оболочки.
10.Кристалическая структура. Молекулярные ковалентные металлические ионные кристаллы.
Кристалли́ческая структу́ра — такая совокупность атомов, в которой с каждой точкой кристаллической решётки связана определённая группа атомов, называемая мотивной единицей, причем все такие группы одинаковые по составу, строению и ориентации относительно решётки. Можно считать, что структура возникает в результате синтеза решётки и мотивной единицы, в результате размножения мотивной единицы группой трансляции.
В простейшем случае мотивная единица состоит из одного атома, например в кристаллах меди или железа. Возникающая на основе такой мотивной единицы структура геометрически весьма сходна с решёткой, но все же отличается тем, что составлена атомами, а не точками. Часто это обстоятельство не учитывают, и термины «кристаллическая решётка» и «кристаллическая структура» для таких кристаллов употребляются как синонимы, что нестрого. В тех случаях, когда мотивная единица более сложна по составу — состоит из двух или большего числа атомов, геометрического сходства решётки и структуры нет, и смешение этих понятий приводит к ошибкам. Так, например, структура магния или алмаза не совпадает геометрически с решёткой: в этих структурах мотивные единицы состоят из двух атомов.
Основными параметрами, характеризующими кристаллическую структуру, некоторые из которых взаимосвязаны, являются следующие:
тип кристаллической решётки (сингония, решётка Браве);
число формульных единиц, приходящихся на элементарную ячейку;
пространственная группа;
параметры элементарной ячейки (линейные размеры и углы);
координаты атомов в ячейке;
координационные числа всех атомов.
Типы химических связей в кристаллах. В зависимости от природы частиц и от характера сил взаимодействия различают четыре вида химической связи в кристаллах: ковалентную, ионную, металлическую и молекулярную.
Ковалентная связь
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов могут служить алмаз, германий и кремний.
|
 Скачать 474.46 Kb.
Скачать 474.46 Kb.


