Кристалка отв. Кристаллография
 Скачать 474.46 Kb. Скачать 474.46 Kb.
|
|
Полиморфи́зм криста́ллов— способность вещества существовать в различных кристаллических структурах, называемых полиморфными модификациями (их принято обозначать греческими буквами α, β, γ и т. д.) Характерен для различных классов веществ. Полиморфизм для простых веществ называют аллотропией, но понятие полиморфизма не относят к некристаллическым аллотропным формам (таким, как газообразные О2 и О3). Частный случай полиморфизма, характерный для соединений со слоистой структурой — политипи́зм (политипи́я). Такие модификации, политипы, отличаются между собой лишь порядком чередования атомных слоёв. Причины возникновения полиморфизма Полиморфизм объясняется тем, что одни и те же атомы вещества могут образовывать различные устойчивые кристаллические решётки, соответствующие минимумам на поверхности энергии Гиббса. Стабильной модификации отвечает глобальный минимум, метастабильным — локальные минимумы. При повышении температуры более прочная кристаллическая решётка низкотемпературной модификации может характеризоваться меньшей энтропией за счёт того, что она менее восприимчива к возбуждению тепловых колебаний, поэтому другая модификация, характеризующаяся более крутой зависимостью энергии Гиббса от температуры, становится более выгодной. Термодинамика и кинетика полиморфизма При заданных условиях (температура, давление и др.) одна из модификаций является термодинамически стабильной, другие — метастабильными. При изменении условий может оказаться стабильной другая модификация. Условия, при которых стабильна каждая из модификаций, изображаются на фазовой диаграмме соответствующего вещества. Переход из метастабильной модификации в стабильную, выгодный термодинамически, не всегда можно наблюдать на практике, так как он зачастую связан с кинетическими затруднениями. Примером является алмаз, полиморфная модификация углерода, которая при нормальных условиях метастабильна, но существует неограниченно долго. Это объясняется тем, что для перестройки кристаллической решётки требуется преодолеть энергетический барьер. Во многих случаях удаётся закалить высокотемпературную модификацию до комнатной температуры. Не удаётся закалить высокотемпературную фазу в случае мартенситных превращений, характеризующихся бездиффузионным переходом. Полиморфные превращения возможны не только при изменении термодинамических условий, но могут быть вызваны радиоактивным облучением (например, превращение а-кварца в Я-кварц), механическим (вюртцит сфалерит, марказит спирит и др.), в частности ударным (графит алмаз, кальцит арагонит и т.п.) воздействием. Различают Фазовые переходы первого и второго рода.Фазовые Переходы первого рода сопровождаются скачком таких термодинамических функций, Как энтропия, Объем и т. д. и, следовательно, Скрытой теплотой перехода. Кристаллическая Структура при этом изменяется скачком(например, сфалерит-вюртцит). При Фазовых переходах второго рода скачок испытывают производные термодинамических функций, (например, Скачком изменяется теплоемкость, Сжимаемость и др.). Кристаллическая Структура изменяется непрерывно (например, В β-Латуни CuZn при Tc=480° C Имеет место фазовый переход второго рода: Наблюдается переход из СТ Α -Fe В СТ С sCl). Как для фазовых переходов первого, Так и второго рода симметрия кристалла меняется скачком в точке фазового перехода. При фазовых переходах второго рода симметрия одной из фаз является подгруппой симметриидругой фазы. При Фазовых переходах первого рода симметрия кристалла в общем случае может изменяться произвольно, И обе фазы могут не иметь общих элементов симметрии. Примером Фазового превращения второго рода могут служить ферромагнитные переходы, а также изменение степени упорядоченности в сплавах, т.е. Типа порядок-беспорядок. 16) Ионные кристаллы. Координационные принципы строения ионных кристаллов. Зависимость между видом координационного полиэдра (координационным числом) и отношением радиуса катиона (rk) к радиусу аниона (ra). Правило Магнуса-Гольдшмидта.
Ионные кристаллы образуются ионной связью. Ионная связь это электростатическая связь между катионами и анионами. Ионная связь малонаправленная и ненасыщаемая. Основные свойства: характерны диэлектрические свойства, вещества хрупкие, обладают низкой электро- и теплопроводимостью. Энергия связи ионных структур в пределах 120-180 ккалл/моль. Ионы с заполненными валентными оболочками обладают сферической симметрией. Кулоновские силы между ионами (ионная связь) с большой степенью приближения можно считать центральными силами. Однако отличие случая ионной связи от задачи о плотных шаровых упаковках заключается в том, что ионы имеют различные ионные радиусы ( Правила Магнуса - Гольдшмидта - КЧ катиона определяется тем отношением его радиуса к радиусу аниона, при котором наступает соприкосновение между собой и «расталкивание» соседних анионов. 17) Реальные кристаллы. Дефекты кристаллической решетки (точечные, дислокации). Реальные кристаллы всегда содержат различные дефекты внутренней структуры решетки, искажения и неровности на гранях и имеет пониженную симметрию многогранника вследствие специфики условий роста, неоднородности питающей среды, повреждений и деформаций. Реальный кристалл не обязательно обладает кристаллографическими гранями и правильной формой, но у него сохраняется главное свойство — закономерное положение атомов в кристаллической решётке. Дефект кристаллической решетки - отклонение кристаллической решетки от ее идеального периодического строения. Дефекты оказывают существенное влияние на физические свойства кристаллов. Различают точечные дефекты (вакансии) ; линейные дефекты (дислокации) ; и объемные дефекты: трещины, поры, раковины и т. д. Дислокация - в кристаллах - линейный дефект кристаллической решетки, представляющий собой нарушение правильного чередования атомных плоскостей. Вакансия - в кристаллах - отсутствие атома или иона в узле кристаллической решетки. Вакансии находятся в термодинамическом равновесии с кристаллической решеткой, они возникают и исчезают в результате теплового движения атомов. 18) Плотнейшие упаковки. Чем больше к.ч. тем больше плотность упаковки. В идеале плотнейшими упаковками обладают металлические и и ионные структуры. В плоском слое шаров, плотнейшим образом прилегающих друг к другу, каждый шар соприкасается с шестью шарами и окружен шестью лунками (пустотами), а каждая из лунок — тремя шарами. Такое расположение атомов характерно для плоскостей {111} гранецентрированной кубической структуры и плоскости базиса (0001) гексагональной плотноупакованной структуры. При наложении второго слоя таким образом, чтобы над лункой первого слоя находился шар второго слоя, можно выделить два типа пустот, различающихся по координационному окружению: - над лункой первого слоя находится шар второго слоя — тетраэдрическая пустота — Т; - пустота второго слоя находится над пустотой первого слоя — октаэдрическая пустота — О. Число пустот О равно числу шаров, а число пустот Т вдвое больше. Если шары третьего слоя уложены в лунки Т, то третий слой повторяет укладку первого. Обозначив первый слой А, а второй В, получаем упаковку: ….АВАВАВ… Если шары третьего слоя уложены в лунки О, то третий слой не повторяет первый слой, и получаем упаковку: ….АВСАВС…. Дальнейшие слои можно укладывать, получая любое чередование слоев, но плотнейшей упаковкой оказываются только две: - двухслойная ….АВАВАВ… и - трехслойная …..АВСАВСАВС….. Коэффициент компактности структуры определяется отношением объема шаров к общему объему (шары +пустоты). В обеих этих упаковках коэффициент компактности максимален и равен К=0,74. У всех остальных структур коэффициент компактности меньше. Координационное число 12 — обязательный признак плотнейшей упаковки. Для шаров кубической упаковки координационный полиэдр (многогранник) – кубооктаэдр, а для гексагональной — гексагональный кубооктаэдр. Двухслойная гексагональная плотная упаковка или ГПУ, соответствующая чередованию слоев ABAB... очень распространена. Она характерна для Be, Mg, Zn, Ti. Набор слоев шаров типа …ABCABC... представляет собой кубическую плотную упаковку (КПУ) атомов в структуре золота. Благородные металлы Ag, Au, Pt, a также Cu, Al, Pb, -Fe характеризуются трёхслойной — кубической плотнейшей упаковкой атомов. Атомы в ней лежат в вершинах куба и центрах его граней: поэтому ее часто называют гранецентрированной кубической или ГЦК. ГЦК структуру имеют многие простые металлы. Третий распространенный тип кристаллической структуры называется объемно-центрированный кубический или ОЦК. Атомы в такой структуре занимают вершины и центр куба. ОЦК-структура немного менее плотно упакована, чем ГЦК или ГПУ и часто это высокотемпературная форма металлов, которые более плотно упакованы при низких температурах. К примеру, структура железа (Fe) может быть либо ГЦК либо ОЦК в зависимости от температуры, тогда как металлы, такие как хром, всегда имеют ОЦК-структуру. Коэффициент компактности для ОЦК равен К =0,68. Все пустоты ОЦК — тетраэдрические. Плотные упаковки характерны для структур с ненаправленными связями. Существуют упаковки четырехслойные, пятислойные и т. п. Четырехслойная упаковка характерна для редкоземельных металлов La, Ce и др. Известны структуры с многослойной упаковкой, состоящей из десятков и сотен слоев (политипия Весьма часто полиморфизм ) (уже не только чистых металлов, но и соединений с простейшей формулой АХ) сводится к смене многослойных плотнейших упаковок (6-, 8-, 15-слойных) вплоть до числа слоев в несколько десятков, как например, в карбиде кремния SiC. Формирование типа упаковки определяется силами дальнодействия между атомами. Структуры многих неорганических (ионных) кристаллов представляют собой плотнейшие упаковки шаровых анионов (с большими ионными радиусами), в пустотах которых распределяются мелкие катионы. 19 вопрос. Пространственные решётки Браве. Вид пространственных решёток (См. Пространственная решётка) кристаллов, установленный впервые французским учёным О. Браве в 1848.Браве высказал гипотезу о том, что пространственные решётки кристаллов построены из закономерно расположенных в пространстве точек — узлов (где расположены атомы), которые могут быть получены в результате повторения данной точки путём параллельных переносов (трансляций (См. Трансляция)) (рис. 1).Проведением прямых линий и плоскостей через эти точки пространственная решётка разбивается на равные параллелепипеды (ячейки). Всего существует 14 видов таких решёток, которыми в первом приближении может быть описана структура любого кристалла. Б. р. делятся на 4 типа (см. рис. 2): 1) примитивный — узлы расположены только в вершинах параллелепипеда, 2) базоцентрированный — имеется ещё по одному узлу в центрах двух противолежащих граней, 3) объёмноцентрированный — к примитивному типу добавлен узел в центре ячейки, 4) гранецентрированный — имеется по одному узлу в центре каждой грани. Б. р. распределяются по сингониям (системам) следующим образом: триклинная — 1, моноклинных — 2, тетрагональных — 2, ромбических — 4, тригональная (ромбоэдрическая) — 1, гексагональная — 1, кубических — 3. 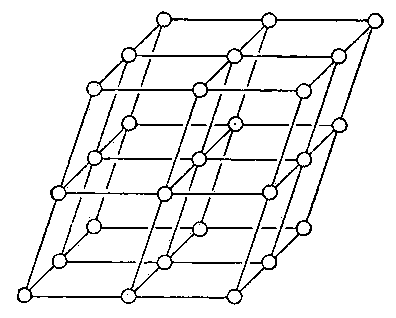 Рис. 1. Схема построения пространственной решётки кристалла путём параллельных переносов. 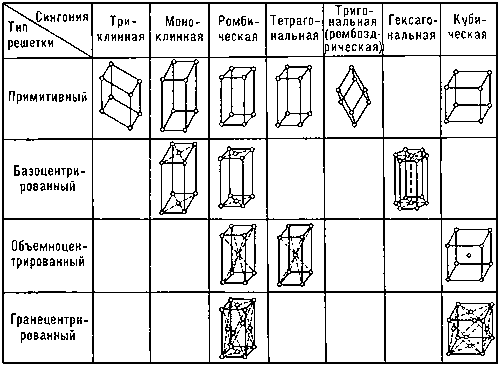 Рис. 2. Решётки Браве. Сингонии: кубическая — куб со сторонами a = b = c и углами между ними α = β = γ = 90°; тетрагональная — параллелепипед a = b ≠ c, α = β = γ = 90°; ромбическая — параллелепипед a ≠ b ≠ c, α = β = γ = 90°; тригональная (ромбоэдр — куб, вытянутый вдоль пространственной диагонали) a = b = c, α = β = γ ≠ 90°; гексагональная — состоит из трех призм с основанием в форме ромба a = b ≠ c, α = β = 90°, γ = 120°; моноклинная — параллелепипед a ≠ b ≠ c, α = γ = 90°, β ≠ 90°; триклинная — косоугольный параллелепипед a ≠ b ≠ c, α ≠ β ≠ γ ≠ 90°. 20. Кристалл , его основные свойства. Кристалл – это твёрдое тело , вырастающее в природных условиях с более или менее плоскими гранями и прямолинейными рёбрами. Основные свойства кристаллов – анизотропность, однородность, способность к самоогоранению и наличие постоянной температуры плавления определяются их внутренним строением. Анизотропность Это свойство называется еще неравносвойственностью.Выражается она в том, что физические свойства кристаллов (твердость, прочность, теплопроводность, электропроводность, скорость распространения света) неодинаковы по разным направлениям.Частицы, образующие кристаллическую структуру по непараллельным направлениям, отстоят друг от друга на разных расстояниях, вследствие чего и свойства кристаллического вещества по таким направлениям должны быть различными.Характерным примером вещества с ярко выраженной анизотропностью является слюда.Кристаллические пластинки этого минерала легко расщепляются лишь по плоскостям, параллельным его пластинчастости.В поперечных же направлениях расщепить пластинки слюды значительно труднее. Анизотропность проявляется и в том, что при воздействии на кристалл какого-либо растворителя скорость химических реакций различна по различным направлениям.В результате каждый кристалл при растворении приобретает свои характерные формы, носящие название фигур вытравливания. Аморфные вещества характеризуются изотропностью (равносвойственностью) – физические свойства по всем направлениям проявляются одинаково. Однородность Ввыражается в том, что любые элементарные объемы кристаллического вещества, одинаково ориентированные в пространстве, абсолютно одинаковы по всем своим свойствам: имеют один и тот же цвет, массу, твердость и т.д. таким образом, всякий кристалл есть однородное, но в то же время и анизотропное тело. Однородность присуща не только кристаллическим телам.Твердые аморфные образования также могут быть однородными.Но аморфные тела не могут сами по себе принимать многогранную форму. |
