Физиология с основами биохимии. Кучерявый В. В. Физиология с Основами биохимии
 Скачать 3.15 Mb. Скачать 3.15 Mb.
|
|
Тема 22. МЕТАБОЛИЗМ ОТДЕЛЬНЫХ ГРУПП ВЕЩЕСТВ Вопросы лекции и семинарского занятия. 1. Общая характеристика и классификация углеводов. Функции углеводов в организме. 2. Строение и биологическая роль глюкозы и гликогена. Синтез и распад гликогена. 3. Пути катаболизма углеводов. Гексозодифосфатный путь расщепления глюкозы. 4. Гексозомонофосфатный путь распада углеводов. 5. Химическое строение и биологическая роль жиров и липоидов. 6. Переваривание и всасывание жиров. 7. Катаболизм жиров. 8. Синтез жиров. 9.Строение мононуклеотидов. 10. Строение нуклеиновых кислот. 11. Переваривание нуклеиновых кислот. Катаболизм. 12. Синтез нуклеотидов. 13. Синтез нуклеиновых кислот. 14. Переваривание и всасывание белков. 15. Катаболизм белков. 16. Синтез белков. 17. Метаболизм аминокислот. 18. Азотистый баланс. Обезвреживание аммиака. 1. Общая характеристика и классификация углеводов. Функции углеводов в организме. Углеводы составляют более 80% всех органических соединений биосферы Земли. Исключительную роль в энергетическом обмене биосферы играет глюкоза. Именно этот углевод образуется в процессе фотосинтеза. И именно, глюкоза запускает энергетический обмен в нашем организме. Углеводы делятся на три основных класса: моносахариды, олигосахариды и полисахариды. Моносахариды или простые сахара не подвергаются гидролизу и получить из них более простые углеводы невозможно. К моносахаридам относятся: рибоза, дезоксирибоза, глюкоза, фруктоза, галактоза и другие. Олигосахариды состоят из нескольких моносахаридов, соединенных ковалентными связями. При гидролизе они распадаются на входящие в них моносахариды. Примером олигосахаридов могут служить дисахариды, состоящие из двух молекул моносахаридов. Наиболее распространенные дисахариды сахароза (пищевой или тростниковый сахар), состоящий из остатков глюкозы и фруктозы, лактоза(молочный сахар), состоящий из остатков глюкозы и галактозы. Полисахариды представляют собой длинные неразветвленные цепи. Включающие сотни и тысячи моносахаридных остатков. Наиболее известные из них – крахмал, целлюлоза, гликоген - состоят из остатков глюкозы. Функции углеводов в организме весьма разнообразны. 1. Энергетическая. 2. Структурная функция (входят в состав клеточных структур). 3. Защитная (синтез иммунных тел в ответ на антигены). 4.Антисвертывающая (гепарин). 5. Гомеостатическая (поддержание водно-солевого обмена) 6. Механическая ( входят в состав соединительных и опорных тканей). 2. Строение и биологическая роль глюкозы и гликогена. Синтез и распад гликогена. Эмпирическая формула глюкозы С6Н12О6. Она может иметь различные пространственные формы. В организме человека глюкоза как правило находится в циклической форме: 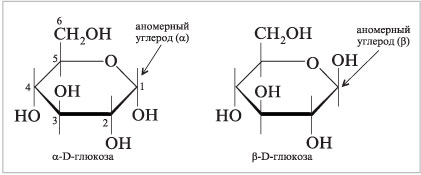 Свободная глюкоза в организме человека в основном находится в крови, где ее содержание довольно постоянно и колеблется в диапазоне от 3,9 до 6,1 ммоль/л. Глюкоза главный источник энергии в организме. Другим углеводом типичным для человека является гликоген. Состоит гликоген из сильно разветвленных молекул большого размера, содержащих десятки тысяч остатков глюкозы. Эмпирическая формула гликогена: (С6 Н12 О5)n где n число остатков глюкозы. Основные запасы гликогена сосредоточены в печени и мышцах. Гликоген является запасной формой глюкозы. В норме с пищей поступает 400 – 500 г углеводов. Это, главным образом, крахмал, клетчатка, сахароза, лактоза, гликоген. Переваривание углеводов происходит в разных частях пищеварительного тракта, начиная с ротовой полости. Осуществляют его ферменты амилазы. Единственный углевод, который не расщепляется в нашем организме – это клетчатка. Все остальные расщепляются до глюкозы, фруктозы, галактозы и.т. д. и вовлекаются в процессы катаболизма, Значительная часть глюкозы превращается в печени в гликоген. Между приемами пищи часть гликогена в печени превращается в глюкозу, которая поступает в кровь. Глюкоза, используемая для синтеза гликогена, предварительно активируется. Затем после ряда превращений образует гликоген. В этом процесс участвует нуклеотид УТФ (уридинтрифосфат), который по строению напоминает АТФ. В ходе реакций образуется промежуточное соединение – уридиндифосфатглюкоза (УДФ-глюкоза). Именно это соединение образует молекулы гликогена, вступая в реакцию с так называемой затравкой. Затравкой служат имеющиеся в печени молекулы гликогена. Реакции образования гликогена обеспечиваются энергией молекулами АТФ. Синтез гликогена ускоряется гормоном инсулином. Распад гликогена в печени осуществляется в обратном порядке и в конечном итоге образуется глюкоза и фосфорная кислота. Этот процесс ускоряется гормонами глюкагоном и адреналином. Распад гликогена в мышцах стимулирует гормон адреналин, который выделяется в кровь во время мышечной работы. При этом в мышцах не образуется свободная глюкоза и путь расщепления гликогена несколько иной. 3. Катаболизм углеводов. Гексозодифосфатный путь расщепления глюкозы. Катаболизм глюкозы осуществляется двумя путями. Основная часть углеводов (до95%) подвергается распаду по гексозодинофосфатному пути. Именно этот путь является основным источником энергии для организма. Остальная часть глюкозы расщепляется через гексозомонофосфатный путь. ГДФ-путь может протекать в условиях отсутствия кислорода – анаэробно и в присутствии кислорода, то есть в аэробных условиях. Это очень сложная цепь последовательных реакций, конечным результатом которой является образование углекислого газа и воды. Этот процесс можно разбить на три этапа, последовательно идущих друг за другом. Первый этап, называемыйгликолизом, происходит в цитоплазме клеток. Конечным продуктом этого этапа является пировиноградная кислота. 1. Реакция состоит в том, что глюкоза превращается в глюкозо-6фосфат. Глюкоза + АТФ → глюкоза-6-фосфат + АДФ 2. Глюкоза-6-фосфат превращается во фруктозо-6-фосфат 3. Фруктозо-6-фосфат переходит во фрутозо-1.6-фосфат 4. Далее из фруктозо-6-фосфата образуется фосфоглицериновый альдегид. 5.Затем из фосфоглицеринового альдегида образуется 1.3дифосфоглицерат 6. 1.3дифосфоглицерат переходит в3-фосфоглицерат, 7 который переходит в 2-фосфоглицерат, а затем 8 в фосфопируват, а тот 9 в пируват (пировиноградная кислота). Общее уравнение гликолиза выглядит так: Глюкоза + О2 + 8АДФ + 8 Н3РО4 → 2 Пируват + 2Н2О + 8 АТФ Первый этап распада углеводов практически обратим. Из пирувата, а также из возникающего в анаэробных условиях лактата (молочная кислота), может синтезироваться глюкоза, а из неё гликоген. Второй и третий этапы ГДФ-пути протекают в митохондриях. Эти этапы требуют присутствия кислорода. В ходе второго этапа от пировиноградной кислоты отщепляется углекислый газ и два атома водорода. Отщепленные атомы водорода по дыхательной цепи передаются на кислород с одновременным синтезом АТФ. Из пирувата же образуется уксусная кислота. Она присоединяется к особому веществу, коферменту А. Это вещество является переносчиком остатков кислот. Результатом этого процесса является образование вещества ацетилкофермент А. Это вещество обладает высокой химической активностью. Ацетилкофермент А подвергается дальнейшему окислению в цикле трикарбоновых кислот. Это и есть третий этап. Первой реакцией цикла является взаимодействие ацетилкофермента А со щавелево-уксусной кислотой с образованием лимонной кислоты. Поэтому эти реакции и называют циклом лимонной кислоты. Образуя ряд промежуточных трикарбоновых кислот лимонная кислота вновь превращается в щавелево-уксусную и цикл повторяется Результатом этих реакций является образование отщепленного водорода, которые, пройдя по дыхательной цепи(см. предыдущую лекцию), образует с кислородом воду. В результате всех этих реакции образуется 36 молекул АТФ. В сумме ГДФ-путь дает 38 молекул АТФ в пересчете на одну молекулу глюкозы Глюкоза + 6 О2 + 38 АДФ + 38 Н3 РО4 → 6СО2 + 6 Н2О +38 АТФ Расщепление гликогена добавляет к этому уравнению еще одну молекулу АТФ, При недостатке кислорода аэробный путь прерывается образованием пирувата, который превращается в лактат. В результате таких превращений образуется лишь две молекулы АТФ. Общая схема ГДФ-пути выглядит так: Г   ликоген Глюкоза ликоген ГлюкозаГлюкозо-6- фосфат  Пировиноградная кислота   Ацетилкофермент А Лактат  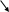 (2 молекулы АТФ при распаде 1молекулы глюкозы) (2 молекулы АТФ при распаде 1молекулы глюкозы)Н2О CO2 ( 38 молекул АТФ при распаде 1 молекулы глюкозы и 39АТФ при распаде 1 молекулы гликогена) 4. Гексозомонофосфатный путь распада углеводов. Как уже подчеркивалось выше ГМФ-путь распада углеводов – побочный. Данный путь встречается в надпочечниках, эритроцитах, жировой ткани, печени и протекает в цитоплазме клеток. ГМФ-путь распада глюкозы имеет анаболическое назначение и обеспечивает различные реакции синтеза рибозой и водородом. ГМФ-путь можно разделить на два этапа, причем, первый этап протекает обязательно, а второй не всегда. Первый этап начинается с перехода глюкозы в активную форму глюкозо-6-фосфат, от которого затем отщепляется молекула углекислого газа и две пары атомов водорода, присоединившиеся к коферменту НАДФ (никотинамидадениндинуклеотидфосфат). Конечным продуктом первого этапа является рибозо-5-фосфат. Образовавшийся в результате первого этапа НАДФ.Н2 поставляет атомы водорода в различные процессы синтеза, в частности для синтеза жирных кислот и холестерина. Рибозо-5-фосфат используется для синтеза нуклеотидов, из которых образуются затем нуклеиновые кислоты и коферменты. Второй этап протекает тогда, когда рибозо-5-фосфат полностью не расходуются для синтеза. Неиспользованные молекулы этого вещества вступают во взаимодействия друг с другом, в ходе которых они обмениваются группами атомов и в качестве промежуточных продуктов появляются моносахариды с различным числом атомов углерода, такие как триозы, пентозы, тетрозы, гексозы. В конечном итоге из шести молекул рибозо-5-фосфата образуется 5 молекул глюкозо-6-фосфата. Таким образом, второй этап делает данный способ распада глюкозы цикличным, поэтому его называют пентозным циклом. Пентозный цикл – это резервный путь энергетического обмена, который в ряде случаев может выдвигаться на первые роли § 5. Химическое строение и биологическая роль жиров и липоидов. Жиры или липиды – это группа разнообразных по строению веществ, обладающих одинаковыми физико-химическими свойствами. Они не растворимы в воде, но хорошо растворимы в органических растворителях (бензол, толуол, бензин, гексан и др.) Жиры делятся на две группы – собственно жиры или липиды и жироподобные вещества или липоиды. Молекула жира состоит из глицерина и трех остатков жирных кислот, соединенных сложноэфирной связью. Это так называемые истинные жиры или триглицериды. Жирные кислоты, входящие в состав жиров делятся на предельные и непредельные. Первые не имеют двойных связей и называются ещё насыщенными, а вторые имеют двойные связи и называются ненасыщенными. Есть ещё полиненасыщенные жирные кислоты, имеющие две и более двойные связи. Такие жирные кислоты в организме человека не синтезируются и должны обязательно поступать с пищей, так как являются для синтеза некоторых важных липоидов. Чем больше двойных связей, тем ниже температура плавления жира. Ненасыщенные жирные кислоты делают жиры более жидкими. Их много содержится в растительном масле. Жиры разного происхождения отличаются набором жирных кислот, входящих в их состав. Жиры нерастворимы в воде. Однако, в присутствии особых веществ – эмульгаторов – жиры при смешивании с водой образуют устойчивую смесь – эмульсию. Пример эмульсии – молоко, а пример эмульгатора – мыла – натриевые соли жирных кислот. В организме человека в роли эмульгаторов выступают желчные кислоты и некоторые белки. В организме животных и человека можно выделит три класса липоидов. 1. Фосфолипиды, состоящие из жирных кислот, спирта и обязательно фосфорной кислоты. 2. Гликолипиды, состоящие из жирной кислоты, спирта и какого-нибудь простого углевода, чаще всего галактозы. 3. Стероиды, содержащие сложное стерановое кольцо. Значение жиров и стероидов в организме очень велико. Жиры являются важным источником энергии. Из одного грамма жира организм извлекает около 9ккал энергии, что в 2 раза больше, чем из 1 г углеводов. Жиры защищают организм от переохлаждения и механических воздействий(например ударов). Жирные кислоты и липоиды входят в состав многих гормонов. Липоиды являются важнейшими компонентами клеточных мембран. Под воздействием УФ- излучения из липоида – холестерина образуется витамин D. 6. Переваривание и всасывание жиров. В суточном рационе обычно содержится 80- 100 г жиров. Переваривание жира в организме человека происходит в тонком кишечнике. Жиры предварительно с помощью желчных кислот превращается в эмульсию. В процессе эмульгирования крупные капли жира превращаются в мелкие, что значительно увеличивает их суммарную поверхность. Ферменты сока поджелудочной железы – липазы, являясь белками, не могут проникать внутрь капель жира и расщепляют только молекулы жира, находящиеся на поверхности. Поэтому увеличение общей поверхности капель жира за счет эмульгирования значительно повышает эффективность действия этого фермента. Под действием липазы жир путем гидролиза расщепляется до глицерина и жирных кислот. Поскольку в пище присутствуют разнообразные жиры, то в результате их переваривания образуется большое количество разновидностей жирных кислот. Продукты расщепления жира всасываются слизистой тонкого кишечника. Глицерин растворим в воде, поэтому его всасывание происходит легко. Жирные кислоты, нерастворимые в воде, всасываются виде комплексов с желчными кислотами (комплексы, состоящие из жирных и желчных кислот, называются холеиновыми кислотами) В клетках тонкой кишки холеиновые кислоты распадаются на жирные и желчные кислоты. Желчные кислоты из стенки тонкого кишечника поступают в печень и затем снова выделяются в полость тонкого кишечника. Освободившиеся жирные кислоты в клетках стенки тонкого кишечника вновь соединяются с глицерином, в результате чего вновь образуется молекула жира. Но в этот процесс вступают только жирные кислоты, входящие в состав жира человека. Таким образом, синтезируется человеческий жир. Такая перестройка пищевых жирных кислот в собственные жиры называется ресинтезом жира. Ресинтезированные жиры по лимфатическим сосудам минуя печень поступают в большой круг кровообращения и откладываются в запас в жировых депо. Главные жировые депо организма располагаются в подкожной жировой клетчатке, большом и малом сальниках, околопочечной капсуле. 7. Катаболизм жиров. Использование жира в качестве источника энергии начинается с его выхода из жировых депо в кровяное русло. Этот процесс называется мобилизация жира. Мобилизация жира ускоряется под действием симпатической нервной системы и гормона адреналина. В печени происходит гидролиз жира до глицерина и жирных кислот. Глицерин легко переходит в фосфоглицериновый альдегид. Это вещество является также промежуточным продуктом углеводов в поэтому легко вовлекается в углеводный обмен. Жирные кислоты соединяются с коферментом А и образуют соединение ацилкофермент А (ацил-КоА). эти процессы происходят в цитоплазме. Далее ацил-КоА передает жирную кислоту корнетину. Корнетин переносит жирную кислоту внутрь митохондрии и вновь отдает ее кофермента А, но в этот раз митохондриальному. В митохондриях окисление жирных кислот проходит в два этапа. Первый этап – β-окисление. Окислению подвергается углеродный атом жирной кислоты, находящийся в положении «бета». От жирной кислоты, связанной с КоА, дважды отщепляется по два атома водорода, которые затем по дыхательной цепи передаются на молекулярный кислород. В итоге образуется вода и образуется пять молекул АТФ. Этот процесс повторяется многократно, пока жирная кислота полностью не превратится в ацетил-КоА. Схема бета-окисления 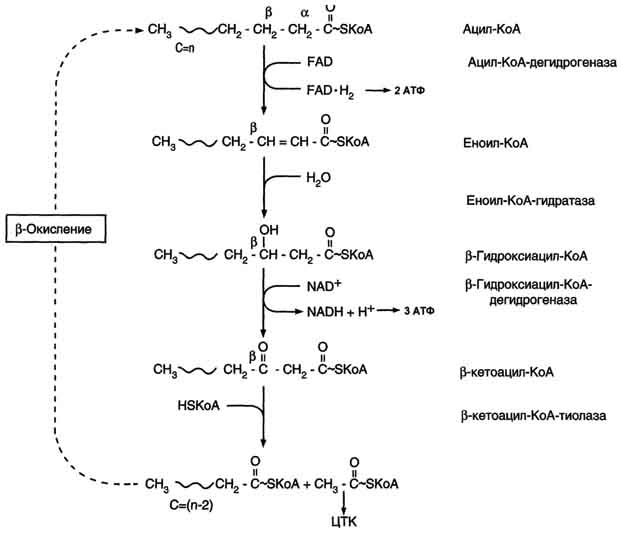 Второй этапом окисления – цикл трикарбоновых кислот, в котором происходит дальнейшее окисление остатка уксусной кислоты, входящей в ацетилкофермент А, до углекислого газа и воды. При окислении одной молекулы ацетилкофермента А выделяется до 12 молекул АТФ. Таким образом, окисление жирных кислот до углекислого газа и воды дает большое количество энергии. Например, из одной молекулы пальмитиновой кислоты (С15 Н31СООН) образуется 130 молекул АТФ. Однако, в силу особенностей строения жирных кислот (слишком много атомов углерода по сравнению с кислородом) их окисление затруднено по сравнению с углеводами. Поэтому жир обеспечивает организм энергией при работе средней мощности, но зато продолжительной. Отсюда вывод, чтобы сжигать жир нужно осуществлять работу средней мощности, но продолжительную. При продолжительных физических нагрузках и избыточном образовании ацетилкофермента А, происходит реакция конденсации уксусной кислоты с образованием кетоновых тел. В мышцах, почках и миокарде эти тела вновь переходят в ацетилкофермент А.Таким образом кетоновые тела играют важную роль при длительных спортивных тренировках. Однако при перетренировке они могут образовывать в крови ацетон, который выделяется с потом, мочой и выдыхаемым воздухом. 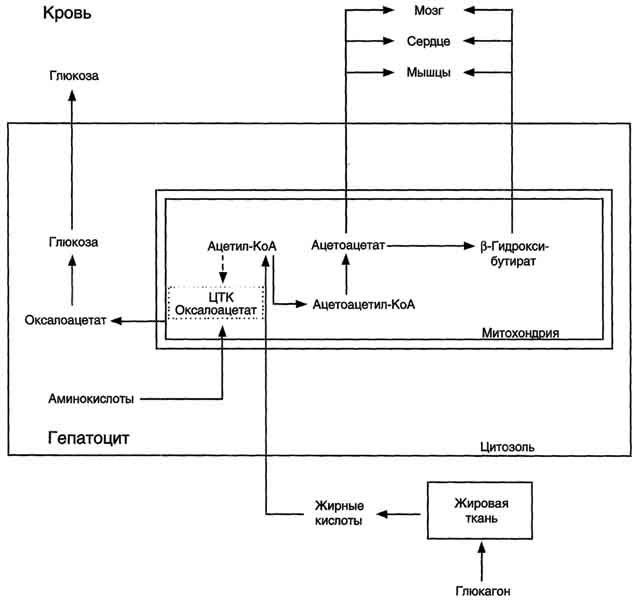 Схема. Активация синтеза кетоновых тел при голодании. Точечные линии - скорость метаболических путей снижена; сплошные линии - скорость метаболических путей повышена. При голодании в результате действия глюкагона активируются липолиз в жировой ткани и 3-окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль, где опять превращается в Оксалоацетат и используется в глюконеогенезе. В результате скорость реакций ЦТК снижается и, соответственно, замедляется окисление ацетил-КоА. Концентрация ацетил-КоА в митохондриях увеличивается, и активируется синтез кетоновых тел. Синтез кетоновых тел увеличивается также при сахарном диабете Схема. Активация синтеза кетоновых тел при голодании. Точечные линии - скорость метаболических путей снижена; сплошные линии - скорость метаболических путей повышена. При голодании в результате действия глюкагона активируются липолиз в жировой ткани и 3-окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль, где опять превращается в Оксалоацетат и используется в глюконеогенезе. В результате скорость реакций ЦТК снижается и, соответственно, замедляется окисление ацетил-КоА. Концентрация ацетил-КоА в митохондриях увеличивается, и активируется синтез кетоновых тел. Синтез кетоновых тел увеличивается также при сахарном диабете . 8. Синтез жиров Синтезируются жиры из глицерина и жирных кислот. Глицерин в организме возникает при распаде жира (пищевого и собственного), а также легко образуются из углеводов. Жирные кислоты синтезируются из ацетилкофермента А. Ацетилкофермент А – универсальный метаболит. Для его синтеза необходимы водород и энергия АТФ. Водород же получается из НАДФ.Н2. В организме синтезируются только насыщенные и мононасыщенные (имеющие одну двойную связь) жирные кислоты. Жирные кислоты, имеющие две и более двойных связей в молекуле, называемые полинасыщенные, в организме не синтезируются и должны поступать с пищей. Для синтеза жира могут быть использованы жирные кислоты – продукты гидролиза пищевого и собственного жиров. Все участники синтеза жира должны быть в активном виде: глицерин в форме глицерофосфата, а жирные кислоты в форме ацетилкофермента А. Синтез жира осуществляется в цитоплазме клеток (преимущественно жировой ткани, печени, тонкой кишки). Пути синтеза жиров представлены в схеме. 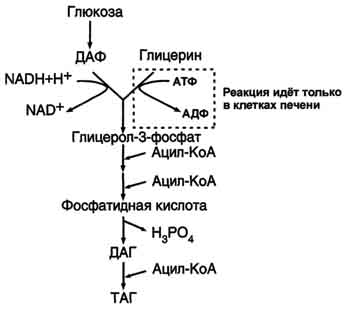 Следует отметить, что глицерин и жирные кислоты могут быть получены из углеводов. Поэтому при избыточном потреблении их на фоне малоподвижного образа жизни развивается ожирение. 9. Строение мононуклеотидов. По своему строению нуклеиновые кислоты являются полинуклеотидами, состоящими из мононуклеотидов или нуклеотидов. Нуклеотид сложное органическое соединение, состоящее из трех частей: азотистого основания, углевода и остатков фосфорной кислоты. Азотистые основания - это гетероциклические органические соединения, относящиеся к двум классам – пурины и пиримидины. Из пуринов в состав нуклеиновых кислот входят аденин и гуанин 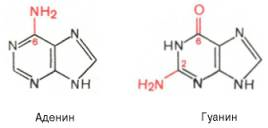 А из пиримидинов цитозин, тимин (ДНК) и урацил(РНК) . 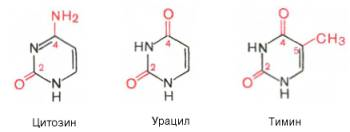 Углеводом, входящим в состав нуклеотидов может быть рибоза (РНК) и дезоксирибоза (ДНК) 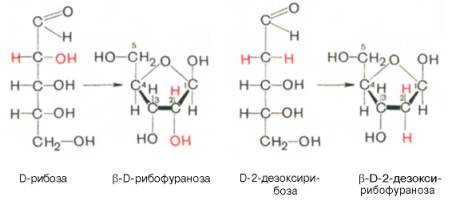 Азотистое основание, связанное с углеводом называется нуклеозидом. Фосфорная кислота присоединяется эфирной связью к пятому атому углерода рибозы или дезоксирибозы. Нуклеотиды, входящие в состав нуклеиновых кислот имеют один остаток фосфорной кислоты и называются мононуклеотидами. Однако в клетке встречаются ди- и тринуклеотиды. 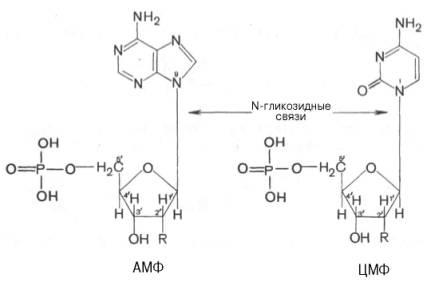 Например, нуклеотид, состоящий из аденина, рибозы и одного остатка фосфорной кислоты называется аденозинмонофосфат или АМФ, а из цитозина и одного остатка фосфорной кислоты цитозинмонофосфат или ЦМФ. 10. Строение нуклеиновых кислот. С точки зрения химии нуклеиновые кислоты – нерегулярные полимеры, состоящие из довольно сложно устроенных мономеров, называемых нуклеотидами. Нуклеиновых кислот в клетках встречается два класса – ДНК и РНК. ДНК – дезоксирибонуклеиновая кислота, а РНК – рибонуклеиновая кислота. Структура ДНК очень сложна и своеобразна. Каждый нуклеотид, из которого состоит ДНК, состоит из остатков сахара дезоксирибозы, остатка фосфорной кислоты и азотистого основания. Азотистых оснований четыре разновидности: аденин, гуанин, цитозин, и тимин. Нуклеотиды соединены в длинные цепи с помощью фосфорно-диэфирных связей. В 1953 году исследователи Джеймс Уотсон и Френсис Крик предложили модель, которая объясняла строение молекулы ДНК. Согласно их теории ДНК состоит из двух спиральных цепей, соединенных водородными связями. Азотистые основания обеих цепей находятся внутри спирали и образуют водородные связи. Эти связи соединяют цепи ДНК не случайным образом, а по принципу комплементарности или соответствия. Суть этого принципа в следующем, если в одной цепи стоит тимин, то в противоположной цепи, ему соответствует аденин, а против гуанина всегда стоит цитозин. Это значит, что при удвоении ДНК на каждой из её цепей может быть достроена другая, и вместо одной молекулы получатся сразу две. Принцип комплементарности лежит в основе всех процессов связанных с реализацией генетической информации: репликации ДНК (удвоения ДНК), транскрипции(синтеза РНК на ДНК матрицах), и трансляции(биосинтеза белка на основе матриц РНК). На схемах ниже продемонстрирована структура ДНК и принцип комплементарности. Структура ДНК  Принцип комплементарности. 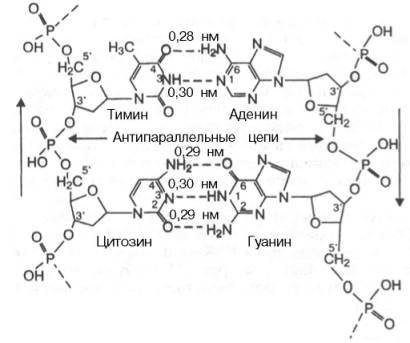 Помимо ДНК в клетках встречаются три разновидности РНК: информационные (и-РНК), транспортные (т-РНК) и рибосомные (р-РНК). Все они отличаются от ДНК рядом особенностей. Во-первых, вместо азотистого основания тимина они содержат урацил. Во-вторых, вместо сахара дезоксирибозы они содержат рибозу. В-третьих, они, как правило, односпиральные. 11. Переваривание и всасывание нуклеиновых кислот. Катаболизм. С пищей в сутки в организм поступает около 1 г нуклеиновых кислот. Переваривание нуклеиновых кислот происходит в тонком кишечнике. Сначала, поступившие с пищей нуклеиновые кислоты под действием ферментов панкреатического сока – нуклеаз – превращаются в мононуклеотиды. Затем уже под влиянием ферментов тонкого кишечника от мононуклеотидов отщепляется фосфорная кислота, и образуются нуклеозиды. Часть нуклеозидов расщепляется затем на азотистое основание и углевод. Продукты переваривания нуклеиновых кислот поступают в кровь, а затем в печень и другие органы. В клетках организмов обмен РНК протекает значительно более интенсивно, чем обмен ДНК. В конечном итоге нуклеиновые кислоты расщепляются на азотистые основания, углеводы и фосфорную кислоту. Далее пуриновые азотистые основания в процессе катаболизма теряют аминогруппу в виде аммиака, окисляются и превращаются в мочевую кислоту. Пиримидиновые основания подвергаются более глубокому расщеплению до углекислого газа, воды и аммиака. Углеводы вовлекаются в ГМФ-путь распада и превращаются в глюкозу. Фосфорная кислота распаду не подвергается. Она используется в реакциях фосфорилирования и фосфолиза или при избытке выделяется из организма с мочой. 12. Синтез нуклеотидов. Все клетки организма способны синтезировать необходимые нуклеиновые кислоты и не нуждаются в наличии в пище готовых нуклеиновых кислот или их составных частей. Поэтому содержание готовых нуклеиновых кислот в пище для организма принципиального значения не имеет, хотя продукты их распада могут частично использоваться организмом. Синтез пуриновых и пиримидиновых нуклеотидов происходит на основе рибозо-5-фосфата. из глюкозы при её распаде по ГМФ-пути. Свободные азотистые основания обычно для этого синтеза не используются. При синтезе пуриновых нуклеотидов к рибозо-5-фосфату присоединяются атомы углерода и азота, из которых образуется пуриновое кольцо. Источниками этих атомов являются аминокислоты глицин, глутамин, аспарагиновая кислота. Часть атомов углерода поставляется коферментами, содержащими в своём составе фолиевую кислоту и биотин. Промежуточным продуктом синтеза пуриновых нуклеотидов является инозиновая кислота. Далее из инозиновой кислоты образуются пуриновые нуклеотиды. Синтезу пиримидиновых нуклеотидов предшествует образование необычного азотистого основания оротовой кислоты, содержащей пиримидиновое кольцо. Синтезируется оротовая кислота из аммиака и аспарагиновой кислоты. Оротовая кислота присоединяется к рибозо-5-фосфату и возникает пиримидиновый нуклеотид оротидинмонофосфат. Далее оротовая кислота в составе этого нуклеотида преобразуется в обычные азотистые основания, в результате чего появляются пиримидиновые нуклеотиды. В связи с высокой важностью оротовой кислоты в спортивной практике в качестве пищевой добавки используется её соль оротат калия. Дезоксирибонуклеотиды образуются из соответствующих рибонуклеотидов путём восстановления входящей в них рибозы в дезоксирибозу. 13. Синтез нуклеиновых кислот. Для синтеза нуклеиновых кислот используются мононуклеотиды обязательно в трифосфатной форме. Такие нуклеотиды содержат в своей молекуле три остатка фосфорной кислоты и обладают повышенным запасом энергии. Переход нуклеотидов в трифосфатную форму осуществляется путем взаимодействия с АТФ. Для синтеза РНК используются АТФ, ГТФ, УТФ, ЦТФ. А для синтеза ДНК, соответственно, дАТФ, дГТФ, дТТФ, дЦТФ. Процесс репликации или редупликации ДНК иначе можно назвать удвоением. Он происходит перед делением клетки. Осуществляет его специальный фермент ДНК полимераза. Этот фермент разделяет две цепи двойной спирали и достраивает к каждой из них комплементарную ей цепь. Таким образом, из одной молекулы образуется две одинаковые дочерние молекулы, причем обе цепи ДНК служат матрицами для дочерних цепей. По мере присоединения к матрице нуклеотиды связываются в полинуклеотидные нити, которые сразу же закручиваются в двойную спираль. Биологический смысл репликации состоит в том, что из одной молекулы ДНК появляются две ее полные копии. Процесс этот идет с очень высокой точностью – ошибки крайне редки. Процесс синтеза РНК называется транскрипцией. Процесс образования белков на матрицах информационной РНК называется трансляцией. Транскрипцию осуществляет фермент РНК-полимераза. Этот фермент соединяет между собой рибонуклеотиды, составляющие остов молекулы РНК. Делает это фермент на основании считывания последовательности молекулы ДНК и, достраивая комплементарные ей последовательности. Показано, что в этом процессе только одна из двух цепей ДНК играет роль матрицы. Бывают, правда, и исключения – это ДНК некоторых вирусов. В процессе транскрипции участвует только ограниченный участок ДНК. Именно этот участок ДНК и понимают в молекулярной биологии, как ген. 14. Переваривание и всасывание белков. В сутки с пищей поступает около 100 г белков. Переваривание белков осуществляют протеолитические ферменты желудочного панкреатического и кишечного соков. Расщепление пищевых белков начинается в полости желудка под действием желудочного сока. Желудочный сок содержит фермент пепсин. Вначале пепсин активируется при этом в его предшественнике – пепсиногене – открывается активный центр. Этот механизм активации называется аутокатализ. Образование активного центра в полости желудка предупреждает нежелательное воздействие этого фермента на белки клеток желудка, где происходит его образование. Муцин, покрывающий защитным слоем поверхность пищеварительного тракта, устойчив к действию пепсина. Под воздействием пепсина в пищевых белках расщепляются пептидные связи, находящиеся в глубине молекул. В результате такого действия пепсина белковые молекулы превращаются в смесь полипептидов различной длины, которую иногда называют пептон. Тепловая переработка пищи вызывает денатурацию белков, то есть изменение пространственной формы белковой молекулы. Это делает внутренние пептидные связи более доступными для пепсина и других протеолитических ферментов. В состав желудочного сока входит и соляная кислота. Она также способствует активизации пепсина. Кроме того, она создает оптимальную для действия пепсина сильнокислую среду. Соляная кислота также вызывает денатурацию пищевых белков, что способствует облегчению действия пепсина. Наконец, соляная кислота обладает бактерицидным действием, обезвреживает пищу от микроорганизмов. Дальнейшее переваривание белков протекает в тонком кишечнике. Из желудка поступает полипептидная смесь, состоящая из фрагментов разной величины и длины. В тонком кишечнике эта смесь вначале подвергается действию ферментов поджелудочной железы (трипсина, химотрипсина, эластазы). Эти ферменты расщепляют полипептиды, поступившие в кишечник до ди- и трипептидов. Причем, эластаза расщепляет прочные белки – коллаген и эластин. Таким образом, возникают олигопептиды. Завершается переваривание белков в тонком кишечнике под действием ферментов кишечного сока. Эти ферменты встроены в стенки микроворсинок и выделяются в полость кишечника. Выделяют два типа переваривания пристеночное и полостное. Аминокислоты, возникающие на поверхности микроворсинок, сразу всасываются в кровь. Незначительная часть аминокислот всасывается в лимфатическую систему. Всасывание аминокислот процесс активный, идущий с затратами АТФ, 15. Катаболизм белков. Внутри клеток также имеются протеолитические ферменты – внутриклеточные протеиназы или катепсины. Эти ферменты сосредоточены в специальных органоидах клетки – лизосомах. Мембраны, окружающие лизосомы непроницаемы для ферментов, но они пропускают белки внутрь, чтобы подвергнуть их протеолизу. Белки, которые необходимо подвергнуть протеолизу, расщепляются в лизосомах до отдельных аминокислот. Кроме того, в цитоплазме клеток имеются особые мультиферментные комплексы – протеосомы, предназначенные для избирательного расщепления белков, которых не должно быть в клетках. Это чужеродные и дефектные белки, а также молекулы, присутствие которых ограничено во времени. Для предотвращения нежелательного переваривания белков в цитоплазме имеются особые белки – эндогенные ингибиторы протеиназ. Ингибиторов такого рода особенно много в плазме крови. В сутки внутриклеточному протеолизу подвергается от 200 до 300 г собственных белков. Глубокий распад белков, сопровождающийся расщеплением всех пептидных связей и приводящий к образованию аминокислот, называется тотальным протеолизом. В некоторых случаях под действием протеолитических ферментов в молекуле белка избирательно расщепляется лишь одна пептидная связь между строго определенными аминокислотами и от белка отщепляется часть его молекулы – полипептид. Такой распад белков называют ограниченный протеолиз. Примером ограниченного протеолиза является превращение проферментов в действующие ферменты: переход неактивных форм факторов свертывания крови в активные. 16. Синтез белков. В синтезе белков из аминокислот можно выделить три этапа. Первый этап – транскрипция – был описан в предыдущей теме. Он состоит в образовании молекул РНК на матрицах ДНК. Для синтеза белка особое значение имеет синтез матричных или информационных РНК, так как здесь записана информация о будущем белке. Транскрипция протекает в ядре клеток. Затем с помощью специальных ферментов, образовавшаяся матричная РНК перемещается в цитоплазму. Второй этап называется рекогниция. Аминокислоты избирательно связываются с своими переносчиками транспортными РНК. Все т-РНК построены сходным образом. Молекула каждой т-РНК представляет собой полинуклеотидную цепь, изогнутую в виде «клеверного листа». Молекулы т-РНК устроены таким образом, что имеют разные концы, имеющие сродство и с м-РНК (антикодон) и с аминокислотами. Т-РНК имеет в клетке 60 разновидностей. Для соединения аминокислот с транспортными РНК служит особый фермент т-РНК синтетаза или, точнее, амино-ацил – т-РНК синтетаза. Третий этап биосинтеза белка называется трансляция. Он происходит на рибосомах. Каждая рибосома состоит из двух частей – большой и малой субъединиц. Они состоят из рибосомных РНК и белков. Трансляция начинается с присоединения матричной РНК к рибосоме. Затем к образовавшемуся комплексу начинают присоединяться т-РНК с аминокислотами. Присоединение это происходит путем связывания антикодона т-РНК к кодону информационной РНК на основании принципа комплементарности. Одновременно к рибосоме могут присоединиться не более двух т-РНК. Далее аминокислоты соединяются друг с другом пептидной связью, образуя постепенно полипептид. После этого рибосома передвигает информационную РНК ровно на один кодон. Дальше процесс повторяется снова до тех пор пока информационная РНК не закончится. На конце и-РНК находятся бессмысленные кодоны, которые являются точками в записи и одновременно командой для рибосомы, что она должна отделиться от и-РНК Таким образом, можно выделить несколько особенности биосинтеза белков. 1. Первичная структура белков формируется строго на основе данных записанных в молекулах ДНК и информационных РНК, 2. Высшие структуры белка (вторичная, третичная, четвертичная) возникают самопроизвольно на основе первичной структуры. 3. В некоторых случаях полипептидная цепь после завершения синтеза подвергается незначительной химической модификации, в результате чего в ней появляются некодируемые аминокислоты, не относящиеся к 20 обычным. Примером такого превращения является белок коллаген, где аминокислоты лизин и пролин превращаются в оксипролин и оксилизин. 4. Синтез белков в организме ускоряется соматотропным гормоном и гормоном тестостероном. 5. Синтез белков очень энергоемкий процесс, требующий огромного количества АТФ. 6. Многие антибиотики подавляют трансляцию. 17. Метаболизм аминокислот. Аминокислоты могут использоваться для синтеза различных небелковых соединений. Например, из аминокислот синтезируется глюкоза, азотистые основания, небелковая часть гемоглобина – гем, гормоны – адреналин, тироксин и такие важные соединения, как креатин, карнитин, принимающие участие в энергетическом обмене. Часть аминокислот подвергается распаду до углекислого газа, воды и аммиака. Распад начинается с реакций общих для большинства аминокислот. К ним относятся. 1. Декарбоксилирование - отщепление от аминокислот карбоксильной группы в виде углекислого газа. 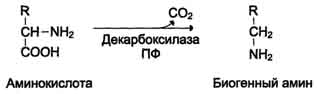 Так, например, образуется гистамин из аминокислоты гистидина. Гистамин – важное сосудорасширяющее вещество. 2. Дезаминирование - отцепление аминогруппы в виде NH3 . У человека дезаминирование аминокислот идет окислительным путем. 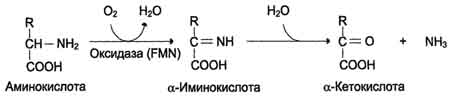 3. Трансаминирование – реакция между аминокислотами и α-кетокислотами. В ходе этой реакции её участники обмениваются функциональными группами. 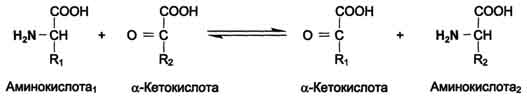 Трансаминированию подвергаются все аминокислоты. Этот процесс – главное превращение аминокислот в организме, так как у него скорость значительно выше, чем у двух первых описанных реакций. Трансаминирование выполняет две основные функции. 1. За счет этих реакций одни аминокислоты превращаются в другие. При этом общее количество аминокислот не меняется но меняется общее соотношение между ними в организме. С пищей в организм поступают чужеродные белки, у которых аминокислоты находятся в иных пропорциях. Путем трансаминирования происходит корректировка аминокислотного состава организма. 2. Трансаминирование является составной частью процесса косвенного дезаминирования аминокислот – процесса, с которого начинается распад большинства аминокислот. Схема косвенного дезаминирования. 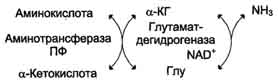 В результате трансаминирования образуются α-кетокислоты и аммиак. Первые разрушаются до углекислого газа и воды. Аммиак для организма высокотоксичен. Поэтому в организме существуют молекулярные механизмы его обезвреживания. 18. Азотистый баланс. Пути обезвреживания аммиака. Азотистый баланс. Состояние белкового обмена можно оценить по азотистому балансу, то есть по соотношению между азотом, поступающим в организм с пищей и азотом, который выводится из организма в составе пота, слюны и мочи. Взрослый человек при обычном питании находится в состоянии азотистого равновесия (азота выводится столько же, сколько поступает с пищей). Это свидетельствует об одинаковой скорости синтеза и распада белков. При положительном азотистом балансе с пищей азота поступает больше, чем выводится. В этом случае синтез белков протекает с более высокой скоростью, чем распад. Положительный азотистый баланс наблюдается у растущего организма, а также у спортсменов, наращивающих мышечную массу. При отрицательном азотистом балансе (азота выводится больше, чем поступает) белков в организме распадается больше, чем образуется. Такой баланс характерен для длительного белкового голодания. Пути обезвреживания аммиака. В таблице показаны основные источники выделения аммиака в организме. Таблица. Основные источники аммиака
По мере образования, аммиак во всех тканях связывается с глутаминовой кислотой с образованием глутамина. 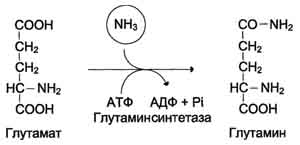 Это временное обезвреживание аммиака. С током крови глутамин поступает в печень, где распадается опять на глутаминовую кислоту и аммиак. Глутаминовая кислота с кровью снова поступает в органы для обезвреживания новых порций аммиака. Освободившийся аммиак, а также углекислый газ используются в печени для синтеза мочевины: Синтез мочевины – это циклический многостадийный процесс, идущий с большими затратами энергии. В синтезе мочевины важнейшую роль играет аминокислота орнитин Синтез мочевины часто называют орнитиновым циклом. В процессе синтезе к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается в другую аминокислоту – аргинин. От аргинина отщепляется мочевина и вновь образуется орнитин. Синтез мочевины – это окончательное обезвреживание аммиака. Из печени с кровью мочевина поступает в почки и выделяется с мочой. В сутки её образуется 20 – 35 г. выделение мочевины с мочой характеризует интенсивность распада белков в организме. Орнитиновый цикл. Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ. На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: • одна аминогруппа - в виде аммиака в матриксе митохондрии; • вторую аминогруппу поставляет аспартат цитозоля. 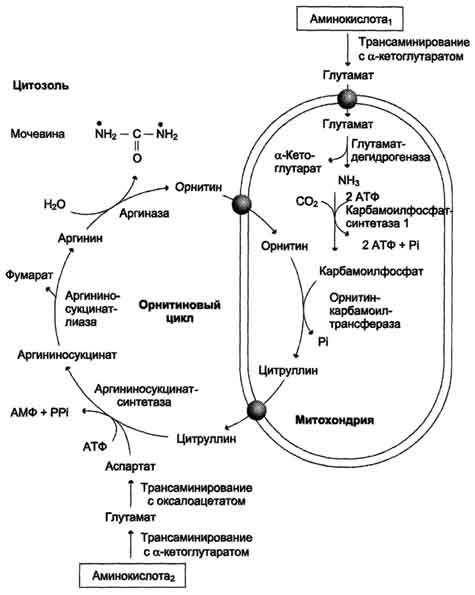 |
