ИНДИКАЦИЯ ВИРУСОВ. Культивирование вирусов
 Скачать 1.01 Mb. Скачать 1.01 Mb.
|
|
КУЛЬТИВИРОВАНИЕ ВИРУСОВ Основные методы культивирования вирусов. 1.В организме лабораторных животных. 2.В куриных эмбрионах. 3.В клеточных культурах. Использование лабораторных животных В настоящее время лабораторные животные широко применяются в вирусологии для решения самых разнообразных теоретических и практических вопросов. Большинство вирусов могут быть дифференцированы друг от друга на основании патогенности для различных видов животных. Некоторые вирусы не представляется возможным культивировать ни в куриных эмбрионах, ни в культуре клеток, а только в организме восприимчивых животных. Наличие у лабораторных животных характерной клинической картины после заражения патологическим вируссодержащим материалом, результаты вирусологических и гистологических исследований их органов и тканей в ряде случаев являются основным методом диагностики вирусных болезней человека. Заражают белых мышей, кроликов, морских свинок, крыс и т.д. Методы заражения: оральное, подкожное, внутримышечное, внутрикожное, внутривенное заражение, в брюшную полость, интракардиальное заражение, заражение через нос, заражение в мозг. Оральное заражение (peros). Для заражения вируссодержащий материал добавляют к пище или воде. Реже через носоглоточный зонд. Заражение в мозг. Интрацеребральную инъекцию у большинства лабораторных животных производят сбоку от средней линии, в середине между верхним краем глазной впадины и наружным слуховым проходом. Животных заражают путем прокола кости черепа иглой. Материал вводят в количестве 0,2-0,3 мл, медленно. Использование куриных эмбрионов В вирусологической практике куриные эмбрионы нашли широкое применение для выделения вируса из патологического материала. Существенное преимущество этого метода – высокая бактериологическая чистота получаемых вирусных суспензий, так как замкнутая полость яйца служит надёжной защитой от различной микрофлоры. Куриные эмбрионы пригодны для культивирования многих вирусов, патогенных для человека и животных. Они дёшевы, удобны и доступны для работы большинства практических лабораторий. К недостаткам этого метода относятся высокое содержание в экстраэмбриональных вирусосодержащих жидкостях неспецифического белка, а также возможность спонтанного инфицирования куриных эмбрионов вирусами. Для вирусологических исследований используют яйца, полученные из хозяйств, благополучных по инфекционным болезням птиц. Для инкубации яйца помещают в специальные инкубаторы с температурой 37,5-38 С и относительной влажностью воздуха 40-70%. Продолжительность инкубирования куриных эмбрионов определяется избранным методом введения вируссодержащего материала. Чаще всего в работе используются 7-12-дневные куриные эмбрионы. Строение куриного эмбриона. Развитие оплодотворенного яйца начинается с образования трёх зародышевых листков: эктодермы, мезодермы и энтодермы. Из экто- и мезодермы возникает амниотическая полость. Амниотическая полость заполнена жидкостью (1мл). Из экто- и мезодермы кроме амниона образуется хорион, который к 10-му дню обволакивает все содержимое яйца, образуя периферическую поверхность хориоаллантоисной оболочки. Внутренняя поверхность аллантоисной оболочки образуется из энтодермы на 3-й день развития эмбриона. Пространство между хориоаллантоисной и аллантоисной оболочкой, покрывающей амнион, заполнено аллантаисной жидкостью. Основной резервуар питательных веществ для зародыша – желточный мешок. Методы заражения куриных эмбрионов. Выбор методов заражения куриных эмбрионов зависит от биологических свойств исследуемого вируса. В вирусологической практике широкое применение нашло заражение на хорионаллантоисную оболочку, в аллантоисную полость и в желточный мешок. Заражение на хорионаллантоисную оболочку. Используют 10-12 – дневные куриные эмбрионы, инкубированные в горизонтальном положении. Поверхность яйца дезинфицируют спиртом, 2% раствором йода, прожигают. На скорлупе выпиливают треугольник (5-6мм). Иглой надрывают подскорлупную оболочку. На обнажённую хорионаллантоисную оболочку пастеровской пипеткой наносят 0,1 мл вируссодержащего материала. Отверстия на скорлупе закрывают парафином. Заражение в аллантоисную полость. Используют 9-11 – дневные эмбрионы, когда аллантоисной жидкости содержится больше всего. Скорлупу дезинфицируют спиртом, 2% раствором йода, прожигают. Яйцо помещают вертикально тупым концом вверх. Над центром воздушного мешка делают прокол скорлупы и через него вводят иглу диаметром 0,5 мм и длиной 5 см на глубину 3-5 см. Инокулируют исследуемый материал в количестве 0,1 мл. Место инъекции закрывают парафином. Яйца инкубируют в вертикальном положении при 35 С 24-72 ч. Заражение в амниотическую полость. Используют 10-11-дневные эмбрионы, которые близко расположены к воздушному пространству. Заражение производят в затемненном помещении под овоскопом. Тупой конец яйца дезинфицируют, в скорлупе делают отверстие над воздушной камерой. Для заражения используют иглу диаметром 0,6мм. Материал вводят в количестве 0,1 мл. Отверстие закрывают парафином. Зараженные яйца инкубируют при 37С 24-72ч. Заражение в желточный мешок. Используют 5-6-дневные эмбрионы, т.к. в этот период желточный мешок имеет самый большой объем. Скорлупу дезинфицируют, делают в ней отверстие. Для заражения используют иглу длиной 5см, которую вводят вертикально до упора. Игла прокалывает хорионаллантоисную оболочку, проходит через аллантоисную полость и через стенку желточного мешка в желток. Место инъекции закрывают парафином. Яйца инкубируют при 37С 72 ч. Использование клеточных культур Культуры клеток – это клетки ткани, выращенные вне организма на специальной питательной среде. Клетки ткани в искусственных условиях сохраняют присущий им обмен и восприимчивость к определенным вирусам. Для выращивания клеточных культур необходимы среды, которые должны иметь солевой состав, близкий клеткам организма, определенное значение pH, содержать питательные вещества и факторы роста. Первые питательные среды состояли из плазмы, сыворотки крови, эмбрионального экстракта и др. Эти биологические компоненты используют и в настоящее время. Основой всех современных сред являются сбалансированные солевые растворы Хэнкса и Эрла. Питательные среды для культур клеток разделяются на ростовые и поддерживающие. Ростовые среды в отличии от поддерживающих содержат сыворотку крови. Питательные среды по происхождению делят на естественные и искусственные. Естественные – это ферментативные гидролизаты различных белковых продуктов (гидролизат лактальбумина, казеина, гемогидролизат и др.). Синтетические среды получают добавлением к солевым растворам аминокислот, витаминов (среда 199, среда Игла). В диагностической работе вирусологических лабораторий широко применяются следующие клеточные культуры: первично-трипсинизированные, перевиваемые и полуперевиваемые. Если первичную ткань пересевают в свежую питательную среду (т.е. производят пассаж) и в ней образуется рост культуры, т.е её называют тканевой субкультурой. Практически субкультуры удаётся получить из любой первичной ткани, но количество пассажей ткань выдерживает не больше 4-5, редко до 20. В результате подбора специальных питательных сред, режима пассажирования удается адаптировать отдельные ткани к определенной питательной среде и пассажировать их (перевивать) очень долго. Клетки, которые приобрели способность к длительному пассажированию называются перевиваемыми. Первично-трипсинизированные культуры клеток. Первично-трипсинизированные культуры клеток – это растущие однослойные культуры клеток, полученные посредством ферментативной дезагрегации органов и тканей. Первичные культуры получают из клеток различных тканей чаще путем их размельчения и трипсинизации, используют однократно, т.е. постоянно необходимо иметь соответствующие органы или ткани. Недостатком первично-трипсинизированных культур является трудоемкость и длительность их получения, а также частая контаминация латентными вирусами. Выбор органа и ткани зависит от чувствительности их клеток in vitro к исследуемому материалу. В вирусологической практике нашли применение первично-трипсинизированные культуры фибробластов мышей, эмбрионов человека, эмбрионов кур, почек морской свинки. Перевиваемые культуры клеток. Перевиваемые культуры клеток получают из необластических и нормальных тканей и органов человека или животных. Они имеют измененный кариотип и обладают способностью бесконечно перевиваться in vitro. Перевиваемые культуры клеток в сравнении с первично-трипсинизированными обладают существенными преимуществами: способностью неопределённо долгое время перевиваться, высокой интенсивностью размножения, простой техникой культивирования, возможностью использования сходных штаммов в различных лабораториях, отсутствием инфицированности посторонними вирусами. Многие перевиваемые культуры проведены через сотни серийных пассажей, имеют совершенно одинаковую форму клеток, стабильны в условиях in vitro, что делает их особенно пригодными для выполнения различных экспериментальных исследований. Перевиваемые культуры клеток Hela, Hep-1, Hep-2, почка эмбриона свиньи, почка эмбриона коровы и другие используются для выделения вируса из патологического материала. Перевиваемые культуры выращивают в виде суспензии или однослойных культур на поверхности стекла в культурных сосудах. Перевиваемые клетки легче получать из злокачественных тканей (клетки Hela получены из карциномы шейки матки женщины, клетки Hep-2 из карциномы гортани человека идр.), но в настоящее время широко культивируются перевиваемые клетки «нормальных» тканей. Однако существует мнение, что перевиваемые ткани «нормального» происхождения вследствие приобретённой потенциальной возможности к бесконечному размножению перерождаеются. В вирусологической практике перевиваемые ткани имеют некоторые преимущества: они свободны от скрытых вирусов, тогда, как первичные ткани могут быть носителями латентного вируса; обладают более широким спектром чувствительности к разным вирусам; кроме того, детально изучена их морфология и чувствительность к различным вирусам. Но перевиваемые клетки имеют ряд недостатков, которые ограничивают в известной степени их применение: они склонны к малигнизации, т.е. к злокачественному перерождению независимо от их происхождения; необходимость постоянного поддержания их; у них появляется неспецифическая дегенерация, изменяется морфология клеток и снижается чувствительность к вирусам. В последние годы в вирусологии, особенно в биопромышленности, применяют штаммы клеток с диплоидным набором хромосом, так называемые диплоидные клетки. Такие штаммы клеток сохраняют хромосомный набор, типичный для исходных тканей. Диплоидные клетки обладают чувствительностью к вирусам, как исходные клетки, свободны от латентных вирусов и не обладают канцерогенными свойствами. Недостаток диплоидных клеток – ограниченная возможность их пассажирования. Получение субкультур или перевивание клеток проводят следующим образом. Снятие клеточного слоя. Растущие клетки довольно прочно прикрепляются к поверхности стекла под слоем питательной среды. Снять их можно механическим путём (соскоб), или воздействием 0,02% раствора версена, или 0,25% раствором трипсина. Из сосудов с выросшим клеточным монослоем сливают питательную среду, добавляют в них подогретый до 37С раствор версена (в количестве вдвое меньшем, чем было среды) и выдерживают в термостате 20-30 минут, при этом сосуд несколько раз покачивают. Версен связывает двухвалентные катионы магния и кальция, в результате ткань разделяется на отдельные клетки и отслаивается от стекла. Отделение клеток от диспергирующего вещества. Взвесь клеток в диспрегирующем веществе (в версене) помещают в центрифужные пробирки и центрифугируют при 800-1000об/мин в течение 7-10 минут. Надосадочную жидкость сливают, а осадок клеток ресуспендируют в небольшом количестве питательной среды. Затем берут 1-2 мл клеточной взвеси и подсчитывают клетки. Посев клеток. После подсчёта клеток в 1 мл исходную клеточную взвесь разводят питательной средой до нужной концентрации. При этом учитывают добавление к общему объему среды стерильной сыворотки крупного рогатого скота в количестве 10%. Подготовленную взвесь вносят при помешивании в специально подготовленную для культивирования клеток посуду и закрывают резиновыми пробками. Посевная доза клеток в пробирке по 80-100 тыс. в 1 мл; в сосуды с плоской поверхностью – 25-30 тыс. на 1 см полезной площади сосуда. Засеянные клетки выращивают в термостате при температуре 37С в течение 3-4 суток. Перевиваемые штаммы клеток обычно пересеваются через каждые 6-7 дней. Заражение клеточных культур вирусом. Проводят в стерильном боксе. Перед заражением все клеточные культуры микроскопируют и отбирают пробирки или матрацы только с хорошим, типичным монослоем. Культуры с неполным монослоем, с признаками дегенерации клеток или с нетипичным клеточным ростом бракуют. В качестве вируссодержащего материала для заражения клеток используют фильтраты (прошедшие через бактерийный фильтр) или свежевзятый (в стерильных условиях) нативный материал с добавлением антибиотиков. Заражать ткани можно пассажным вирусом на культуре ткани. В этом случае используют от культур с типичным для данного вируса цитопатогенным эффектом. Методика заражения. Из отобранных культур отсасывают или сливают питательную среду. Часть культур (не менее четырёх) оставляют в качестве контроля; в них вносят по 0,1 мл свежей питательной среды без сыворотки. В другие 4-6 пробирок с клеточным монослоем вносят по 0,1 мл вируссодержащего материала. Все культуры в пробирках (контрольные и опытные) помещают в термостат и выдерживают при температуре 37С 20-30 минут. Затем в них добавляют по 0,9 мл питательной среды без сыворотки, ставят в термостат и ежедневно наблюдают за ними, сравнивая под микроскопом опытные культуры клеток с контрольными. Необходимо иметь в виду, что при внесении вируса и при последующем его выращивании пробирки выдерживают в термостате под углом так, чтобы клеточный слой был покрыт питательной средой. Поэтому на пробирках принято делать продольные прямые линии цветным карандашом. Пробирки укладывают всегда линией вверх. Учёт результатов заражения. В контрольных культурах клеток обычно в течение недели морфологических изменения не отмечают. В опытных культурах под воздействием вируса видимые изменения в клетках могут наступить уже через 10-12 часов, или через несколько дней, или заметной деструкции клеток не наступит. Всё это зависит от восприимчивости ткани к данному вирусу, свойств и дозы вируса, условий культивирования и т.д. Кроме того, следует учитывать также, что морфологические клетки могут изменяться под воздействием токсических веществ, содержавшихся в исследуемом материале. Чтобы убедиться в отсутствии действии вируса на клетки или подтвердить специфичность этого действия , а также убедиться в том, что наступившая дегенерация клеток не является результатом действия токсических веществ, из зараженных тканей отсасывают культуральную жидкость и заражают ею свежую культуру ткани, т.е. проводят пассаж. Повторение морфологических изменений в пассажах указывает на наличие и размножение вируса. Если в первом дегенерация клеток наступила, а в пассаже она отсутствует, то предполагают наличие в материале токсических веществ. Отсутствие каких-либо видимых изменений в клетках в первом заражении и пассажах окончательно не исключает наличие вируса в исследуемом материале, т.к. некоторые вирусы не способны вызывать деструкции клеток. Полуперевиваемые культуры клеток. Полуперевиваемые культуры клеток – это культуры диплоидных клеток человека и животных. Это морфологически однородная популяция клеток, стабилизированная в процессе культивирования in vitro, имеющая ограниченный срок жизни, характеризующаяся тремя фазами (стабилизации, активного роста, старения), сохраняющая в процессе пассирования кариотип, свойственный исходной ткани, свободная от контаминантов. Линии диплоидных клеток пригодны к повторному диспергированию и росту, как правило не более 20 пассажей (теряют исходные свойства). Культуры диплоидных клеток получают из тканей человека путем серийных пассажей культур клеток, сохраняющих характерную диплоидную конфигурацию хромосом. Преимущество культур диплоидных клеток состоит в высокой чувствительности к различным вирусам. ИНДИКАЦИЯ ВИРУСОВ Обнаружение вируса в культуре клеток называется индикацией и осуществляется следующими методами:
Цитопатогенное действие вируса. Простейшим признаком, свидетельствующим о размножении вируса, являются дегенеративные изменения в клетках, то есть проявление цитопатогенного действия вируса. Наступившие видимые морфологические изменения в клетке называют цитопатогенным эффектом. Цитопатические изменения в инфицированных культурах клеток зависят от биологических свойств и дозы исследуемого вируса. Одни вирусы проявляют ЦПД в течение первой недели после заражения (вирус полиомиелита, Коксаки В), другие – спустя 1-2 недели после заражения (аденовирусы). Просмотр зараженных вирусом клеток проводят под малым увеличением микроскопа (рис. 1). Характер изменений при инфицировании клеточных культур классифицируется на следующие группы:
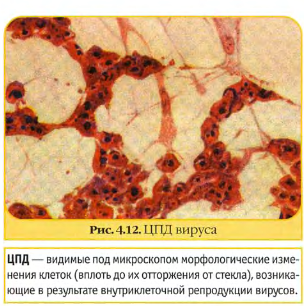 Рисунок 1. Цитопатогенное действие вируса. Обнаружение внутриклеточных включений. При репродукции некоторых вирусов внутри протоплазмы или ядра клетки образуются специфические включения. Для их обнаружения культуры клеток выращивают на специальных стеклянных пластинках, помещенных в стерильные пробирки с 2 мл клеточной суспензии. После образования монослоя клетки заражают вирусом и через определенные сроки в зависимости от свойств исследуемого вируса готовят препараты. Для морфологических исследований культуры клеток окрашивают обычными красителями (рис.2). 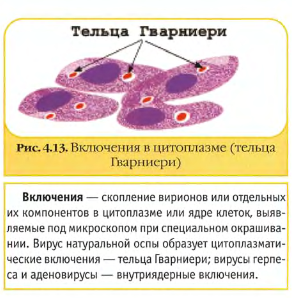 Рисунок 2. Включения в цитоплазме клеток. Обнаружение вирусов с помощью электронного микроскопа. В большинстве клеток, зараженных вирусом, под электронным микроскопом различают кристаллоподобные структуры с полигональным неупорядоченным содержимым. Именно в этих местах происходит репродукция вирусов, накопление созревших вирионов (рис.3).  Рисунок 3. Электронная микроскопия вируса герпеса. Образование бляшек. Размножение некоторых вирусов (энтеровирусов, арбовирусов, миксовирусов и др.) в культуре клеток можно выявить методом бляшек. В основе метода лежит появление в монослое зараженных клеток под агаровым покрытием обесцвеченных участков (бляшек). Бляшки представляют собой деструктивные клетки, разрушенные вирусом и неспособные окрашиваться в отличие от живых клеток (рис. 4). 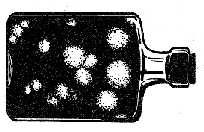 Рисунок 4. «Бляшки» (негативные колонии вируса). Реакция гемагглютинации. В основе РГА лежит способность некоторых вирусов агглютинировать эритроциты человека, отдельных видов животных и птиц. Впервые явление гемагглютинации эритроцитов вирусом гриппа было описано в 1941 г. Херстом. При вскрытии зараженных гриппом куриных эмбрионов исследователь установил, что кровь, вытекающая из пораженных сосудов, смешиваясь с вируссодержащей аллантоисной жидкостью, собирается в комочки. По РГА можно выявить не только наличие вируса в исследуемом материале, но и определить его гемагглютинирующий титр. РГА применяется для индикации вирусов гриппа, паргриппа, аденовирусной инфекции, кори, полиомиелита и др. В качестве исследуемого материала при геамагглютинации используют аллантоисную и амниотическую жидкость, суспензию хорионаллантоисных оболочек куриного эмбриона, взвеси и экстракты из органов животных, а также культуральную жидкость инфицированных клеток. Перед постановкой реакции испытуемый материал освобождается от крупных частиц ценртифугированием. Компоненты РГА: вирусосодержащий материал, взвесь эритроцитов человека или животных, физиологический раствор (рис.5). Техника постановки РГА. РГА можно ставить двумя методами: капельным методом на стекле и в пробирках или лунках пластин. Для постановки капельной реакции на чистое обезжиренное предметное стекло наносят каплю 5% взвеси эритроцитов и каплю вируссодержащего материала, тщательно перемешивают пипеткой. При положительной реакции через 1-2 минуты макроскопически обнаруживают появление агглютинации эритроцитов в виде хлопьев. Постановка РГА в пробирках. В штативе устанавливают 10-12 пробирок, в которых готовят последовательные разведения вируса. Затем во все пробирки вносят по 1 мл 1% взвеси эритроцитов. Содержимое пробирок тщательно перемешивают и оставляют для инкубации. При наличии гемагглютинирующего вируса в исследуемом материале агглютинированные эритроциты осядут на дно пробирки в виде зонтика с неровными зубчатыми краями. При отрицательной РГА эритроциты оседают на дно в виде точки с ровными гладкими краями. 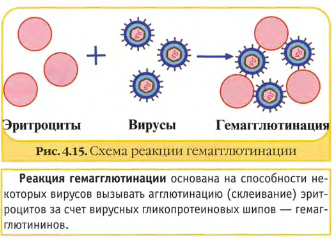 Рисунок 5. Схема реакции гемагглютинации. Реакция гемадсорбции. Сущность реакции гемадсорбции состоит в том, что на поверхности клеток, инфицированных вирусами, обладающими гемадсорбирующей активностью, адсорбируются эритроциты. Реакция гемадсорбци применяется при диагностики гриппа, парагриппа, клещевого энцефалита, оспы. Компоненты реакции гемадсорбции: пробирки с культурой клеток, зараженных вирусом, 0,5% взвесь эритроцитов (рис.6). Техника постановки реакции гемадсорбции. Для постановки реакции используют 10 пробирок с хорошо сформированным монослоем клеток. Культуры клеток заражают вирусосодержащим материалом. После 3-7 дневной инкубации добавляют в каждую пробирку 0,2 мл 0,5% стерильной суспензии эритроцитов, выдерживают в течение нескольких минут, затем встряхивают и просматривают под микроскопом. Зараженные вирусом клетки адсорбируют на своей поверхности эритроциты, не зараженные клетки эритроцитов не адсорбируют. 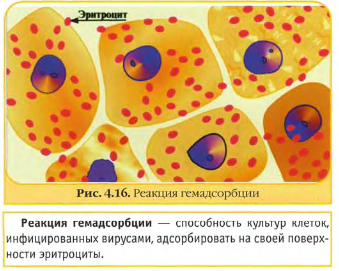 Рисунок 6. Реакция гемадсорбции. Цветная проба (колориметрический тест). Заражение клеточных культур цитопатогенным вирусом ведет к подавлению их метаболизма. Последнее можно определить колориметрическим методом (цветной пробой). Свежая питательная среда pH 7,4-7,8, содержащая феноловый красный, имеет красный цвет. Растущие клетки в процессе метаболизма продуцируют кислоту, что приводит к изменению цвета питательной среды на желтый. При заражении вирусом клетки погибают раньше, чем вырабатывают достаточное количество кислоты, чтобы изменить цвет среды на желтый. Таким образом красный цвет среды указывает на размножение вируса, желтый – на отсутствие вируса. ИДЕНТИФИКАЦИЯ ВИРУСОВ. Методы определения типа вирусов (в вируссодержащем материале) относятся к методам идентификации и основаны на нейтрализации вирусов типоспецифическими сыворотками:
Реакции нейтрализации. Реакции нейтрализации основаны на способности специфических гипериммунных сывороток нейтрализовать инфекционное действие гомологичного вируса в культуре клеток, курином эмбрионе, лабораторных животных. Выбор восприимчивой системы определяется свойствами испытуемого вируса. В реакции нейтрализации один из компонентов (вирус или сыворотка) должны быть обязательно известным и применяться в постоянной дозе. Второй (исследуемый) компонент применяется в различных разведениях (титруется). Постановка реакции нейтрализации в зависимости от цели осуществляется двумя вариантами. Применяют реакцию нейтрализации для выявления и определения титра специфических антител в сыворотках крови переболевших животных. В этом случае реакция нейтрализации ставится с постоянной дозой известного вируса и разными разведениями испытуемых сывороток. В сыворотках крови вируснейтрализующие антитела накапливаются, как правило, в период реконвалесценции и могут сохраняться в течение многих месяцев и даже лет. Динамика накопления и исчезновения вируснейтрализующих антител определяется в значительной степени биологией вируса. Так, при гриппе человека вируснейтрализующие антитела в высоких титрах определяются на 21-28-й день и содержание их уменьшается к 6 мес. При энцефалите антитела обнаруживаются через 1,5-2 месяца и сохраняются в течение длительного срока. Компоненты реакций нейтрализации: 1) вирус известного вида (типа) для серологической диагностики заболевания или исследуемый вирус для идентификации; 2) сыворотка, специфическая для идентификации выделенного вируса, или исследуемая сыворотка для серологической диагностики заболевания. Реакция торможения (задержки) гемагглютинации. Реакция торможения гемагглютинации (РТГА) основана на свойстве специфических антисывороток подавлять (тормозить) гемагглютинирующую способность вирусов. Реакция используется для идентификации неизвестного вируса (по известной специфической сыворотке) или для определения специфических антител в сыворотке переболевших животных (по известному вирусному антигену). Компоненты РТГА: вирус, специфическая гипериммунная сыворотка, 1% взвесь эритроцитов, физиологический раствор. При использовании РТГА для серологической диагностики вирусных инфекций парные сыворотки больных титруют с несколькими вирусными антигенами. Специфичность последних, равно как и рабочий титр, заранее проверяются посредством эталонных специфических сывороток. Положительным результатом РТГА считается отсутствие гемагглютинации в пробирке с большой концентрацией сыворотки. При использовании РТГА для идентификации выделенного вируса испытуемый вирус относится к тому виду (типу), сыворотка которого вызвала его нейтрализацию и торможение реакции гемагглютинации. Идентификация вирусов при помощи флюоресцирующих антител. В основу метода иммунофлюоресцирующих антител положено свойство антител при окрашивании флюорохромами флюоресцировать (светиться) в ультрафеолетовых лучах. Коньюгированные флюорохромами иммунные сыворотки называются «мечеными» При взаимодействии с гомологичным антигеном в клетках ткани или мазках меченые антитела фиксируются, образуя прочный комплекс антиген-антитело. В люминесцентном микроскопе фиксированные антитела излучают свечение, цвет которого зависит от флюорохрома, использованного для коньюгации. В том случае, если меченый глобулин не гомологичен исследуемому антигену, комплекс антиген-антитело не образуется и флюоресцирующий гамма-глобулин легко удаляется при следующей промывке. Методы РИФ просты, высокочувствительны, специфичны, позволяют в течение короткого времени диагностировать заболевание. Для приготовления препаратов необходимы: исследуемый материал (мазки-отпечатки из органов и тканей больных животных, органы и ткани здоровых животных, культуры клеток, инфицированные вирусом и незараженные культуры клеток), коньюгированный гомологичный гамма-глобулин или коньюгированные специфические сыворотки, отрицательная коньюгированная сыворотка. Техника постановки. На предметное стекло делают мазки-отпечатки из патологического материала, предназначенного для исследования. Препарат фиксируют ацетоном в течение 10 минут с последующим высушиванием в течение 20 минут при 37С. На исследуемые препараты наслаивают флюоресцирующий специфический глобулин. Препараты помещают во влажную камеру и окрашивают при комнатной температуре в течение 30 минут. Затем дважды тщательно промывают фосфатным буферным раствором, высушивают. На препараты наносят каплю забуференного глицерина, накрывают покровным стеклом, просматривают под иммерсионной системой люминесцентного микроскопа в отраженном свете. В положительных случаях специфические антитела, фиксирующиеся в местах расположения вирусного антигена, обнаруживают по свечению. ЛИТЕРАТУРА:
ОГЛАВЛЕНИЕ
а) строение куриного эмбриона; 4 б) методы заражения куриных эмбрионов; 5
а) первично-трипсинизированные; 8 б) перевиваемые; 9 в) полуперевиваемые; 15 III. ИНДИКАЦИЯ ВИРУСОВ 16
|
