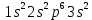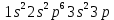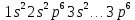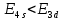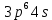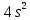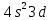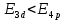Курс лекций. Курс лекций ОЭФ(Кв) 14 (копия). Курс лекций по дисциплине Общая и экспериментальная физика для студентов ВлГУ
 Скачать 7.12 Mb. Скачать 7.12 Mb.
|
|
Лекция 12. Спектры атомов. Спектральный анализ. План лекции: Спектральные серии атома водорода. Виды спектров. Спектральный анализ и его применения. При экспериментальном изучении спектра водорода, группа швейцарских физиков: Лайман, Бальмер, Пашен и другие обнаружили, что линии водородного спектра объединены в группы (спектральные серии). Объясним сериальную структуру на основе теории Бора. Набор длин волн каждой серии определяется формулой 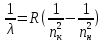 .Спектральная серия- это набор длин волн, полученных при переходе атома в одно конечное состояние. В видимой области спектра была получена спектральная серия Бальмера (nк=2), в ультрафиолетовой области - серия Лаймана (nк=1), в инфракрасной были получены три спектральных серии: серия Пашена (nк=3), серия Пфунда (nк=4), серия Брекета (nк=5) (см. рисунок). .Спектральная серия- это набор длин волн, полученных при переходе атома в одно конечное состояние. В видимой области спектра была получена спектральная серия Бальмера (nк=2), в ультрафиолетовой области - серия Лаймана (nк=1), в инфракрасной были получены три спектральных серии: серия Пашена (nк=3), серия Пфунда (nк=4), серия Брекета (nк=5) (см. рисунок).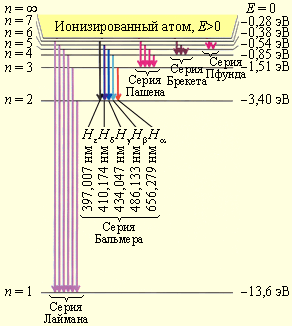 Запишем формулы интервала длин волн для каждой серии, исходя из теории Бора: 1 ) серия Лаймана – самая коротковолновая (nк=1): 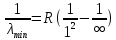 , , 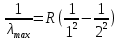 , ,2 ) серия Бальмера (nк=2): 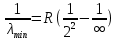 , , 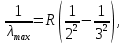 3 ) серия Пашена (nк=3): 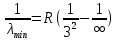 , , 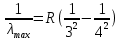 , ,4 ) серия (nк=4) Брекета: 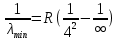 , , 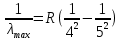 , ,5 ) серия (nк=5) Пфунда: 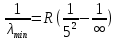 , , 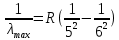 . .Таким образом, Боровская теория справедлива для атома водорода и водородоподобных систем. Для многоэлектронных атомов и молекул необходимо учитывать законы квантовой физики. Многоэлектронные атомы также характеризуются линейчатыми спектрами. Опыты показывают, что атомы различных элементов имеют разные наборы спектральных линий. Эмиссионный линейчатый спектр атомов азота. 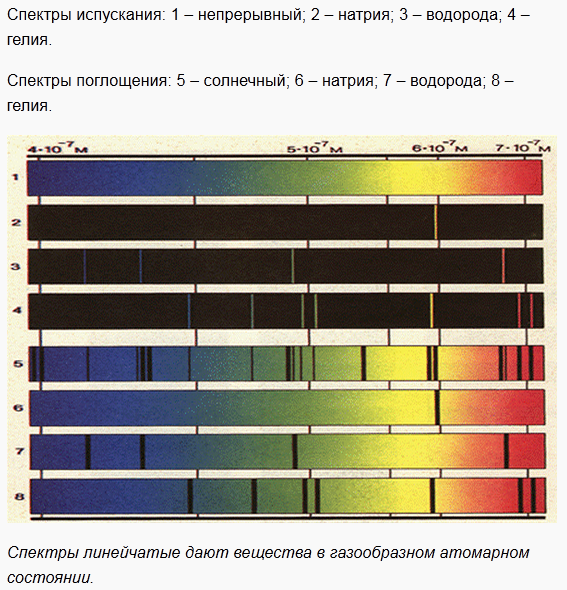 Это позволяет применять спектры для определения состава неизвестных веществ (сплавов, порошков и т.п.), что лежит в основе спектрального анализа. Спектральный анализ - это физический метод определения химического состава вещества, основанный на исследовании спектров испускания и поглощения атомов или молекул. Различные типы спектрального анализа следует рассматривать с трёх точек зрения. I. По решаемым задачам: Элементный, когда устанавливается состав пробы по элементам; Изотопный, когда устанавливается состав пробы по изотопам; Молекулярный, когда устанавливается молекулярный состав пробы; Структурный, когда устанавливаются структурные составляющие молекулярного соединения. II. По применяемым методам: Эмиссионный спектральный анализ, использующий спектры излучения, главным образом, атомов. Абсорбционный спектральный анализ, использующий спектры поглощения, главным образом, молекул; возможен и по спектрам поглощения атомов. Метод, использующий спектры комбинационного рассеяния твёрдых, жидких и газообразных проб. Люминесцентный, использующий спектры люминесценции вещества, возбуждаемые, главным образом, ультрафиолетовым излучением или катодными лучами. 5. Рентгеновский, использующий рентгеновские спектры атомов и дифракцию рентгеновских лучей при прохождении их через исследуемый образец. 6. Радиоспектроскопический, использующий спектры поглощения молекул с длинами волн больше 1 мм. III. По характеру получаемых результатов: Качественный, по результатам которого определяется состав. Полуколичественный, в результате которого даётся приблизительная оценка содержания определяемых элементов в процентах. Количественный, который позволяет точно определить количественное содержание элементов или соединений в пробе. IV. По способу регистрации спектров различают следующие методы: Визуальные при наблюдении спектров в видимой области с помощью простых или специализированных спектроскопов (стилоскоп, стилометр). Применение электронно-оптических преобразователей позволяет визуально наблюдать спектры в ультрафиолетовой и ближней инфракрасной областях (до 12000Å). Фотографические, использующие фотопленку или фото-пластинку для регистрации спектров. Фотоэлектрические, использующие фотоэлементы, фото- умножители и фотосопротивления, иногда с кристаллами – сцинтилляторами. Термоэлектрические для инфракрасной области с использованием термоэлементов, болометров и других термоэлектрических приемников. Чувствительность спектрального анализа, как правило, очень высока. Минимальная концентрация определяемого вещества, которая может быть обнаружена и измерена спектральными методами, колеблется в широких пределах в зависимости от свойств этого вещества и состава анализируемой пробы. Для большинства металлов и ряда других элементов сравнительно легко достигается чувствительность 10-3 – 10-4 %, а для некоторых веществ 10-5 – 10-6 %. Благодаря высокой чувствительности спектральный анализ широко применяется для анализа чистых и особо чистых металлов, в геохимии и почвоведении для определения микроконцентраций различных элементов, в производстве полупроводниковых материалов и материалов атомной энергетики. Точность атомного спектрального анализа зависит от состава и структуры анализируемых объектов. При анализе образцов, близких по своей структуре и составу, можно легко достигать высокой точности. Ошибка в этом случае не превышает ±1 – 3 % по отношению к определяемой величине. Спектральный анализ точнее химического в области малых концентраций. Скорость спектрального анализа обычно значительно превышает скорость выполнения анализа другими методами. Это объясняется тем, что при проведении анализа по спектрам не требуется предварительного разделения пробы на отдельные компоненты, сам анализ выполняется очень быстро. Так, при применении современных методов спектрального анализа точное количественное определение нескольких компонентов в сложном образце занимает всего несколько минут. Производительность анализа, связанная с высокой скоростью, достаточно большая, что очень существенно при массовых анализах. Благодаря большой производительности, малым расходам реактивов и других материалов стоимость анализа мала, несмотря на затраты на оборудование. Спектральный анализ позволяет подойти к полной автоматизации определения химического состава вещества и является универсальным методом. С его помощью можно определить практически любые элементы в самых разнообразных твердых, жидких и газообразных анализируемых объектах. Для спектрального анализа характерна высокая избирательность. Это означает, что почти каждое вещество может быть качественно и количественно определено в сложной пробе, без ее разделения на составляющие. Благодаря перечисленным особенностям спектральный анализ во многих случаях оказывается предпочтительным по сравнению с химическим анализом, и поэтому он находит весьма широкое применение. В металлургии при производстве качественных сталей проводится непрерывный экспресс-анализ по ходу плавки, чтобы строго выдерживать необходимый процентный состав легирующих присадок. Аналогично в химическом производстве часто требуется проводить целые серии спектральных анализов для контроля за ходом технологического процесса, например, при синтезе новых соединений, при производстве витаминов, фармацевтических препаратов, полимеров и др. При проведении геологоразведочных работ применяется так называемая металлографическая съемка во время поисков редких рассеянных элементов. На больших площадях в определенном порядке производится забор проб грунта с последующим быстрым их анализом в поисковых спектральных лабораториях. Полученные данные о концентрациях элементов наносятся на карту. Это позволяет определить места с повышенным содержанием рассеянных редких элементов. Спектральный анализ сравнительно легко и с большой чувствительностью позволяет определять присутствие ничтожных примесей в веществах, поэтому он находит применение при контроле чистоты некоторых сверхчистых материалов, которые требуются в современной технике. Так современная атомная промышленность, используя очень чистые материалы, выдвинула требование значительного повышения чувствительности анализа. Полупроводниковая промышленность еще более требовательна в этом отношении. Промышленность изотопов поставила задачу количественного контроля изотопного состава вещества, когда химические свойства определяемых компонентов практически неразличимы, и с помощью химического анализа невозможно обеспечить контроль смесей изотопов. Важное значение имеют спектральные лаборатории в медицинских исследовательских учреждениях и клиниках, например, для определения патологического влияния микроэлементов на функции отдельных органов человеческого организма, в санитарно-эпидемиологических лабораториях для определения качества питьевой воды, пищи, степени заражения воздуха. В агротехнических лабораториях спектральный анализ используется для составления почвенных карт, для анализа влияния различных добавок в удобрения на развитие растений. Спектральный анализ иногда находит применение в самых неожиданных направлениях: в криминалистике и судебной медицине, археологии, искусствоведении и т.д. Перечисленные примеры относятся в основном к применению эмиссионного спектрального анализа. Большое значение имеет также абсорбционный анализ. Известно, что линии Фраунгофера в спектре Солнца являются линиями поглощения атомов и ионов в поверхностном слое солнца. Они дают возможность произвести качественный спектральный анализ излучения. Это относится и к спектрам звезд. Таким образом, спектральный анализ является мощным физическим методом, утверждающим материальное единство мира и его познаваемость. В спектральном анализе применяются различные спектральные приборы: стиллоскопы, монохроматоры, спектрографы и др.  Лекция 13. Многоэлектронные атомы в квантовой механике. План лекции. Квантовые числа. Принцип Паули. Строение многоэлектронных атомов. Периодическая система элементов Менделеева. Основным законом в квантовой механике является уравнение Шредингера. Следовательно, решая уравнение Шредингера можно описать состояние атома в любой системе. Уравнение Шредингера имеет решение не при любых значениях, входящих в него параметров. Те параметры, при которых уравнение Шредингера имеет решение, называют квантовые числа. 1.Решая уравнение относительно энергии, получим: 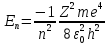 , где n – главное квантовое число. n=1,2,3,…, , где n – главное квантовое число. n=1,2,3,…, . .2.Решая относительно момента импульса электрона в атоме, получим: 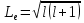 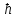 , где l – орбитальное квантовое число. l=0,1,2,…,n-1. , где l – орбитальное квантовое число. l=0,1,2,…,n-1.3.m – магнитное квантовое число. m= 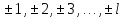 . .4.s – спиновое квантовое число (спин частицы ) 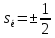 . .Смысл квантовых чисел: 1) 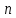 - главное квантовое число в основном определяет значение энергии и удаление электрона от ядра. - главное квантовое число в основном определяет значение энергии и удаление электрона от ядра.2) 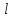 - орбитальное квантовое число характеризует величину механического орбитального момента электрона. - орбитальное квантовое число характеризует величину механического орбитального момента электрона.3) 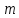 - магнитное квантовое число характеризует магнитный момент орбитального движения. - магнитное квантовое число характеризует магнитный момент орбитального движения.4) 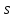 - спин – это свойство микрообъектов электрона, характеризующее собственное движение электронов. - спин – это свойство микрообъектов электрона, характеризующее собственное движение электронов. Таким образом, Решая уравнение Шредингера можно получить волновую функцию, которая зависит от четверки квантовых чисел 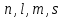 .; задание этой четверки чисел характеризует состояние атома; .; задание этой четверки чисел характеризует состояние атома; 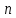 - максимальное квантовое число; - максимальное квантовое число; 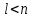 ; ; 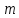 не превышает не превышает 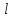 ; ; 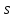 принимает два значения для электрона. принимает два значения для электрона.Например, для электрона в состоянии с минимальной энергией имеем: 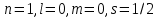 . . Будем считать, что каждый электрон в атоме находится в силовом поле ядра, взаимодействием пренебрегаем. Рассмотрим, каким законам подчиняется распределение электронов по энергетическим состояниям в многоэлектронном атоме. В 1925г. Паули сформулировал закон, справедливый для любого атома. Принцип гласит: никакие два электрона в атоме не могут находиться в одном энергетическом состоянии, или: никакие два электрона в атоме не могут иметь одинаковый набор квантовых чисел. Таким образом, распределение электронов по состояниям в многоэлектронном атоме подчиняется двум законам: 1) система частиц стабильна, когда энергия ее минимальна; 2) в каждом квантовом состоянии может находиться только один электрон. Если для электронов в атоме 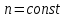 ,то эти электроны обладают одинаковым значением энергии, о таких электронах говорят, что они находятся на одной электронной оболочке. Обозначение оболочек приведены в таблице. ,то эти электроны обладают одинаковым значением энергии, о таких электронах говорят, что они находятся на одной электронной оболочке. Обозначение оболочек приведены в таблице.
Если 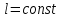 – энергии таких электронов еще больше совпадают по значению – эти электроны находятся на одной электронной подоболочке. Обозначения подоболочек указаны в таблице. – энергии таких электронов еще больше совпадают по значению – эти электроны находятся на одной электронной подоболочке. Обозначения подоболочек указаны в таблице.
Записывая состояние электрона указывают не четверку квантовых чисел, а только два квантовых числа n и l. Пример. Состояние 1s, то есть n=1 –К-оболочка, l=0 – s-подоболочка. Следовательно, электроны в многоэлектронном атоме распределяются по оболочкам и подоболочкам. В соответствии с принципом Паули максимальное число электронов на каждой оболочке и подоболочке вполне определенное. На подоболочке максимальное количество электронов равно 2(2 l +1), а на оболочке 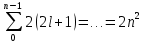 . .Электронные оболочки и подоболочки с max количеством электронов называются замкнутыми. Распределение электронов по оболочкам и подоболочкам представлено в таблицах.
Если химические элементы расположить в порядке возрастания атомных номеров, то элементы с одинаковыми свойствами повторяются через определенный интервал. В периодах наблюдается равномерный переход от активных металлов к менее активным металлам, к слабо активным неметаллам, к активным неметаллам, инертный газ. Первая группа– щелочные металлы, самые активные. В группе наблюдается регулярное изменение свойств, но менее заметное, чем внутри периода. Химическая активность щелочных металлов первой группы увеличивается с увеличением атомного номера, а у галогенов 7 группы наоборот. Периодичность изменения свойств объясняется заполнением электронных оболочек.
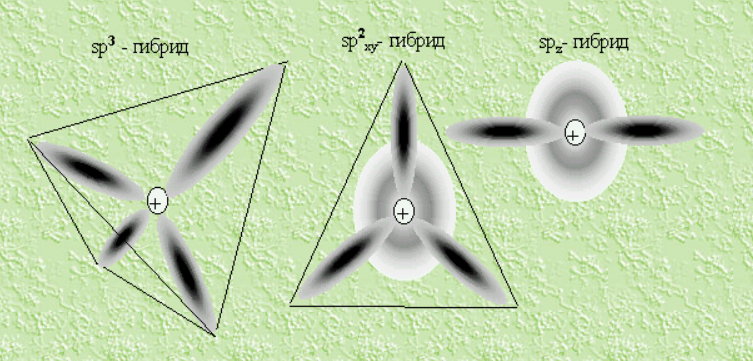  Распределение электронной плотности в атоме углерода в различных состояниях (рисунок слева) Объединение атомов в молекулы образует сложную структуру. На рисунке (справа) представлена одна из сложнейших органических молекул – структура ДНК (дезоксирибонуклеиновой кислоты). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

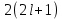
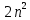
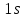 – начало заполнения К оболочки
– начало заполнения К оболочки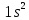 – заполненная электронная оболочка,
– заполненная электронная оболочка, 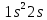 – начало заполнения L оболочки, атом активен.
– начало заполнения L оболочки, атом активен.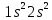
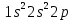
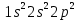
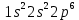 – заполнена L оболочка, не активен.
– заполнена L оболочка, не активен. 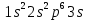 – начало заполнения M оболочки, активен.
– начало заполнения M оболочки, активен.