Курс лекций по нормальной физиологии. Ю. И. Савченков. Красноярск Издво , 2012, 470 с
 Скачать 8.6 Mb. Скачать 8.6 Mb.
|
Лекция 13. ФИЗИОЛОГИЯ ГЕМОСТАЗА.13.1. Свертывание крови: понятие, ферментативная теория (Шмидт, Моравиц), факторы свертывания, роль тромбоцитов.Сущность и значение свертывания крови. Если выпущенную из кровеносного сосуда кровь оставить на некоторое время, то из жидкости она вначале превращается в желе, а затем в крови организуется более или менее плотный сгусток, который, сокращаясь, выжимает из себя жидкость, называемую кровяной сывороткой. Это - плазма, лишенная фибрина. Описанный процесс называется свертыванием крови (гемокоагуляцией). Его сущность заключается в том, что растворенный в плазме белок фибриноген в определенных условиях переходит в нерастворимое состояние и выпадает в осадок в виде длинных нитей фибрина. В ячейках этих нитей, как в сетке, застревают клетки и коллоидное состояние крови в целом меняется. Значение этого процесса заключается в том, что свернувшаяся кровь не вытекает из раненного сосуда, предотвращая смерть организма от кровопотери. Первыми в процесс гемостаза включаются тромбоциты крови. Тромбоциты, или кровяные пластинки, образуются из гигантских клеток красного костного мозга — мегакариоцитов. В кровотоке тромбоциты имеют круглую или слегка овальную форму, диаметр их не превышает 2—3 мкм. У тромбоцита нет ядра, но имеется большое количество гранул (до 200) различного строения. При соприкосновении с поверхностью, отличающейся по своим свойствам от эндотелия, тромбоцит активируется, распластывается и у него появляется до 10 зазубрин и отростков, которые могут в 5—10 раз превышать диаметр тромбоцита. Наличие этих отростков важно для остановки кровотечения. В норме число тромбоцитов у здорового человека составляет 2—4-1011 /л, или 200—400 тыс. в 1 мкл. Увеличение числа тромбоцитов носит наименование «тромбоцитоз», уменьшение — «тромбоцитопения». В естественных условиях число тромбоцитов подвержено значительным колебаниям (количество их возрастает при болевом раздражении, физической нагрузке, стрессе), но редко выходит за пределы нормы. Как правило, тромбоцитопения является признаком патологии и наблюдается при лучевой болезни, врожденных и приобретенных заболеваниях системы крови. Основное назначение тромбоцитов — участие в процессе гемостаза Важная роль в этой реакции принадлежит так называемым тромбоцитарным факторам, которые сосредоточены главным образом в гранулах и мембране тромбоцитов. Тромбоциты принимают участие в защите организма от чужеродных агентов. Они обладают фагоцитарной активностью, содержат IgG, являются источником лизоцима и β-лизинов, способных разрушать мембрану некоторых бактерий. Кроме того, в их составе обнаружены пептидные факторы, вызывающие превращение «нулевых» лимфоцитов (0-лимфоциты) в Т- и В-лимфоциты. Эти соединения в процессе активации тромбоцитов выделяются в кровь и при травме сосудов защищают организм от попадания болезнетворных микроорганизмов. Регуляторами тромбоцитопоэза являются тромбоцитопоэтины кратковременного и длительного действия. Они образуются в костном мозге, селезенке, печени, а также входят в состав мегакариоцитов и тромбоцитов. Тромбоцитопоэтины кратковременного действия усиливают отшнуровку кровяных пластинок от мегакариоцитов и ускоряют их поступление в кровь; тромбоцитопоэтины длительного действия способствуют переходу предшественников гигантских клеток костного мозга в зрелые мегакариоциты. Сосудисто-тромбоцитарный гемостаз. Сосудисто-тромбоцитарный гемостаз сводится к образованию тромбоцитарной пробки, или тромбоцитарного тромба. Условно его разделяют на три стадии: 1) временный (первичный) спазм сосудов; 2) образование тромбоцитарной пробки за счет адгезии (прикрепления к поврежденной поверхности) и агрегации (склеивания между собой) тромбоцитов; 3) ретракция (сокращение и уплотнение) тромбоцитарной пробки. Сразу после травмы наблюдается первичный спазм кровеносных сосудов, благодаря чему кровотечение в первые секунды может не возникнуть или носит ограниченный характер. Первичный спазм сосудов обусловлен выбросом в кровь в ответ на болевое раздражение адреналина и норадреналина и длится не более 10—15 с. В дальнейшем наступает вторичный спазм, обусловленный активацией тромбоцитов и отдачей в кровь сосудосуживающих агентов — серотонина, ТхА2, адреналина и др. Повреждение сосудов сопровождается немедленной активацией тромбоцитов, что обусловлено появлением высоких концентраций АДФ (из разрушающихся эритроцитов и травмированных сосудов), а также с обнажением субэндотелия, коллагеновых и фибриллярных структур. В результате «раскрываются» вторичные рецепторы и создаются оптимальные условия для адгезии, агрегации и образования тромбоцитарной пробки. Адгезия обусловлена наличием в плазме и тромбоцитах особого белка — фактора Виллебранда (FW), имеющего три активных центра, два из которых связываются с экспрессированными рецепторами тромбоцитов, а один — с рецепторами субэндотелия и коллагеновых волокон. Таким образом, тромбоцит с помощью FW оказывается «подвешенным» к травмированной поверхности сосуда. Одновременно с адгезией наступает агрегация тромбоцитов, осуществляемая с помощью фибриногена — белка, содержащегося в плазме и тромбоцитах и образующего между ними связующие мостики, что и приводит к появлению тромбоцитарной пробки. Сначала (в течение 1-2 минут) кровь еще проходит через эту рыхлую пробку, но затем происходит т.н. вискозное перерождение тромба, он уплотняется и кровотечение останавливается. Понятно что такой конец событий возможен только при ранении мелких сосудов, там, где артериальное давление не в состоянии выдавить этот "гвоздь". Важную роль в адгезии и агрегации играет комплекс белков и полипептидов, получивших наименование «интегрины». Последние служат связующими агентами между отдельными тромбоцитами (при склеивании друг с другом) и структурами поврежденного сосуда. Агрегация тромбоцитов может носить обратимый характер (вслед за агрегацией наступает дезагрегация, т. е. распад агрегатов), что зависит от недостаточной дозы агрегирующего (активирующего) агента. Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются гранулы и содержащиеся в них биологически активные соединения — АДФ, адреналин, норадреналин и др. (этот процесс получил название реакции высвобождения), что приводит к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образованием тромбина, усиливающего агрегацию и приводящего к появлению сети фибрина, в которой застревают отдельные эритроциты и лейкоциты. Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, т. е. наступает ее ретракция. В норме остановка кровотечения из мелких сосудов занимает 2—4 мин. Важную роль для сосудисто-тромбоцитарного гемостаза играют производные арахидоновой кислоты — простагландин I2 (PgI2), или простациклин, и ТхА2. При сохранении целости эндотелиального покрова действие Pgl преобладает над ТхА2, благодаря чему в сосудистом русле не наблюдается адгезии и агрегации тромбоцитов. При повреждении эндотелия в месте травмы синтез Pgl не происходит, и тогда проявляется влияние ТхА2, приводящее к образованию тромбоцитарной пробки. Факторы свертывания. За последние 50 лет было открыто множество веществ, принимающих участие в свертывании крови, белков, отсутствие которых в организме приводит к гемофилии (не свертываемости крови). Рассмотрев все эти вещества, международная конференция гемокоагулологов постановила обозначить все плазменные факторы свертывания римскими цифрами, клеточные - арабскими. Это было сделано для того, чтобы исключить путаницу в названиях. И теперь в любой стране после общепринятого в ней названия фактора (они могут быть разными) обязательно указывается номер этого фактора по международной номенклатуре. Имеется три группы факторов, участвующих в коагуляционном гемостазе. Плазменные факторы свертывания. I. Фибрин и фибриноген. Фибрин - конечный продукт реакции свертывания крови. В плазме содержится 2-4 г/л. Место образования - ретикулоэндотелиальная система, печень, костный мозг. II. Тромбин и протромбин. В цельной крови содержится 15-20 мг% протромбина. Этого содержания в избытке хватает для того, чтобы перевести весь фибриноген крови в фибрин. Важную роль в его образовании в печени играет антигеморрагический витамин К. III. Тромбопластин. В крови этого фактора в активном виде нет. Он образуется при повреждении клеток крови и тканей и может быть соответственно кровяной, тканевой, эритроцитарный, тромбоцитарный. По своей структуре это фосфолипид, аналогичный фосфолипидам клеточных мембран. Тромбопластин участвует как обязательный компонент в первой фазе свертывания крови. IV. Кальций ионизированный, Са++. Кальций необходим не только для превращения протромбина в тромбин, но для других промежуточных этапов гемостаза, во всех фазах свертывания. Содержание ионов кальция в крови 9-12 мг%. V и VI. Проакцелерин и акцелерин (АС-глобулин). Образуется в печени. Является ускорителем (акцелератором) многих ферментативных реакций свертывания. VII. Проконвертин и конвертин. Этот фактор является белком, входящим в бета-глобулиновую фракцию нормальной плазмы или сыворотки. Активирует тканевую протромбиназу. VIII. Антигемофилический глобулин А (АГГ-А). IX. Антигемофилический глобулин В (АГГ-В, Кристмас-фактор) X. Фактор Коллера, Стьюард-Прауэр-фактор. XI. Фактор Розенталя, плазменный предшественник тромбопластина (ППТ). XII. Фактор контакта, Хагеман-фактор. Играет роль пускового механизма в свертывании крови. Контакт этого глобулина с чужеродной поверхностью (шероховатость стенки сосуда, поврежденные клетки т.п.) приводит к активации фактора и инициирует всю цепь процессов свертывания. XIII. Фибринстабилизатор Лаки-Лоранда. Необходим для образования окончательно нерастворимого фибрина. Это - транспептидаза, которая сшивает отдельные нити фибрина пептидными связями, способствуя его полимеризации. Описанные 13 факторов являются общепризнанными основными компонентами, необходимыми для нормального процесса свертывания крови. Вызываемые их отсутствием различные формы кровоточивости относятся к разным видам гемофилий. В последние годы были обнаружены и другие факторы свертывания, которые еще не утверждены международной классификацией. Клеточные факторы свертывания. Наряду с плазменными факторами первостепенную роль в свертывании крови играют и клеточные, выделяющиеся из клеток крови. Больше всего их содержится в тромбоцитах, но есть они и в других клетках. Просто при гемокоагуляции тромбоциты разрушаются в большем количестве, чем, скажем, эритроциты или лейкоциты, поэтому наибольшее значение в свертывании имеют именно тромбоцитарные факторы. К ним относятся: Ф1. АС-глобулин тромбоцитов. Подобен V-VI факторам крови, выполняет те же функции, ускоряя образование протромбиназы. Ф2. Тромбин-акцелератор. Ускоряет действие тромбина. Ф3. Тромбопластический или фосполипидный фактор. Находится в гранулах в неактивном состоянии, и может использоваться только после разрушения тромбоцитов. Активируется при контакте с кровью, необходим для образования протромбиназы. Ф4. Антигепариновый фактор. Связывает гепарин и задерживает его антикоагулирующий эффект. Ф5. Тромбоцитарный фибриноген. Необходим для агрегации кровяных пластинок, вязкого их метаморфоза и консолидации тромбоцитарной пробки. Находится и внутри и снаружи тромбоцита. способствует их склеиванию. Ф6. Ретрактозим. Обеспечивает уплотнение тромба. В его составе определяют несколько субстанций, например тромбостенин +АТФ +глюкоза. Ф7. Антифибинозилин. Тормозит фибринолиз. Ф8. Серотонин. Вазоконстриктор. Экзогенный фактор, 90% синтезируется в слизистой ЖКТ, остальные 10% - в тромбоцитах и ЦНС. Выделяется из клеток при их разрушении, способствует спазму мелких сосудов, те самым способствуя предотвращению кровотечения. Всего в тромбоцитах находят до 14 факторов, таких еще, как антитромбопластин, фибриназа, активатор плазминогена, стабилизатор АС-глобулина, фактор агрегации тромбоцитов и др. В других клетках крови в основном находятся эти же факторы, но заметной роли в гемокоагуляции в норме они не играют. Тканевые факторы свертывания. Участвуют во всех фазах. Сюда относятся активные тромбопластические факторы, подобные III, VII,IX,XII,XIII факторам плазмы. В тканях есть активаторы V и VI факторов. Много гепарина, особенно в легких, предстательной железе, почках. Есть и антигепариновые вещества. Особенно важны вещества, содержащиеся в сосудистой стенке. Все эти соединения постоянно поступают из стенок сосудов в кровь и осуществляют регуляцию свертывания. Ткани обеспечивают также и выведение продуктов свертывания из сосудов. 13.2. Вторичный (коагуляционный) гемостаз: последовательность процессов (3 фазы, факторы, участвующие в каждой фазе, схема, отражающая процесс взаимодействия этих факторов), оценка состояния системы вторичного гемостаза. Ферментативная теория свертывания. Первая теория, объясняющая процесс свертывания крови работой специальных ферментов, была разработана в 1902 г. русским ученым Шмидтом. Он считал, что свертывание протекает в две фазы. В первую фазу один из белков плазмы протромбин под влиянием освобождающихся из разрушенных при травме клеток крови, особенно тромбоцитов, ферментов (тромбокиназы) и ионов Са переходит в фермент тромбин. На второй стадии под влиянием фермента тромбина растворенный в крови фибриноген превращается в нерастворимый фибрин, который и заставляет кровь свертываться. В последние годы жизни Шмидт стал выделять в процессе гемокоагуляции уже 3 фазы: 1- образование тромбокиназы, 2- образование тромбина. 3- образование фибрина. Дальнейшее изучение механизмов свертывания показало, что это представление весьма схематично и не полностью отражает весь процесс. Основное заключается в том, что в организме отсутствует активная тромбокиназа, т.е. фермент, способный превратить протромбин в тромбин (по новой номенклатуре ферментов этот следует называть протромбиназой). Оказалось, что процесс образования протромбиназы очень сложен, в нем участвует целый ряд т.н. тромбогенных белков-ферментов, или тромбогенных факторов, которые, взаимодействуя в каскадном процессе, все необходимы для того, чтобы свертывание крови осуществилось нормально. Кроме того, было обнаружено, что процесс свертывания не кончается образованием фибрина, ибо одновременно начинается его разрушение. Таким образом, современная схема свертывания крови значительно сложнее Шмидтовой. Современная схема свертывания крови включает в себя 5 фаз, последовательно сменяющих друг друга. Фазы эти следующие: образование протромбиназы, образование тромбина, образование фибрина, полимеризация фибрина и организация сгустка, фибринолиз. Современная схема гемостаза. Цепная реакция свертывания крови начинается с момента соприкосновения крови с шероховатой поверхностью раненного сосуда или тканью. Это вызывает активацию тромбопластических факторов плазмы и затем происходит поэтапное образование двух отчетливо различающихся по своим свойствам протромбиназ - кровяной и тканевой.. Однако прежде, чем закончится цепная реакция образования протромбиназы, в месте повреждения сосуда происходят процессы, связанные с участием тромбоцитов (т.н. сосудисто-тромбоцитарный гемостаз). Тромбоциты за счет своей способности к адгезии налипают на поврежденный участок сосуда, налипают друг на друга, склеиваясь тромбоцитарным фибриногеном. Все это приводит к образованию т.н. пластинчатого тромба ("тромбоцитарный гемостатический гвоздь Гайема"). Адгезия тромбоцитов происходит за счет АДФ, выделяющейся из эндотелия и эритроцитов. Этот процесс активируется коллагеном стенки, серотонином, XIII фактором и продуктами контактной активации. Сначала (в течение 1-2 минут) кровь еще проходит через эту рыхлую пробку, но затем происходит т.н. вискозное перерождение тромба, он уплотняется и кровотечение останавливается. Понятно что такой конец событий возможен только при ранении мелких сосудов, там, где артериальное давление не в состоянии выдавить этот "гвоздь". 1 фаза свертывания. В ходе первой фазы свертывания, фазе образования протромбиназы, различают два процесса, которые протекают с разной скоростью и имеют различное значение. Это - процесс образования кровяной протромбиназы, и процесс образования тканевой протромбиназы. Длительность 1 фазы составляет 3-4 минуты. однако, на образование тканевой протромбиназы тратится всего 3-6 секунд. Количество образующейся тканевой протромбиназы очень мало, ее недостаточно для перевода протромбина в тромбин, однако тканевая протромбиназа выполняет роль активатора целого ряда факторов, необходимых для быстрого образования кровяной протромбиназы. В частности, тканевая протромбиназа приводит к образованию малого количества тромбина, который переводит в активное состояние V и VIII факторы внутреннего звена коагуляции. Каскад реакций, заканчивающихся образованием тканевой протромбиназы (внешний механизм гемокоагуляции), выглядит следующим образом: 1. Контакт разрушенных тканей с кровью и активация III фактора - тромбопластина. 2. III фактор переводит VII в VIIa (проконвертин в конвертин). 3.Образуется комплекс (Ca++ + III + VIIIa) 4. Этот комплекс активирует небольшое количество Х фактора - Х переходит в Ха. 5. (Хa + III + Va + Ca) образуют комплекс, который и обладает всеми свойствами тканевой протромбиназы. Наличие Va (VI) связано с тем, что в крови всегда есть следы тромбина, который активирует V фактор. 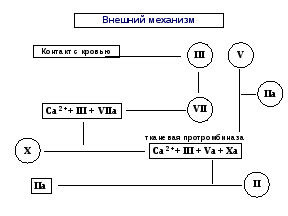 Рис. 15. Внешний механизм образования протромбназы в первую фазу гемокоагуляции. 6. Образовавшееся небольшое количество тканевой протромбиназы переводит небольшое количество протромбина в тромбин. 7. Тромбин активирует достаточное количество V и VIII факторов, необходимых для образования кровяной протромбиназы. В случае выключения этого каскада (например, если со всею предосторожностью с использованием парафинированных игл, взять кровь из вены, предотвратив ее контакт с тканями и с шероховатой поверхностью, и поместить ее в парафинированную пробирку), кровь свертывается очень медленно, в течение 20-25 минут и дольше. Ну, а в норме одновременно с уже описанным процессом запускается и другой каскад реакций, связанных с действием плазменных факторов, и заканчивающийся образованием кровяной протромбиназы в количестве, достаточном для перевода большого количества протромбина с тромбин. Реакции эти следующие ( внутренний механизм гемокоагуляции): 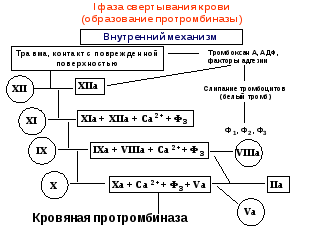 Рис. 16. Внутренний механизм образовании протромбиназы в первую фазу гемокоагуляции. Рис. 16. Внутренний механизм образовании протромбиназы в первую фазу гемокоагуляции.1. Контакт с шероховатой или чужеродной поверхностью приводит к активации XII фактора : XII -- XIIa. Одновременно начинает образовываться гемостатический гвоздь Гайема (сосудисто-тромбоцитарный гемостаз). 2.Активный ХII фактор превращает XI в активное состояние и образуется новый комплекс XIIa +Ca++ +XIa + III(ф3) 3. Под влиянием указанного комплекса IX фактор активизируется и образуется комплекс IXa + Va + Cа++ +III(ф3). 4. Под влиянием этого комплекса происходит активация значительного количества Х фактора, после чего в большом количестве образуется последний комплекс факторов: Xa + Va + Ca++ + III(ф3), который и носит название кровяная протромбиназа. а весь этот процесс затрачивается в норме около 4-5 минут, после чего свертывание переходит в следующую фазу. 2 фаза свертывания - фаза образования тромбина заключается в том, что под влиянием фермента протромбиназы II фактор (протромбин) переходит в активное состояние (IIa). Это протеолитический процесс, молекула протромбина расщепляется на две половинки. Образовавшийся тромбин идет на реализацию следующей фазы, а также используется в крови для активации все большего количества акцелерина (V и VI факторов). Это пример системы с положительной обратной связью. Фаза образования тромбина продолжается несколько секунд. 3 фаза свертывания - фаза образования фибрина - тоже ферментативный процесс, в результате которого от фибриногена благодаря воздействию протеолитического фермента тромбина отщепляется кусок в несколько аминокислот, а остаток носит название фибрин-мономер, который по своим свойствам резко отличается от фибриногена. В частности, он способен к полимеризации. Это соединение обозначается как Im. 4 фаза свертывания - полимеризация фибрина и организация сгустка. Она тоже имеет несколько стадий. Вначале за несколько секунд под влиянием рН крови, температуры, ионного состава плазмы происходит образование длинных нитей фибрин-полимера Is который, однако, еще не очень стабилен, так как способен растворяться в растворах мочевины. Поэтому на следующей стадии под действием фибрин-стабилизатора Лаки-Лоранда (XIII фактора) происходит окончательная стабилизация фибрина и превращение его в фибрин Ij. Он выпадает из раствора в виде длинных нитей, которые образуют сетку в крови, в ячейках которой застревают клетки. Кровь из жидкого состояния переходит в желеобразное (свертывается). Следующей стадией этой фазы является длящаяся достаточно долго (несколько минут) ретракия (уплотнение) сгустка, которая происходит за счет сокращения нитей фибрина под действием ретрактозима (тромбостенина). В результате сгусток становится плотным, из него выжимается сыворотка, а сам сгусток превращается в плотную пробку, перекрывающую сосуд - тромб. 5 фаза свертывания - фибринолиз. Фибринолиз - это процесс растворения фибрина. Хотя он фактически не связан с образованием тромба, фибринолиз считают послефазой гемокоагуляции, так как в ходе его происходит ограничение тромба только той зоной, где он действительно необходим. Если тромб полностью закрыл просвет сосуда, то в ходе этой фазы этот просвет восстанавливается (происходит реканализация тромба). Практически фибринолиз всегда идет параллельно с образованием фибрина, предотвращая генерализацию свертывания и ограничивая процесс. Р 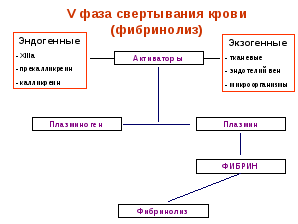 ис. 17. Схема образования плазмина и фибринолиз. ис. 17. Схема образования плазмина и фибринолиз.Растворение фибрина обеспечивается протеолитическим ферментом плазмином (фибринолизином) который содержится в плазме в неактивном состоянии в виде плазминогена (профибринолизина). Переход плазминогена в активное состояние осуществляется специальным активатором, который в свою очередь образуется из неактивных предшественников (проактиваторов), высвобождающихся из тканей, стенок сосудов, клеток крови, особенно тромбоцитов. В процессах перевода проактиваторов и активаторов плазминогена в активное состояние большую роль играют кислые и щелочные фосфатазы крови, трипсин клеток, тканевые лизокиназы, кинины, реакция среды, XII фактор. Плазмин расщепляет фибрин на отдельные полипептиды, которые затем утилизируются организмом. Фибринолиз, как и процесс свертывания крови, может протекать по внешнему и внутреннему механизму (пути). Внешний механизм активации фибринолиза осуществляется при участии тканевых активаторов, которые синтезируются главным образом в эндотелии сосудов. К ним относятся тканевый активатор плазминогена (ТАП) и урокиназа. Последняя также образуется в юкстагломеруляриом комплексе почки. Внутренний механизм активации фибринолиза осуществляется плазменными активаторами, а также активаторами форменных элементов крови — лейкоцитов, тромбоцитов и эритроцитов и разделяется на Хагеман-зависимый и Хагеман-независимый. Хагеман-зависимый фибринолиз протекает под влиянием факторов XIIа и калликреина, которые переводят плазминоген в плазмин. Хагеман-независимый фибринолиз осуществляется наиболее быстро и носит срочный характер. Его основное назначение сводится к очищению сосудистого русла от нестабилизированного фибрина, образующегося в процессе внутрисосудистого свертывания крови. В плазме находятся и ингибиторы фибринолиза. Важнейшими из них являются α2-антиплазмин, связывающий плазмин, трипсин, калликреин, урокиназу, ТАП и, следовательно, вмешивающийся в процесс фибринолиза как на ранних, так и на поздних стадиях. Сильным ингибитором плазмина служит α1-протеазный ингибитор. Кроме того, фибринолиз тормозится α2-макроглобулином, C1-протеазным ингибитором, а также рядом ингибиторов активатора плазминогена, синтезируемых эндотелием, макрофагами, моноцитами и фибробластами. Фибринолитическая активность крови во многом определяется соотношением активаторов и ингибиторов фибринолиза. При ускорении свертывания крови и одновременном торможении фибринолиза создаются благоприятные условия для развития тромбозов, эмболии и ДВС-синдрома. Наряду с ферментативным фибринолизом, по мнению профессора Б. А. Кудряшова, существует так называемый неферментативный фибринолиз, который обусловлен комплексными соединениями естественного антикоагулянта гепарина с ферментами и гормонами. Неферментативный фибринолиз приводит к расщеплению нестабилизированного фибрина, очищая сосудистое русло от фибрин-мономеров и фибрина s (Fs). Антикоагулянты. Несмотря на то, что в циркулирующей крови имеются все факторы, необходимые для образования тромба, в естественных условиях при наличии целостности сосудов кровь остается жидкой. Это обусловлено наличием в кровотоке противосвертывающих веществ, получивших название естественных антикоагулянтов, или фибринолитического звена системы гемостаза. Естественные антикоагулянты делят на первичные и вторичные. Первичные антикоагулянты всегда присутствуют в циркулирующей крови, вторичные — образуются в результате протеолитического расщепления факторов свертывания крови в процессе образования и растворения фибринового сгустка. Первичные антикоагулянты можно разделить на три основные группы: 1) антитромбопластины — обладающие антитромбопластическим и антипротромбиназным действием; 2) антитромбины — связывающие тромбин; 3) ингибиторы самосборки фибрина — дающие переход фибриногена в фибрин. Следует заметить, что при снижении концентрации первичных естественных антикоагулянтов создаются благоприятные условия для развития тромбозов и ДВС-синдрома. К вторичным антикоагулянтам относят «отработанные» факторы свертывания крови (принявшие участие в свертывании) и продукты деградации фибриногена и фибрина (ПДФ), обладающие мощным антиагрегационным и противосвертывающим действием, а также стимулирующие фибринолиз. Роль вторичных антикоагулянтов сводится к ограничению внутрисосудистого свертывания крови и распространения тромба по сосудам. В естественных условиях фибринолитическая активность крови находится в зависимости от депо плазминогена, плазменного активатора, от условий, обеспечивающих процессы активации, и от поступления этих веществ в кровь. Спонтанная активность плазминогена в здоровом организме наблюдается при состоянии возбуждения, после инъекции адреналина, при физических напряжениях и при состояниях, связанных с шоком. Среди искусственных блокаторов фибринолитической активности крови особое место занимает гамма аминокапроновая кислота (ГАМК). В норме в плазме содержится количество ингибиторов плазмина, превышающее в 10 раз уровень запасов плазминогена в крови. Основные естественные антикоагулянты
Состояние процессов гемокоагуляции и относительное постоянство или динамическое равновесие факторов свертывания и антисвертывания связано с функциональным состоянием органов системы гемокоагуляции (костного мозга, печени, селезенки, легких, сосудистой стенки). Деятельность последних, а следовательно, и состояние процесса гемокоагуляции, регулируется нервно-гуморальными механизмами. В кровеносных сосудах имеются специальные рецепторы, воспринимающих концентрацию тромбина и плазмина. Эти два вещества и программируют деятельность указанных систем. Регуляция процессов гемокоагуляции и антигоагуляции. Установлено, что при острой кровопотере, гипоксии, интенсивной мышечной работе, болевом раздражении, стрессе свертывание крови значительно ускоряется, что может привести к появлению фибрин-мономеров и даже фибрина s в сосудистом русле. Однако благодаря одновременной активации фибринолиза, носящего защитный характер, появляющиеся сгустки фибрина быстро растворяются и не наносят вреда здоровому организму. Ускорение свертывания крови и усиление фибринолиза при всех перечисленных состояниях обусловлены повышением тонуса симпатической части автономной нервной системы и поступлением в кровоток адреналина и норадреналина. При этом активируется фактор Хагемана, что приводит к запуску внешнего и внутреннего механизма образования протромбиназы, а также стимуляции Хагеман-зависимого фибринолиза. Кроме того, под влиянием адреналина усиливается образование апопротеина III — составной части тромбопластина, и наблюдается отрыв клеточных мембран от эндотелия, обладающих свойствами тромбопластина, что способствует резкому ускорению свертывания крови. Из эндотелия также выделяются ТАП и урокиназа, приводящие к стимуляции фибринолиза .В случае повышения тонуса парасимпатической части автономной нервной системы (раздражение блуждающего нерва, введение АХ, пилокарпина) также наблюдаются ускорение свертывания крови и стимуляция фибринолиза. В этих условиях происходит выброс тромбопластина и активаторов плазминогена из эндотелия сердца и сосудов. Следовательно, основным эфферентным регулятором свертывания крови и фибринолиза является сосудистая стенка. Напомним также, что в эндотелии сосудов синтезируется Pgl2, препятствующий в кровотоке адгезии и агрегации тромбоцитов. Вместе с тем развивающаяся гиперкоагуляция может смениться гипокоагуляцией, которая в естественных условиях носит вторичный характер и обусловлена расходом (потреблением) тромбоцитов и плазменных факторов свертывания крови, образованием вторичных антикоагулянтов, а также рефлекторным выбросом в сосудистое русло в ответ на появление фактора IIа, гепарина и антитромбина III. При многих заболеваниях, сопровождающихся разрушением эритроцитов, лейкоцитов, тромбоцитов и тканей, развивается ДВС-синдром, значительно отягощающий течение патологического процесса и даже приводящий к смерти больного. В настоящее время ДВС-синдром обнаружен более чем при 100 различных заболеваниях. Особенно часто он возникает при переливании несовместимой крови, обширных травмах, отморожениях, ожогах, длительных оперативных вмешательствах на легких, печени, сердце, предстательной железе, всех видах шока, краш-синдроме (длительное сдавление конечностей), а также в акушерской практике при попадании в кровоток матери околоплодных вод, насыщенных тромбопластином плацентарного происхождения. При этом возникает гиперкоагуляция, которая из-за интенсивного потребления тромбоцитов, фибриногена, факторов V, VIII, XIII и др. в результате интенсивного внутрисосудистого свертывания крови сменяется вторичной гипокоагуляцией вплоть до полной неспособности крови к образованию фибриновых сгустков, что приводит к трудно поддающимся терапии кровотечениям. Знание основ физиологии гемостаза позволяет клиницисту избрать оптимальные варианты борьбы с заболеваниями, сопровождающимися тромбозами, эмболиями, ДВС-синдромом и повышенной кровоточивостью. Рефлекторные влияния. Важное место среди многих раздражителей, падающих на организм, занимает болевое раздражение. Боль приводит к изменению деятельности почти всех органов и систем, в том числе и системы свертывания. Кратковременное или длительное болевое раздражение ведет к ускорению свертывания крови, сопровождаемое тромбоцитозом. Присоединение к боли чувства страха приводит к еще более резкому ускорению свертывания. Болевое раздражение, нанесенное анестезированному участку кожи, не вызывает ускорения свертывания. Такой эффект наблюдается с первого дня рождения. Большое значение имеет продолжительность болевого раздражения. При кратковременной боли сдвиги менее выражены и возврат к норме совершается в 2-3 раза быстрей, чем при длительном раздражении. Это дает основание полагать, что в первом случае принимает участие лишь рефлекторный механизм, а при длительном болевом раздражении включается и гуморальное звено, обусловливая продолжительность наступающих изменений. Большинство ученых полагает, что таким гуморальным звеном при болевом раздражении является адреналин. Значительное ускорение свертывания крови происходит рефлекторно также при действии на организм тепла и холода. После прекращения теплового раздражения период восстановления до исходного уровня в 6-8 раз короче, чем после холодового. Свертывание крови является компонентом ориентировочной реакции. Изменение внешней среды, неожиданное появление нового раздражителя вызывают ориентировочную реакцию и одновременно ускорение свертывания крови, что является биологически целесообразной защитной реакцией. Эндокринная система и свертывание. Эндокринные железы являются важным активным звеном механизма регуляции свертывания крови. Под влиянием гормонов процессы свертывания крови претерпевают ряд изменений, а гемокоагуляция либо ускоряется, либо замедляется. Если сгруппировать гормоны по их действию на свертывание крови, то к ускоряющим свертывание будут относиться АКТГ, СТГ, адреналин, кортизон, тестостерон, прогестерон, экстракты задней доли гипофиза, эпифиза и зобной железы; замедляют свертывание тиреотропный гормон, тироксин и эстрогены. Во всех приспособительных реакциях, в особенности протекающих с мобилизацией защитных сил организма, в поддержании относительного постоянства внутренней среды вообще и системы свертывания крови, в частности, гипофизарно-анреналовая система является важнейшим звеном нейрогуморального механизма регуляции. Имеется значительное количество данных, свидетельствующих о наличии влияния коры головного мозга на свертывание крови. Так, свертывание крови изменяется при повреждении полушарий головного мозга, при шоке, наркозе, эпилептическом припадке. Особый интерес представляют изменения скорости свертывания крови в гипнозе, когда человеку внушают, что он ранен, и в это время свертываемость возрастает так: как будто это происходит в действительности. Противосвертывающая система крови. Еще в 1904 году известный немецкий ученый Моравиц впервые высказал предположение о наличие в организме противосвертывающей системы, которая сохраняет кровь в жидком состоянии, а также о том, что свертывающая и антисвертывающая системы, находятся в состоянии динамического равновесия. Позже эти предположения подтвердились в лаборатории, возглавляемой профессором Кудряшовым. В 30-е годы был получен тромбин, который вводился крысам с целью вызвать свертывание крови в сосудах. Оказалось, что кровь в этом случае вообще перестала свертываться. Значит, тромбин активизировал какую-то систему, которая препятствует свертыванию крови в сосудах. На основании этого наблюдения Кудряшов пришел к выводу о наличии противосвертывающей системы. Под противосвертывающей системой следует понимать совокупность органов и тканей, которые синтезируют и утилизируют группу факторов, обеспечивающих жидкое состояние крови, то есть препятствующих свертыванию крови в сосудах. К таким органам и тканям относятся сосудистая система, печень, некоторые клетки крови и др. Эти органы и ткани вырабатывают вещества, которые получили на звание ингибиторов свертывания крови или естественных антикоагулянтов. Они вырабатываются в организме постоянно, в отличие от искусственных, которые вводятся при лечении претромбических состояний. Ингибиторы свертывания крови действуют по фазам. Предполагается, что механизм их действия заключается либо в разрушении, либо в связывании факторов свертывания крови. В 1 фазе в качестве антикоагулянтов срабатывают: гепарин (универсальный ингибитор) и антипротромбиназы. Во 2 фазе срабатывают ингибиторы тромбина: фибриноген, фибрин с продуктами своего распада - полипептиды, продукты гидролиза тромбина, протромбин 1 и II, гепарин и естественный антитромбин 3, который относится к группе глюкозоаминогликанов. При некоторых патологических состояниях, например, заболевания сердечно - сосудистой системы, в организме появляются дополнительные ингибиторы. Наконец, имеет место ферментативный фибринолиз, ( фибринолити-ческая система) протекающий в 3 фазы. Так, если в организме много образуется фибрина или тромбина, то моментально включается фибринолитическая система и происходит гидролиз фибрина. Большое значение в сохранении жидкого состояния крови имеет неферментативный фибринолиз. По Кудряшову различают две противосвертывающие системы: Первая имеет гуморальную природу. Она срабатывает постоянно, осуществляя выброс всех уже перечисленных антикоагулянтов, исключая гепарин. Вторая - аварийная противосвертывающая система, которая обусловлена нервными механизмами, связанными с функциями определенных нервных центров. Когда в крови накапливается угрожающее количество фибрина или тромбина, происходит раздражение соответствующих рецепторов, что через нервные центры активизирует противосвертывающую систему. Свертывающая и антисвертывающая системы взаимосвязаны, находятся под контролем как нервных, так и гуморальных механизмов. Можно предположить, что существует функциональная система, обеспечивающая свертывание крови, которая состоит из воспринимающего звена, представленного специальными хеморецепторами, заложенными в сосудистых рефлексогенных зонах (дуга аорты и синокаротидная зона), которые улавливают факторы, обеспечивающие свертывание крови. Второе звено функциональной системы - это механизмы регуляции. К ним относятся нервный центр, получающий информацию с рефлексогенных зон. Эксперименты над животными показывают, что при раздражении задней части гипоталамуса имеет место чаще гиперкоагуляция, а при раздражении передней части - гипокоагуляция. Как работает функциональная система поддержания жидкого состояния крови? Если концентрация каких - либо факторов обеспечивающих процесс свертывания крови, возрастает или падает, то это воспринимается хеморецепторами. Информация от них идет в центр регуляции свертывания крови, а затем на органы - исполнители, и по принципу обратной связи их выработка или тормозится или увеличивается. Воспринимающее звено этой функциональной системы находится в сосудистых рефлексогенных зонах и представлено специфическими хеморецепторами, улавливающими концентрацию антикоагулянтов. Второе звено представлено нервным центром противосвертывающей системы. По данным Кудряшова, он находится в продолговатом мозге, что доказывается рядом экспериментов. Если, например, выключить его такими веществами, как аминозин, метилтиурацил и другими, то кровь начинает свертываться в сосудах. К исполнительным звеньям относятся органы, синтезирующие антикоагулянты. Это сосудистая стенка, печень, клетки крови. Срабатывает функциональная система, препятствующая свертыванию крови следующим образом: много антикоагулянтов - их синтез тормозится, мало - возрастает (принцип обратной связи). | ||||||||||||||||||||||||||||||||||
