|
|
лекции. Краткий курс лекций структурообразование в пищевых системах воро. Курс лекций структурообразование в пищевых системах
Глава 4. ВИДЫ ДИСПЕРСНЫХ СИСТЕМ
4.1 Лиофильные коллоидные системы
4.1.1 Растворы коллоидных ПАВ
Коллоидными называют поверхностно-активные вещества (ПАВ), способные в растворах образовывать мицеллы, т.е. ассоциаты, состоящие из большого количества молекул (от 20 до 100). Способностью к мицеллообразованию обладают ПАВ с длинной углеводородной цепью, включающей 10-20 атомов углерода.
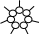
При образовании мицелл в полярном растворителе, например, воде углеводородные цепи молекул ПАВ объединяются в компактное ядро, а гидратированные полярные группы, обращенные в сторону водной фазы, образуют гидрофильную оболочку (рис. 4.1 а). В неполярных растворителях ориентация молекул ПАВ противоположна, т.е. углеводородный радикал обращен к неполярной жидкости (рис. 4.1 б)
Между молекулами ПАВ в адсорбционном слое и в растворе, а также между молекулами ПАВ, входящими в составе мицелл, существует динамическое равновесие (рис. 4.2).
а)
б)
Рис. 4.1. Ориентация молекул ПАВ в мицелле:
а) полярный растворитель; б) неполярный
растворитель
За счет высокой степени ассоциации молекул ПАВ в мицелле между нею и дисперсионной средой возникает граница раздела, т.е. мицеллярные растворы ПАВ – это гетерогенные системы. Но, несмотря на гетерогенность и большую межфазную поверхность, они термодинамически устойчивы. Это объясняется тем, что молекулы ПАВ в мицеллах ориентируются полярными группами к полярной среде (или неполярными группами к неполярной среде), что обусловливает низкое межфазовое натяжение. Поэтому поверхностная энергия таких систем невелика, они представляют собой типичные лиофильные системы.
Одним из характерных свойств растворов коллоидных ПАВ, связанных с их мицеллярным строением, является солюбилизация – растворение в растворах коллоидных ПАВ веществ, которые в чистой жидкости обычно нерастворимы.
Одним из характерных свойств растворов коллоидных ПАВ, связанных с их мицеллярным строением является солюбилизация – растворение в растворах коллоидных ПАВ веществ, которые в данной жидкости обычно нерастворимы.
М еханизм солюбилизации заключается в проникновении неполярных молекул веществ, добавленных в раствор ПАВ в неполярное ядро мицеллы (или наоборот: полярных – в полярное ядро). При этом углеводородные цепи раздвигаются и объем мицеллы увеличивается. В результате солюбилизации в водных растворах ПАВ растворяются углеводородные жидкости: бензин, керосин, а также жиры, которые нерастворимы в воде. еханизм солюбилизации заключается в проникновении неполярных молекул веществ, добавленных в раствор ПАВ в неполярное ядро мицеллы (или наоборот: полярных – в полярное ядро). При этом углеводородные цепи раздвигаются и объем мицеллы увеличивается. В результате солюбилизации в водных растворах ПАВ растворяются углеводородные жидкости: бензин, керосин, а также жиры, которые нерастворимы в воде.
Д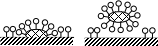 ругим важным свойством растворов коллоидных ПАВ является их моющее действие. Как правило, частицы загрязняющих веществ гидрофобны и не смачиваются водой. Поэтому даже при высокой температуре моющее действие воды очень мало и для его увеличения добавляют коллоидные ПАВ. При контакте моющего средства с загрязненной поверхностью молекулы ПАВ образуют адсорбционный слой на частицах грязи и очищаемой поверхности. Молекулы ПАВ постепенно проникают между частицами загрязнения и поверхностью, способствуя отрыванию частиц грязи. Загрязняющее вещество попадает внутрь мицеллы и больше не может оседать на отмываемой поверхности. ругим важным свойством растворов коллоидных ПАВ является их моющее действие. Как правило, частицы загрязняющих веществ гидрофобны и не смачиваются водой. Поэтому даже при высокой температуре моющее действие воды очень мало и для его увеличения добавляют коллоидные ПАВ. При контакте моющего средства с загрязненной поверхностью молекулы ПАВ образуют адсорбционный слой на частицах грязи и очищаемой поверхности. Молекулы ПАВ постепенно проникают между частицами загрязнения и поверхностью, способствуя отрыванию частиц грязи. Загрязняющее вещество попадает внутрь мицеллы и больше не может оседать на отмываемой поверхности.
Применение коллоидных ПАВ
Пищевая промышленность.
Коллоидные ПАВ применяют в хлебопекарной, макаронной и кондитерской промышленности. Это позволяет улучшить качество продуктов, увеличить срок хранения за счет удерживания влаги, сократить расход сырья. Благодаря применению коллоидных ПАВ сохраняется форма макаронных изделий при варке.
В мясоперерабатывающей промышленности ПАВ коллоидные ПАВ применяют для улучшения вкуса продуктов, повышения стойкости к воздействию неблагоприятных факторов при хранении, в качестве биологически инертных покрытий на мясопродукты.
В пищеконцентратной промышленности коллоидные ПАВ применяют для улучшения структуры продукта, исключения комкования и слипания.
Коллоидные ПАВ применяют также при производстве мороженного, за счет чего замедляется процесс таяния, улучшается вкус и консистенция продукта.
Сборка нефти растворами ПАВ. ПАВ собирают пленки ПАВ в одну каплю, которую легко удалить с поверхности.
Благодаря солюбилизирующему действию ПАВ их применяют в медицине, фармации для перевода в растворимое состояние нерастворимых в воде лекарств.
ПАВ применяют в качестве ингибиторов коррозии, так как они способны образовывать на поверхности практически мономолекулярную пленку, защищающую металл от воздействий внешней среды.
Механизм солюбилизации заключается в проникновении неполярных молекул веществ, добавленных в раствор ПАВ, в неполярное ядро мицеллы (или полярных – в полярное ядро). При этом углеводородные цепи раздвигаются и объем мицеллы увеличивается. В результате солюбилизации в водных растворах ПАВ растворяются углеводородные жидкости: бензин, керосин, а также жиры, нерастворимые в чистой воде.
Благодаря солюбилизирующему действию ПАВ, их применяют для перевода в растворимое состояние нерастворимых в воде лекарств в медицине, фармации. Солюбилизация – первый этап процесса усвоения жиров и жирорастворимых веществ живыми организмами.
Солюбилизация является важным фактором моющего действия ПАВ. Как правило, частицы загрязняющих веществ гидрофобны и не смачиваются водой. Поэтому, даже при высокой температуре, моющее действие воды очень мало. Удаление загрязнений с любой поверхности облегчается в присутствии моющих средств, содержащих коллоидные ПАВ.
Концентрация ПАВ, при которой в растворе возникают мицеллы, называется критической концентрацией мицеллобразования (ККМ).
Величина ККМ – важнейшая характеристика ПАВ, зависящая от многих факторов: молекулярной природы ПАВ и растворителя, рН, температуры, присутствия примесей. При концентрации ПАВ выше критической, соответствующей ККМ, резко изменяются физико-химические свойства, а на кривой свойство-состав появляется излом.
Поэтому большинство методов определения ККМ основаны на измерении какого-либо физико-химического свойства – поверхностного натяжения, электрической проводимости, показателя преломления, осмотического давления и др. – и установлении концентрации, при которой наблюдается резкое изменение этого свойства.
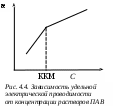
Так, изотермы поверхностного натяжения растворов коллоидных ПАВ вместо обычного плавного хода, описываемого уравнением Шишковского, обнаруживают при ККМ излом (рис. 4.3). При дальнейшем увеличении концентрации выше ККМ значения поверхностного натяжения остаются практически неизменными.
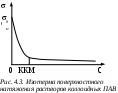
Кривая зависимости удельной электрической проводимости æ от концентрации С при ККМ имеет резкий излом (рис. 4.4).
4.1.2 Растворы высокомолекулярных соединеий
К ВМС относят соединения с большой молекулярной массой от 104 до 106. Размеры молекул ВМС могут достигать 1000 нм, т.е. соизмеримы с размерами частиц в средне- и высокодисперсных системах.
Классификация ВМС
По происхождению различают:
– природные ВМС: белки (желатин, казеин), полисахариды (крахмал, целлюлоза);
– синтетические ВМС получают в результате химического синтеза, например, полиэтилен:
n(CH2 = CH2) → (– CH2 – CH2 –)n
Полимеры образуются из низкомолекулярных молекул при их взаимодействии друг с другом. Если образование полимера не сопровождается выделением побочного продукта, то идет реакция полимеризации (полиэтилен, полипропилен и т.д.) Если образуется побочный низкомолекулярный продукт, то протекает реакция поликонденсации (фенолформальдегидные смолы).
По строению полимерной цепи различают:
– линейные полимеры образуются при полимеризации бифункциональных молекул (полиэтилен), обладают высокой гибкостью; линейные полимеры образуются при полимеризации бифункциональных молекул (полиэтилен), обладают высокой гибкостью;
– пространственные (сшитые) полимеры образуются, когда функциональность мономера больше двух (фенолформальдегидные смолы), менее эластичны, обладают высокой твердостью, менее растворимы. пространственные (сшитые) полимеры образуются, когда функциональность мономера больше двух (фенолформальдегидные смолы), менее эластичны, обладают высокой твердостью, менее растворимы.
– разветвленные: характерно образование боковых ответвлений от основной цепи, имеют промежуточные свойства между линейными и сшитыми (крахмал). разветвленные: характерно образование боковых ответвлений от основной цепи, имеют промежуточные свойства между линейными и сшитыми (крахмал).
По способности к электролитической диссоциации различают:
– неэлектролиты
– полиэлектролиты: поликислоты; полиоснования; амфолиты.
Особенности строения полимеров
В макромолекулах ВМС имеется два типа связей:
– химические связи, соединяющие атомы в полимерной цепи, очень прочные;
– межмолекулярные связи, возникающие за счет сил Ван-дер-Ваальса и водородные связи, которые связывают между собой макромолекулы, менее прочные.
Макромолекулы ВМС обладают гибкостью, которая обусловлена внутренним вращением звеньев. Благодаря этому макромолекула может принимать различные конформации, т.е пространственные энергетически неравноценные формы, возникающие за счет вращения звеньев вокруг химических связей без их разрыва. В результате макромолекулы ВМС могут различные формы: линейную, клубка, глобулы.
Полимеры обладают пластичностью. Пластичность – это свойство твердых тел необратимо изменять свои размеры и форму под действием механических нагрузок. Это свойство полимеров связано с взаимным перемещением гибких цепей относительно друг друга. Благодаря пластичности возможна переработка полимерных материалов: вытягивание нитей, пленок, формование различных изделий.
Для повышения пластичности применяются пластификаторы – вещества, способные окружать макромолекулы мономолекулярным слоем и предотвращать возникновение межмолекулярных связей.
Набухание высокомолекулярных соединений
природного происхождения
При контакте полимера с растворителями происходит его набухание. Набухание – это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом, сопровождающийся увеличением массы и объёма полимера.
Набухание обусловлено существенным различием подвижностей молекул растворителя и ВМС: малые молекулы растворителя быстро проникают в полимер, раздвигая цепи. Полярные полимеры набухают в полярных жидкостях (например, белки в воде), неполярные – в неполярных (каучук в бензоле).
Количественная характеристика набухания – степень набухания i – величина, показывающая относительное увеличение массы ВМС при набухании:
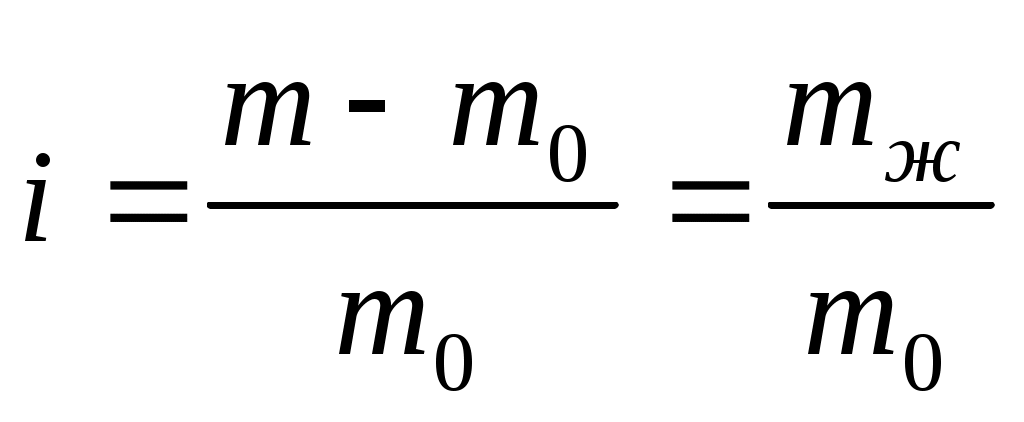 , (4.1) , (4.1)
где m0, – масса сухого полимера; m – масса набухшего полимера; mж – масса поглощенной жидкости.
Набухание может быть ограниченным и неограниченным.
При ограниченном набухании m и i достигают постоянных предельных значений mmax и imax (рис. 4.5, кривая 1).
При неограниченном набухании m и i достигают максимальных значений, которые затем уменьшаются вследствие растворения полимера (рис. 4.5, кривая 2). В этом случае набухание является первой стадией растворения.
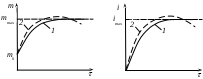
Рис. 4.5 .Кинетические кривые набухания
1 – ограниченное набухание; 2 – неограниченное набухание
Набухание протекает в две стадии.
Первая – стадия гидратации (сольватации); на этой стадии молекулы растворителя адсорбируются на поверхности ВМС, происходит сольватация макромолекул. При этом выделяется т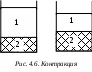 еплота набухания (ΔH < 0), и наблюдается контракция – уменьшение объёма системы в результате сжатия растворителя 1 в сольватных оболочках и образованием связанной жидкости наряду с увеличением объёма полимера 2 (рис. 4.6). еплота набухания (ΔH < 0), и наблюдается контракция – уменьшение объёма системы в результате сжатия растворителя 1 в сольватных оболочках и образованием связанной жидкости наряду с увеличением объёма полимера 2 (рис. 4.6).
Теплота набухания ВМС, а, следовательно, и количество связанной воды в биополимерах зависит от числа полярных групп, с которыми она взаимодействует, образуя водородные связи.
Вторая стадия – осмотическая. Растворитель диффундирует внутрь матрицы ВМС, внутри ВМС возникает большое осмотическое давление. На этой стадии теплота не выделяется. Если межмолекулярные связи сильные и их много, ВМС набухает, достигая mmax и imax. Происходит ограниченное набухание. Если все связи слабые, полимер набухает и полностью растворяется.
Ограничено набухают полимеры, имеющие разветвлённую и пространственную структуру, а также химические связи между молекулами – “мостики”, которые не позволяют молекулам полимера отделиться друг от друга. Образуется студень.
Жидкость, заполняющую сетку студня, называют интермицеллярной. Она состоит из связанной, образующей гидратные (сольватные) оболочки, и свободной, или капиллярной. Количество связанной воды зависит от гидрофильности макромолекул. Чем больше полярных групп, тем больше связанной воды. С течением времени наблюдается старение набухших полимеров, проявляющееся в постепенном сжатии сетки (матрицы), в результате чего отделяется мицеллярная жидкость. Этот процесс называется синерезисом.
В человеческом организме доля связанной воды у младенцев составляет 70 %, а у пожилых людей – до 40 %, что обусловливает появление морщин, дряблость кожи и т.д. Синерезис, таким образом, в человеческом организме идет достаточно медленно и его скорость индивидуальна.
Мясо молодых животных сочнее и нежнее по сравнению с мясом старых животных, так как в последнем, склонном к синерезису, происходит потеря свободной и даже связанной воды, что приводит к снижению качества продукта.
Интересное свойство студней – «память». Если высушить при низкой температуре до одного и того же содержания влаги два студня, один из которых был получен из разбавленного, а другой из концентрированного раствора желатина, а затем дать им снова набухнуть в воде, то первый студень набухнет гораздо больше, чем второй.
К важнейшим природным высокомолекулярным веществам растительного и животного происхождения относятся белки, полисахариды и др. Белки – сложные высокомолекулярные соединения, которые можно рассматривать как полимеры аминокислот. Полипептидные цепи образуются в результате конденсации -аминокислот с пептидной связью –С–N–. В сложной структуре белка различают несколько уровней организации.
-Спиральная структура – это последовательность расположения аминокислот в цепи, стабилизированная водородными связями между группами N–H и С=О третьего аминокислотного остатка вдоль полипептидной цепи. Эта структура обеспечивает максимальное число внутримолекулярных водородных связей.
Слоистая -структура (складчатая). Она возникает за счет межмолекулярных водородных связей между полипептидными вытянутыми цепями. Водородные связи в этой структуре ориентированы примерно перпендикулярно длинной оси полипептидных цепей.
Более сложная структура белка, в которой сочетается -спиральная конформация и -структура. Пространственная организация молекулы белка в целом стабилизирована водородными связями, дисульфидными связями между цистеиновыми остатками, а также нековалентными взаимодействиями. К этой структуре, в частности, относятся глобулярные белки (казеин, сывороточные белки молока, белки муки и др.). В глобулярных белках полипептидные цепи свернуты таким образом, чтобы в контакте с ними оставалось как можно меньше свободного пространства, не занятого самим белком.
Фибриллярные белки находятся в шерсти, волосах, шелке. Фибриллярные белки, содержащиеся в волосах и шерсти, называются кератинами. -Спиральные участки в кератинах определяют гибкость и эластичность шерсти. В кератинах отсутствует взаимодействие между цепями, поэтому шерстяные нити не очень прочны. Молекулы белков шелка содержат также и -структуры, полипептидные цепи вытянуты. Поэтому шелк не обладает эластичностью, но весьма прочен вследствие водородных связей, возникающих между цепями.
Другой пример фибриллярных белков – коллаген, основа соединительных тканей (хрящи, сухожилия, связки). Основная структурная единица коллагена – вытянутая тройная спираль. Три полипептидные цепи переплетены таким образом, что образуют сверхспираль диаметром около 1,5 нм и длиной 300 нм. Важнейшее свойство коллагена – его жесткость и устойчивость к деформации. Оба эти свойства имеют жизненно важное значение при передаче механического усилия, создаваемого мышцами.
Полимер природного происхождения крахмал – широко распространенный в природе полисахарид, главная составная часть всех злаков и картофеля. Молекула крахмала состоит из звеньев остатков глюкозы (С6Н10О5)n. Число остатков глюкозы, образующих молекулу крахмала, неодинаково. Одна фракция (около 25 %) с молекулярной массой 3105–106 (амилоза) представляет собой линейный полимер. Эта фракция неограниченно набухает в теплой воде, переходя в растворенное состояние. Вторая фракция (амилопектин) ограниченно набухает в воде. Молекулы амилопектина – это разветвленные структуры с молекулярной массой, более чем на два порядка превышающей молекулярную массу растворимой фракции. Зерна крахмала связывают влагу в результате гидратации, поэтому объем их увеличивается незначительно.
Скорость набухания – изменение степени набухания в единицу времени  – скорость набухания можно рассчитать только для ограниченного набухания. – скорость набухания можно рассчитать только для ограниченного набухания.
Кинетика набухания идёт по механизму реакции I порядка
 , ,
где iτ – степень набухания за время τ.
 , ,
 . .
Факторы, влияющие на набухание
1. Природа ВМС и растворителя (неполярные полимеры хорошо набухают и растворяются в неполярных растворителях, полярные – в полярных).
2. Время жизни ВМС: чем старше полимер, тем хуже он набухает.
3. Температура: интенсифицирует процесс набухания.
4. Добавка электролита. Если к раствору ВМС добавить электролит, можно наблюдать образование хлопьев. Этот процесс называется высаливанием ВМС. Механизм: электролит диссоциирует на ионы, ионы гидратируются, при этом оттягивается вода от ВМС. При высокой концентрации электролита гидратная оболочка у ВМС становится тонкой, раствор по количеству полимера становится пересыщенным и ВМС выпадает в осадок.
5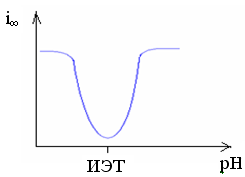 . рН среды. Существенное влияние оказывает на набухание полиэлектролитов, т.е. ВМС, способных в растворе диссоциировать с образованием высокомолекулярного иона. К полиэлектролитам относят белки, которые имеют как основную –NH3+ так и кислотную –СОО– группы. В кислой и щелочной среде степень набухания имеет высокое значение, что связано с одноименным избыточным зарядом макромолекул. В кислой среде идет диссоциация основных групп: . рН среды. Существенное влияние оказывает на набухание полиэлектролитов, т.е. ВМС, способных в растворе диссоциировать с образованием высокомолекулярного иона. К полиэлектролитам относят белки, которые имеют как основную –NH3+ так и кислотную –СОО– группы. В кислой и щелочной среде степень набухания имеет высокое значение, что связано с одноименным избыточным зарядом макромолекул. В кислой среде идет диссоциация основных групп:
–R–NH3OH –R–NH3+ + OH–,
за счет чего макромолекула заряжается положительно. В щелочной среде наоборот идет диссоциация кислотных групп:
–R–СОOH –R–СОО– + H+,
и молекула заряжается отрицательно. Одноименно заряженные участки макромолекулы не позволяют ей свернуться в клубок, что облегчает проникновение молекул растворителя и сольватацию цепей ВМС.
Минимальная степень набухания полиэлектролита наблюдается в изоэлектрической точке (ИЭТ). Связано это с тем, что в ИЭТ за счет одинакового количества положительных и отрицательных зарядов участки макромолекулы притягиваются друг к другу и цепь полимера сворачивается в глобулу. В результате молекулам растворителя трудно проникнуть внутрь глобулы, что затрудняет набухание.
Свойства растворов ВМС
Растворение ВМС является самопроизвольным процессом и приводит к уменьшению свободной энергии системы. Поэтому растворы ВМС являются термодинамически устойчивыми и не требуют присутствия стабилизаторов. Более того, растворы ВМС сами часто используются как стабилизаторы.
I. Осмотическое давление растворов ВМС ниже, чем истинных растворов и может быть рассчитано по уравнению
 , ,
где с – массовая концентрация полимера;
М – средняя молекулярная масса полимера;
b – коэффициент, описывающий межмолекулярные взаимодействия.
 , ,
таким образом, если экспериментальные данные представить в координатах
/с = f(с), можно определить среднюю молекулярную массу растворенного вещества. Данный метод является одним из самых точных и распространенных методов определения молекулярной массы ВМС.
II. Вязкость растворов ВМС.
Вязкость дисперсных систем описывается уравнением Эйнштейна
 , ,
где η и η0 – вязкость раствора и растворителя; ηуд– удельная вязкость.
Растворы ВМС обладают высокой вязкостью даже при низких концентрациях. Связано это с наличием в системе длинных гибких макромолекул. Вязкость в жидкости можно определить как сопротивление жидкости передвижению одного её слоя относительно другого. Громадные вытянутые макромолекулы увеличивают силу трения между слоями, и, следовательно, оказывают относительно большее сопротивление потоку, чем это следует из уравнения Эйнштейна. Вязкость растворов ВМС зависит не только от концентрации полимера, природы растворителя и температуры, но и от размеров молекул, их конформационных состояний, а также от условий измерения.
Для характеристики вязкости сильно разбавленных растворов полимеров, в которых макромолекулы не взаимодействуют друг с другом, Штаудингером предложено уравнение
 , ,
где K – константа, имеющая определенное значение для каждого полимергомологического ряда (полимеров, отличающихся только молекулярной массой); М – молекулярная масса полимера; с – концентрация раствора, выраженная в «основных молях» на дм3. «Основной моль» равен молекулярной массе мономера, из которого построена макромолекула.
Уравнение Штаудингера лежит в основе метода определения молекулярной массы полимеров, но применим только к веществам с молекулярной массой не боле 80000.
|
|
|
 Скачать 0.85 Mb.
Скачать 0.85 Mb. ,
, . рН среды. Существенное влияние оказывает на набухание полиэлектролитов, т.е. ВМС, способных в растворе диссоциировать с образованием высокомолекулярного иона. К полиэлектролитам относят белки, которые имеют как основную –NH3+ так и кислотную –СОО– группы. В кислой и щелочной среде степень набухания имеет высокое значение, что связано с одноименным избыточным зарядом макромолекул. В кислой среде идет диссоциация основных групп:
. рН среды. Существенное влияние оказывает на набухание полиэлектролитов, т.е. ВМС, способных в растворе диссоциировать с образованием высокомолекулярного иона. К полиэлектролитам относят белки, которые имеют как основную –NH3+ так и кислотную –СОО– группы. В кислой и щелочной среде степень набухания имеет высокое значение, что связано с одноименным избыточным зарядом макромолекул. В кислой среде идет диссоциация основных групп:



 еханизм солюбилизации заключается в проникновении неполярных молекул веществ, добавленных в раствор ПАВ в неполярное ядро мицеллы (или наоборот: полярных – в полярное ядро). При этом углеводородные цепи раздвигаются и объем мицеллы увеличивается. В результате солюбилизации в водных растворах ПАВ растворяются углеводородные жидкости: бензин, керосин, а также жиры, которые нерастворимы в воде.
еханизм солюбилизации заключается в проникновении неполярных молекул веществ, добавленных в раствор ПАВ в неполярное ядро мицеллы (или наоборот: полярных – в полярное ядро). При этом углеводородные цепи раздвигаются и объем мицеллы увеличивается. В результате солюбилизации в водных растворах ПАВ растворяются углеводородные жидкости: бензин, керосин, а также жиры, которые нерастворимы в воде. ругим важным свойством растворов коллоидных ПАВ является их моющее действие. Как правило, частицы загрязняющих веществ гидрофобны и не смачиваются водой. Поэтому даже при высокой температуре моющее действие воды очень мало и для его увеличения добавляют коллоидные ПАВ. При контакте моющего средства с загрязненной поверхностью молекулы ПАВ образуют адсорбционный слой на частицах грязи и очищаемой поверхности. Молекулы ПАВ постепенно проникают между частицами загрязнения и поверхностью, способствуя отрыванию частиц грязи. Загрязняющее вещество попадает внутрь мицеллы и больше не может оседать на отмываемой поверхности.
ругим важным свойством растворов коллоидных ПАВ является их моющее действие. Как правило, частицы загрязняющих веществ гидрофобны и не смачиваются водой. Поэтому даже при высокой температуре моющее действие воды очень мало и для его увеличения добавляют коллоидные ПАВ. При контакте моющего средства с загрязненной поверхностью молекулы ПАВ образуют адсорбционный слой на частицах грязи и очищаемой поверхности. Молекулы ПАВ постепенно проникают между частицами загрязнения и поверхностью, способствуя отрыванию частиц грязи. Загрязняющее вещество попадает внутрь мицеллы и больше не может оседать на отмываемой поверхности.

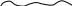 линейные полимеры образуются при полимеризации бифункциональных молекул (полиэтилен), обладают высокой гибкостью;
линейные полимеры образуются при полимеризации бифункциональных молекул (полиэтилен), обладают высокой гибкостью; пространственные (сшитые) полимеры образуются, когда функциональность мономера больше двух (фенолформальдегидные смолы), менее эластичны, обладают высокой твердостью, менее растворимы.
пространственные (сшитые) полимеры образуются, когда функциональность мономера больше двух (фенолформальдегидные смолы), менее эластичны, обладают высокой твердостью, менее растворимы. разветвленные: характерно образование боковых ответвлений от основной цепи, имеют промежуточные свойства между линейными и сшитыми (крахмал).
разветвленные: характерно образование боковых ответвлений от основной цепи, имеют промежуточные свойства между линейными и сшитыми (крахмал).
 еплота набухания (ΔH < 0), и наблюдается контракция – уменьшение объёма системы в результате сжатия растворителя 1 в сольватных оболочках и образованием связанной жидкости наряду с увеличением объёма полимера 2 (рис. 4.6).
еплота набухания (ΔH < 0), и наблюдается контракция – уменьшение объёма системы в результате сжатия растворителя 1 в сольватных оболочках и образованием связанной жидкости наряду с увеличением объёма полимера 2 (рис. 4.6).