лекции. Краткий курс лекций структурообразование в пищевых системах воро. Курс лекций структурообразование в пищевых системах
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
4.2 Лиофобные коллоидные системы 4.2.1 Эмульсии Эмульсии – это дисперсные системы, в которых дисперсная фаза и дисперсионная среда являются взаимно нерастворимыми или плохо растворимыми жидкостями. Эмульсии широко распространены в природе (нефть, млечный сок растений-каучуконосов). Эмульсиями являются многие продукты и полупродукты пищевой промышленности (молоко, майонез, маргарин, мясные бульоны). Дисперсионная среда эмульсий может быть как полярной, так и неполярной. Любую полярную жидкость принято обозначать буквой В (вода), неполярную – М (масло). Следовательно, эмульсии могут быть двух типов: 1) прямая, или эмульсия I рода, в которой неполярная жидкость диспергирована в полярной (сокращенно М/В); 2) обратная, или эмульсия II рода, в которой дисперсной фазой является полярная жидкость (В/М). Примером прямой эмульсии может служить молоко, обратной – природная нефть. Эмульсии классифицируют также по концентрации дисперсной фазы (Сдф). Различают разбавленные (Сдф 1 % об.), концентрированные (1 < Сдф 74 % об.) и высококонцентрированные (Сдф > 74 % об.) эмульсии. Получают эмульсии преимущественно механическим диспергированием (эмульгированием) одной жидкости в другой путем перемешивания, встряхивания, вибрационного воздействия, воздействия ультразвуком. С этой целью применяются коллоидные мельницы, смесители различных конструкций. Эмульсии могут быть лиофильными и лиофобными. Лиофильные эмульсии образуются самопроизвольно и являются термодинамически устойчивыми. Таких эмульсий немного, например, смазочно-охлаждающие жидкости. Большинство эмульсий – это термодинамически неустойчивые лиофобные системы, которые не могут образовываться самопроизвольно и существовать длительное время. Термодинамическая неустойчивость эмульсий обусловлена большим запасом свободной поверхностной энергии Gпов. Согласно второму закону термодинамики такие системы стремятся самопроизвольно перейти в состояние с минимумом свободной энергии. В дисперсных системах этот процесс может происходить либо за счет снижения межфазового натяжения , либо за счет уменьшения удельной поверхности S, поскольку Gпов = S. Агрегативная неустойчивость эмульсий проявляется в коалесценции – самопроизвольном слиянии капель дисперсной фазы и образовании частиц большего размера с последующим расслоением на две макрофазы с минимальной поверхностью раздела (рис. 4.7). Поэтому лиофобные эмульсии нуждаются в стабилизации. С этой целью в них вводят стабилизаторы (эмульгаторы).  Рис. 4.7. Разрушение эмульсии Действие стабилизатора основано на снижении межфазового натяжения и образовании на поверхности капель прочных адсорбционных защитных слоев, не разрывающихся при столкновении капель. При этом удельная поверхность дисперсной фазы остается неизменной, а образующаяся эмульсия становится агрегативно устойчивой. В качестве стабилизаторов эмульсий наиболее часто используют коллоидные поверхностно-активные вещества (мыла, моноглицериды жирных кислот, эфиры сахарозы, сахароглицериды) и высокомолекулярные соединения (белки, полисахариды), реже – тонкоизмельченные нерастворимые порошки (мел, глины, каолин, уголь). Свойства и тип образующейся эмульсии в большой степени зависят от природы применяемых эмульгаторов. При выборе эмульгатора необходимо руководствоваться правилом Банкрофта: эмульгатор должен обладать большим сродством к жидкости, являющейся дисперсионной средой, чтобы защитный слой образовывался снаружи капель. Так, для получения прямой эмульсии следует использовать водорастворимые ВМС, например, белки, растворимые в воде ПАВ, гидрофильные порошки; обратную эмульсию стабилизируют жирорастворимыми ВМС и ПАВ, гидрофобными порошками. Выбор эмульгатора можно производить, исходя из его гидрофильно-липофильного баланса (ГЛБ): где Вi – групповое число. П 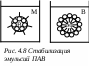 АВ с числом ГЛБ = 8 13 лучше растворимы в воде, чем в масле (т.е. имеют более выраженные гидрофильные свойства), поэтому стабилизируют прямые эмульсии. ПАВ с числом АВ с числом ГЛБ = 8 13 лучше растворимы в воде, чем в масле (т.е. имеют более выраженные гидрофильные свойства), поэтому стабилизируют прямые эмульсии. ПАВ с числом ГЛБ = 3 6 стабилизируют обратные эмульсии. На рис. 4.8 представлена схема расположения дифильных молекул ПАВ на поверхности капелек эмульсий. Стабилизирующее действие эмульгатора зависит не только от его природы, но и от концентрации в системе. Каждый эмульгатор имеет определенную оптимальную концентрацию, при которой достигается максимальный эффект стабилизации эмульсии. При определенных условиях эмульсии одного типа могут превращаться в эмульсии другого типа. Это явление называется обращением фаз эмульсий. Обращение фаз эмульсий можно вызвать изменением природы эмульгатора. Так, олеат натрия стабилизирует прямую эмульсию. При постепенном добавлении к этой эмульсии соли кальция образуется нерастворимый в воде олеат кальция, который является стабилизатором обратной эмульсии. На практике нередко возникает задача разрушения эмульсии – деэмульгирование. Разрушение эмульсий может быть достигнуто химическим, механическим, термическим воздействием. Типичным примером разрушения эмульсий является центрифугирование, например, сепарирование молока. Химическое воздействие сводится к разрушению или вытеснению эмульгатора. Роль деэмульгаторов могут выполнять минеральные кислоты, а также ПАВ, которые по сравнению с эмульгатором обладают большей поверхностной активностью, но не способны образовывать прочных защитных слоев. Применение эмульсий 1. Пищевая промышленность. Многие пищевые продукты представляют собой эмульсии. Молоко – эмульсия типа М/В: дисперсная фаза – капли жира, дисперсионная среда – вода с растворенными в ней минеральными веществами, белками, молочным сахаром. Роль стабилизатора играют белки, обволакивающие наружную поверхность жировых капель. Майонез – концентрированная эмульсия растительного масла. Дисперсионной средой является вода, содержащая яичный желток, уксус, горчицу, специи. Маргарин – концентрированная эмульсия типа В/М. В мясной промышленности к эмульсиям относят тонкоизмельченные колбасные фарши: эмульгированные частицы жира являются дисперсной фазой, вода с растворенными в ней белками – дисперсионной средой. Мясной фарш является сложной дисперсной системой. 2. Фармацевтическая промышленность. Многие лекарства готовят в виде эмульсий. 4.2.2 Пены Пены – высококонцентрированные дисперсные системы, состоящие из пузырьков газа, отделенных друг от друга тонкими твердыми или жидкими пленками, т.е. дисперсной фазой является газ, а дисперсионной средой - жидкость или твердое вещество. Разбавленные дисперсные системы типа г/ж с с концентрацией дисперсной фазы < 0,1 % представляют собой газовые эмульсии. Важная характеристика пен – кратность, показывает, во сколько раз объем пены Vп превышает объем жидкости Vж, необходимый для ее формирования: Если < 10, то это жидкие пены; 10 100 – полусухие пены; 100 – сухие пены. Образование устойчивой пены в чистой жидкости невозможно. Наличие пены всегда свидетельствует о присутствии в жидкости посторонних веществ. Пену можно получить только в присутствии стабилизатора – пенообразователя. Пены, как и другие дисперсные системы являются термодинамически неустойчивыми системами. Их образование сопровождается повышением свободной энергии. Избыточная энергия вызывает самопроизвольные процессы, которые ведут к уменьшению дисперсности и разрушению пены. Факторы устойчивости пен Факторы, связанные с наличием пенообразователя. В качестве пенообразователей используют коллоидные ПАВ и ВМС. Типичные пенообразователи – спирты, мыла, белки, сапонин. Низкомолекулярные ПАВ, уменьшая поверхностное натяжение, облегчают образование пены, но не придают ей стабильности, пена быстро разрушается. Пенообразователи с длинной молекулярной цепью, адсорбируясь на границе вода-воздух формируют высоковязкую структурированную пленку, препятствующую истечению жидкости из прослоек дисперсионной среды. Пена может существовать длительное время. Факторы, связанные со свойствами дисперсионной среды: – вязкость: чем больше вязкость среды, тем устойчивее пены; – рН: максимальное пенообразование обычно наблюдается при РН = 8 9 при использовании в качестве пенообразователей жирных кислот и их щлочных солей. – наличие в жидкости низкомолекулярных электролитов: в жесткой воде (в присутствии большого количества солей) кратность и устойчивость пен невысока. Факторы, связанные с внешними воздействиями – температура: чем выше температура, тем ниже устойчивость пен; – механическое воздействие – сотрясение, ветер – отрицательно влияют на устойчивость пен. Методы разрушения пен На практике иногда необходимо исключить пенообразование, как нежелательный процесс. Для разрушения пены применяют механические, физические и химические способы. Механические способы осуществляют струей воздуха или пара, а также с помощью специальных механических устройств: диспергаторов, крыльчатки, вакуумных устройств. Физические способы подразделяются на: – термические (пены разрушаются при нагревании или охлаждении), воздействие перегретым паром; – акустические (воздействие ультразвука) – электрические (разрушение под действием электрического поля) Химические способы основаны на применении пеногасителей. Для пеногасителей характерна специфичность действия: вещества, вызывающие гашение пены в одной среде, малоэффективны в другой. В качестве пеногасителей применяют природные жиры и масла, органические кислоты, кремнийорганические соединения, силиконовые масла, спирты, эфиры. Широкое распространение получили пеногасители из семейства кремнийорганических ВМС, они устойчивы, химически инертны, дешевы. Действие пеногасителей заключается в вытеснении пенообразователя с поверхности жидкости или образовании с ним нерастворимых или малорастворимых соединений. Практическое применение пен Многие пищевые продукты представляют собой пены: хлебобулочные изделия, муссы, коктейли, кремы, зефир. На образовании пены основана пеносушка – сушка с предварительным вспениванием, обеспечивает получение сухих продуктов с тонкой структурой. Используется при производстве сухого картофельного пюре, кофе, порошков для приготовления напитков. Пены применяют в пожаротушении. Библиографический список 1. Краткий справочник физико-химических величин [Текст] / под ред. А. А. Равделя, А. М. Пономаревой. – СПб.: Спец. лит-ра, 2002. 2. Щукин, Е. Д. Коллоидная химия [Текст] / Е. Д. Щукин, А. В. Перцов, Е. А. Амелина. – М.: Высшая школа, 2004. – 445 с. 3. Зимон, А.Д. Коллоидная химия [Текст] / А. Д. Зимон, Н. Ф. Лещенко. – М.: Агар, 2003. |
