коллойдные растворы. Реферат Коллоидные системы
 Скачать 1.28 Mb. Скачать 1.28 Mb.
|
|
Реферат Коллоидные системы 1. ПОЛУЧЕНИЕ ЛИОФОБНЫХ КОЛЛОИДНЫХ СИСТЕМ. ОПТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ коллоидный лиофобный поверхностный натяжение Лиофобные коллоидные системы можно получить как из неорганических, так и из органических веществ, если эти вещества практически нерастворимы в дисперсионной среде. Коллоидные системы - гетерогенные высокодисперсные (размер частиц 10-7 - 10-9 м) системы, которые состоят из двух фаз: дисперсионной среды и дисперсной фазы. Коллоидные системы могут существовать в основном в двух видах: золи и гели. Золь - от лат. «solutio» - раствор, т.е. высокодисперсные системы с жидкой дисперсионной средой. Гель - это связнодисперсные системы, в которых возникает контакт частиц дисперсной фазы, приводящий к образованию структуры в виде каркаса. Способы получения коллоидных систем Коллоидные системы могут быть получены двумя способами: конденсацией, т.е. путем ассоциации молекул или ионов истинных растворов, и диспергированием (от лат. «dispergere» - рассеивать), т.е. раздроблением частиц дисперсной фазы грубодисперсных систем до нужной степени дисперсности. Известны случаи самопроизвольного диспергирования дисперсной фазы в дисперсионной среде. Для придания частицам устойчивости против слипания (агрегативной устойчивости) необходимо создание на поверхности частиц защитных слоёв: двойных ионных слоев, вызывающих электростатическое отталкивание (электростатический фактор устойчивости), и сольватных, или адсорбционно-сольватных, слоев, препятствующих в силу своих особых структурно-механических свойств соприкосновению и слипанию частиц (структурно-механический фактор стабилизации). Важное условие для получения устойчивой коллоидной системы - присутствие веществ, которые, адсорбируясь на поверхности коллоидных частиц, создавали бы достаточно интенсивное взаимодействие между поверхностью частиц и окружающей их средой. Вещества, обусловливающие устойчивость коллоидных растворов, называются стабилизаторами. Диспергационные методы . Механическое диспергирование - измельчение твердых тел в данной среде в присутствии стабилизаторов в шаровых или коллоидных мельницах, с помощью измельчителей или ультразвука, вольтовой дуги и т.д. . Физико-химическое дробление осадков (пептизация) - это метод уменьшения размеров частиц свежеполученных осадков до коллоидных размеров (т.е. пептизация является процессом, как бы обратным коагуляции). Различают следующие виды пептизации: пептизация осадка электролитом - адсорбционная пептизация - отталкивание частиц осадка друг от друга вызывается двойными ионными слоями, образованными на поверхности частиц за счет адсорбции ионов добавляемого электролита-пептизатора; пептизация путем поверхностной диссоциации - образование двойного ионного слоя за счет диссоциации молекул на поверхности твердой фазы (например, образование растворимых соединений); пептизация путем промывания осадка - применяется в случае высокой концентрации электролита, когда на поверхности частиц осадка есть двойные ионные слои, но они сжаты. Промывание водой уменьшает концентрацию электролита, что приводит к увеличению двойного ионного слоя и силы электростатического отталкивания и вызывает коллоидное растворение осадка. Различают пептизацию непосредственную и посредственную,в зависимости от того, что адсорбируется на поверхности частиц перед их разделением: прибавленное вещество (стабилизатор) или продукт его взаимодействия с веществом частиц. Конденсационные методы 1. Физическая конденсация - конденсация без химической реакции, практически осуществляемая разными путями: охлаждением раствора; пропусканием паров одного вещества в другое; заменой растворителя - молекулярный раствор какого-либо вещества постепенно, при перемешивании прибавляют к жидкости, в которой это вещество не растворимо, при этом происходит конденсация молекул и образование коллоидных частиц. . Химическая конденсация - получение коллоидных систем с помощью химических реакций: окислительно-восстановительных, двойного обмена, гидролиза и других. При получении коллоидных систем методом физической конденсации следует руководствоваться тем, что необходимым условием существования их является нерастворимость вещества в растворителе. При получении коллоидных растворов методом химической конденсации необходимыми условиями являются: а) использование разбавленных растворов, чтобы скорость роста кристаллических частиц была невелика, тогда частицы получаются мелкие (10-7 - 10-9 м) и системе будет обеспечена седиментационная устойчивость; б) избыток одного из реагентов по сравнению с другим, обеспечивающий формирование двойного ионного слоя на поверхности кристаллических частиц - основного фактора агрегативной устойчивости. Двойной ионный слой со связанной с ним сольватной оболочкой обеспечивает агрегативную устойчивость золя. Знак заряда коллоидной частицы зависит от соотношения реагентов при проведении реакции получения золя. Строение коллоидных частиц 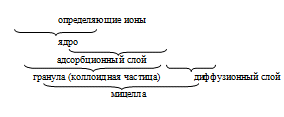 По правилу Фаянса ‒ Панета из растворов на поверхности агрегата адсорбируются ионы, которые способны достраивать его кристаллическую решетку, т.е. ионы, из которых построена данная решетка, или изоморфные им; или ионы, которые могут образовывать с ионами кристаллической решетки малорастворимые соединения. Наличие одноименного заряда у всех гранул или коллоидных частиц является важным фактором устойчивости. Определение знака заряда коллоидных частиц Знак заряда коллоидных частиц золей можно определить методом электрофореза, а для окрашенных золей - методом капиллярного анализа. Согласно методу капиллярного анализа знак заряда коллоидных частиц определяется по характеру взаимодействия их с целлюлозой. Некоторые вещества при погружении в воду заряжаются отрицательно (целлюлоза, шелк, стекло, песок и др.), а пропитывающая вещество вода - положительно. Если на лист фильтровальной бумаги нанести каплю исследуемого золя, то частицы, заряженные положительно, адсорбируются на стенках капилляров, и золь с положительными частицами дает окрашенное пятно в центре и бесцветное по краям. Если в воде находятся отрицательно заряженные коллоидные частицы, то они не притягиваются капиллярами поверхности бумаги (заряженными отрицательно) и капля золя образует равномерно окрашенное пятно. При исследовании бесцветного коллоидного раствора, пропитанную раствором фильтровальную бумагу следует высушить и обработать реактивом, окрашивающим коллоидные частицы. Используя метод электрофореза для определения знака заряда частиц окрашенного и неокрашенного золя, раствор помещают в U-образную трубку, в обоих коленах которой находятся медные электроды. При подключении источника постоянного тока положительно заряженные частицы накапливаются у отрицательного электрода, что можно наблюдать по признаку усиления мути. У противоположно заряженного электрода, т.е. положительного, золь просветляется. Оптические свойства коллоидных систем Высокодисперсный коллоидный раствор внешне не отличается от истинного (молекулярного раствора) раствора. Отличие между ними можно установить по оптическим свойствам. Золи способны рассеивать свет, в результате чего наблюдается: а) конус Тиндаля, не образующийся при прохождении светового луча через сосуд с истинным раствором; б) опалесценция - различие окраски коллоидного раствора в проходящем и отраженном свете. Для коллоидных систем с частицами меньшими, но соизмеримыми с длиной волны падающего света, характерно поглощение (адсорбция) и рассеяние света. Когда длина волны падающего света велика сравнительно с линейными размерами светорассеивающей частицы, то в этом случае наблюдается дифракция световой волны, вызывающей светорассеяние. Такое светорассеяние и является причиной эффекта Тиндаля, или «конуса Тиндаля». Если по внешнему виду коллоидный раствор трудно отличить от истинного, то коллоидную природу полученного раствора подтверждают путем наблюдения в сильном световом луче, проходящем через заполненную раствором кювету с плоскопараллельными стенками. В качестве источника света может служить проекционный фонарь или любой источник направленного светового пучка. Цвет опалесценции золей преимущественно голубой. Объясняется это тем, что желтые и красные лучи (с большой длиной волны) мало рассеиваются и проходят через систему, а голубые и синие (с меньшей длиной волны) хорошо рассеиваются. . ОПРЕДЕЛЕНИЕ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ РАСТВОРОВ ПАВ И МЕЖФАЗНОГО НАТЯЖЕНИЯ НА ГРАНИЦЕ ДВУХ НЕСМЕШИВАЮЩИХСЯ ЖИДКОСТЕЙ СТАЛАГМОМЕТРИЧЕСКИМ МЕТОДОМ Поверхностное натяжение (σ) возникает на границе раздела фаз. Молекулы на границах раздела фаз не полностью окружены другими молекулами того же вида по сравнению с соответствующими молекулами в объеме фазы, поэтому поверхность раздела фаз в межфазном поверхностном слое всегда является источником силового поля. Результат этого явления - нескомпенсированность межмолекулярных сил и наличие внутреннего или молекулярного давления. Для увеличения площади поверхности необходимо вывести молекулы из объемной фазы в поверхностный слой, совершив работу против межмолекулярных сил. Приращение свободной поверхностной энергии при увеличении поверхности на 1 см2 представляет собой удельную свободную энергию и обозначается символом σ. Величину σ называют также поверхностным натяжением и рассматривают как силу, стягивающую поверхность. В условиях постоянства V, T, состава системы - δA = dF: В условиях постоянства p, T, состава системы - δA = dG: Методы определения поверхностного натяжения жидкостей Существующие методы определения поверхностного натяжения разделяются на III основные группы:. Статические методы: ) метод капиллярного поднятия; ) метод вращающейся капли; ) метод Вильгельми, или метод уравновешивания пластинки.. Полустатические методы: ) метод максимального давления образования пузырька или капли; ) метод отрыва кольца (метод Дю-Нуи); ) сталагмометрический метод (метод взвешивания и счета капель).. Динамические методы: ) метод колеблющихся струй; ) метод нулевой ползучести; ) метод расщепления. В основе большинства статических и полустатических методов измерения поверхностного натяжения лежит метод капиллярности с основополагающим уравнением Лапласа. Наиболее теоретически разработанные методы связаны с измерением разности давлений по обе стороны поверхности раздела фаз, т.е. капиллярного давления. Поскольку кривизну поверхности измерить трудно, то ее оценивают на основании других параметров, например, связывая ее с радиусом капилляра, формирующего мениск. Статические методы основаны на изучении устойчивого равновесного состояния, к которому самопроизвольно приходит изучаемая система, что позволяет получать истинно равновесные значения поверхностного натяжения. Метод капиллярного поднятия основан на формуле Жюрена При этом применяются тонкие капилляры, что обеспечивает сферичность мениска. Этот метод может давать точность измерения поверхностного натяжения до десятых и сотых долей Метод вращающейся капли позволяет измерять очень низкие значения межфазного натяжения на границах двух жидкостей. При использовании этого метода трубка, заполненная жидкостью, приводится в движение вращением вокруг своей оси (рис. 1). В трубку вводится капля другой жидкости с меньшей плотностью ρ2. За счёт действия центробежных сил эта менее плотная жидкость стремится расположиться ближе к оси вращения и вытягивается в тонкий столбик.  Рис. 1. Равновесная форма вращающейся капли Измеряя размеры столбика и скорость вращения ω, при известной разности плотностей жидкостей (ρ1 - ρ2) можно определить натяжение межфазной поверхности: Метод Вильгельми, или метод уравновешивания пластинки. Закреплённую на коромысле весов тонкую пластину шириной d погружают в жидкость (рис. 2). Пластина хорошо смачивается этой жидкостью. На поверхности пластины с обеих сторон образуются мениски. Их форма и максимальная высота поднятия определяется уравнением Лапласа.  Рис. 2. Условие равновесия при изменении поверхностного натяжения по методу Вильгельми Суммарный вес поднятой жидкости на единицу длины периметра пластины не зависит от формы мениска и при нулевом краевом угле смачивания равен поверхностному натяжению Метод Вильгельма один из наиболее точных методов определения поверхностного натяжения, не требующий введения каких-либо поправок. Если платиновая или стеклянная пластина установлена так, что её нижняя поверхность будет располагаться строго на уровне поверхности, то где F - сила, необходимая для преодоления сил, втягивающих пластину внутрь жидкости, т.е. для уравновешивания пластины при её возвращении в начальное положение; l и b - ширина и толщина пластины. Полустатические методы определения поверхностного натяжения основаны на достижении системой некоторого равновесного состояния, но это равновесие неустойчиво. Метод максимального давления образования пузырька или капли. Под действием приложенного извне избыточного давления Δp через калиброванный капилляр в объём жидкости продавливается пузырёк газа или капля другой жидкости. По мере роста пузырька радиус кривизны его поверхности r уменьшается и достигает минимального значения, равного радиусу капилляра r0, когда поверхность пузырька приобретает форму полусферы (рис. 3). При r = r0капиллярное давление  Рис. 3. Изменение радиуса кривизны поверхности пузырька при изменении поверхностного натяжения по методу наибольшего давления Если избыточное давления Δp меньше максимального давления Если Метод отрыва кольца (метод Дю-Нуи) основан на измерении усилия F, необходимого для отрыва от поверхности жидкости тонкого кольца радиусом rк, хорошо смачиваемого жидкостью (θ = 0º) (рис. 4). В первом приближении можно считать, что значение поверхностного натяжения обратно пропорционально длине периметра кольца 2π rк, т.е.  Рис. 4. Изменение поверхностного натяжения по методу отрыва кольца Метод Дю-Нуи достаточно точен и часто используется для определения поверхностного натяжения жидкостей. Его редко применяют для определения межфазного натяжения на границе ж - ж, поскольку в этом случае трудно реализовать условие θ = 0º. Сталагмометрический метод (метод взвешивания и счета капель) широко применяется для определения межфазного натяжения ж - ж. Основан на определении веса капли, отрывающейся под действием силы тяжести от плоской поверхности торцевого среза капилляра. Расчет проводят по формуле где f (r/a) - некоторая функция, определяемая из таблиц Гаркинса и Брауна; а - капиллярная постоянная. В грубом приближении можно считать, что в момент отрыва капли её вес Р уравновешивается силами поверхностного натяжения: Если жидкости |
