Курсовая Стрептомицин. Курсовая Наливкина. Курсовая работа контроль качества лекарственных средств, изготовленных в аптеке
 Скачать 43.52 Kb. Скачать 43.52 Kb.
|
|
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «УФИМСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ» КУРСОВАЯ РАБОТА КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ИЗГОТОВЛЕННЫХ В АПТЕКЕ МДК 01.02 Отпуск лекарственных средств и товаров аптечного ассортимента 33.02.01 Фармация Студент Наливкина Н.И. подпись 05.04.2020 г. Оценка выполнения и защиты курсовой работы ______________ Руководитель Красовский И.А. подпись 30.04.2020 г. Уфа, 2020 СОДЕРЖАНИЕ Введение Нормативные документы и требования к качеству лекарственных средств аптечного изготовления Предупредительные мероприятия Приемочный контроль Письменный контроль Опросный контроль Особенности экспресс-анализа лекарственных средств аптечного производства Особенности определения подлинности экспресс-методом Особенности количественного экспресс-анализа Основные этапы экспресс-анализа Органолептический контроль Физический контроль Химический контроль Испытания на подлинность Количественный анализ Заключение Список литературы Введение Контроль качества лекарственных средств, изготовляемых в аптеках, в настоящее время контролируется в соответствии с требованиями, регламентированными ГФ и действующими НТД. Эти требования распространяются на все аптеки, включая гомеопатические, независимо от форм собственности и ведомственной принадлежности. Изготовление ЛС по индивидуальным прописям, в виде внутриаптечной заготовки, а также концентратов и полуфабрикатов считается законченным только после оценки качества их изготовления и правильности оформления. В экстемпоральной рецептуре аптек определенный объем составляют многокомпонентные ЛФ: глазные капли, лекарства, изготовленные по индивидуальным рецептам и требованиям лечебных учреждений, внутриаптечные заготовки. Особо важную роль занимают лекарственные средства для новорожденных детей и инъекционные растворы, поэтому контроль качества экстемпоральных ЛФ является важным этапом в сохранении физико-химических свойств, фармакологического эффекта ЛС и, соответственно, здоровья пациентов. Лекарственные формы содержат, как правило, 3-4 и более веществ из различных групп химических соединений, для идентификации и количественного определения которых необходимы быстрые и достоверные методики анализа Целью настоящей работы является ознакомление с процессом контроля качества на всех его этапах, а также более подробное знакомство с методами качественного и количественного определения. Нормативные документы и требования к качеству лекарственных средств аптечного производства.Вся производственная деятельность аптеки должна быть направлена на обеспечение высококачественного изготовления лекарственных средств. Одним из важнейших факторов, определяющих качество ЛС, изготовляемых в аптеке, является организация внутриаптечного контроля. Внутриаптечный контроль – комплекс мероприятий, направленных на своевременное выявление и предупреждение ошибок, возникающих в процессе изготовления, оформления и отпуска лекарств. Лекарства аптечного производства подвергаются нескольким видам контроля в зависимости от характера лекарственной формы. Система внутриаптечного контроля качества лекарственных средств предусматривает проведение предупредительных мероприятий, приемочного, органолептического, письменного, опросного, физического, химического контроля и контроля при отпуске. Согласно инструкции МЗ РФ «О контроле качества ЛС, изготовляемых в аптеках» (Приказ №214 от 16.07.1997 г.), все ЛС подвергаются внутриаптечному контролю: органолептическому, письменному и контролю при отпуске – обязательно, опросному и физическому – выборочно, а химическому, в соответствии с пунктом 8 данного приказа. 2. Предупредительные мероприятия.Большое значение в обеспечении фармацевтического порядка и качества изготовления ЛС имеет организация и проведение предупредительных мероприятий. К ним относится соблюдение санитарных норм и правил противоэпидемического режима, правил асептики при изготовлении ЛС в соответствии с действующими нормативными документами, инструкциями и приказами. Все это способствует изготовлению высококачественных ЛС. Соблюдение требований и правил получения, сбора, хранения и изъятия для испытаний на стерильность воды очищенной, воды для инъекций, стерильных растворов, требований к приготовлению и контролю качества растворов для новорожденных, а также правил приготовления ЛС в асептических условиях, изготовления нестерильных ЛС определены «Инструкцией по санитарному режиму аптечных учреждений (аптек)», утвержденной Приказом МЗ РФ №309 от 21 октября 1997 г. Чем строже соблюдается санитарный режим, тем меньше микробная загрязненность ЛС. Предупредительные мероприятия включают обеспечение исправности и точности приборов, аппаратов и весового хозяйства, систематической их проверки. Важное значение имеет контроль за правильностью выписываемых рецептов и требований лечебных учреждений, за соблюдением технологии ЛС, ее соответствием требованиям ГФ, НД и методических указаний, действующих приказов и инструкций. Любые отклонения и нарушения норм метрологии и технологии влияют на качество изготавливаемых ЛС. Приготовление ЛС по индивидуальным прописям, а также внутриаптечной заготовки, концентратов и полуфабрикатов считается законченным только после оценки их качества и правильности оформления. В аптеке должны быть созданы необходимые условия для хранения ЛС в соответствии с их физико-химическими свойствами и требованиями ГФ, чтобы они выдерживали установленные НД сроки годности. Особые требования предъявляются в аптеке к правильности оформления и заполнения штангласов. В помещениях хранения на всех штангласах с ЛС должны быть указаны: Номер серии предприятия-изготовителя; Номер анализа КАнЛ (ЦККЛ); Срок годности; Дата заполнения и подпись заполнившего штанглас; На штангласах, заполненных ЛС, содержащими сердечные гликозиды, должно быть указано количество ЕД/г ЛРС или ЕД/мл ЛС. В ассистентских комнатах на всех штангласах с ЛВ должны быть указаны: дата заполнения, подпись заполнившего штанглас и проверившего подлинность ЛВ. На штангласах с ЛВ списков А и Б должны быть указаны высшие разовые и суточные дозы, а на штангласах с ЛВ, предназначенными для изготовления стерильных ЛФ, — предупредительная надпись: «Для стерильных лекарственных форм». Штангласы с растворами, настойками, концентратами должны быть обеспечены нормальными каплемерами или пипетками. На штангласе указывается число капель в определенном объеме. Заполнение штангласа или бюретки в бюреточной установке должно производиться только после полного использования ЛС и соответствующей обработки штангласа (бюретки). 3. Приемочный контроль.Цель приемочного контроля — предупреждение поступления в аптеку некачественных ЛС. Он заключается в проверке всех поступающих ЛС на соответствие требованиям ФС по показателям: «Описание», «Упаковка», «Маркировка», а также наличия сертификатов и других документов, подтверждающих качество ЛС в соответствии с действующими приказами и инструкциями. Этот вид контроля осуществляет зав. отделом запасов. Контроль по показателю «Описание» предусматривает проверку внешнего вида, запаха. В случае сомнения в качестве образцы ЛС направляются в КАнЛ (ЦККЛ). Эти ЛС хранятся в аптеке изолированно от других с обозначением «Забраковано при приемочном контроле». При проверке по показателю «Упаковка» главное внимание обращается на ее целостность и соответствие упаковки физико-химическим свойствам лекарственных средств. При контроле по показателю «Маркировка» уделяют внимание правильности оформления этикетки, а также соответствию маркировки на первичной, вторичной и групповой упаковке и наличию листовки-вкладыша (на русском языке). На этикетках должны быть указаны: предприятие-изготовитель, название ЛС, масса или объем, концентрация или состав, номер серии, номер анализа, срок годности, дата фасовки. На ЛС, содержащих сердечные гликозиды, должно быть указано количество ЕД/г ЛРС или ЕД/мл ЛС. Если ЛС предназначены к изготовлению растворов для инъекций и инфузий, то на этикетке должно быть указано «Годен для инъекций». Упаковки с ядовитыми и наркотическими ЛС должны быть оформлены в соответствии с требованиями действующих приказов и инструкций. Лекарственное растительное сырье, поступающее от населения, проверяется по показателю «Внешние признаки» в соответствии с требованиями ГФ или другой НД, после чего направляется на анализ в территориальную КАнЛ (ЦККЛ). 4. Письменный контроль.Письменный контроль осуществляет провизор-технолог. Суть его состоит в оформлении паспортов письменного контроля при изготовлении ЛФ по рецептам и требованиям лечебных учреждений. В паспорте должны быть указаны: дата изготовления, номер рецепта (номер больницы), наименования взятых ЛВ, их количества, число доз, подписи изготовившего, расфасовавшего и проверившего изготовленную ЛФ. Все расчеты должны производиться до изготовления ЛФ и записываться на оборотной стороне паспорта. Паспорт заполняется немедленно после изготовления ЛФ, по памяти, на латинском языке, в соответствии с последовательностью технологических операций. В случае использования полуфабрикатов и концентратов в паспорте указываются их состав, концентрация, взятый объем или масса. При изготовлении порошков, суппозиториев, пилюль указываются общая масса, количество и масса отдельных доз. Общая масса пилюль или суппозиториев, концентрация и объем (масса) изотонирующих и стабилизирующих веществ, добавленных в глазные капли, растворы для инъекций (инфузий), должны быть указаны не только в паспортах, но и на рецептах. Ведение паспортов письменного контроля обязательно и в том случае, когда ЛФ изготавливаются и отпускаются одним и тем же лицом. Паспорт при этом заполняется в процессе изготовления ЛФ. Изготовленные ЛФ, рецепты и паспорта передаются фармацевтом на проверку провизору-технологу, который осуществляет контроль. Суть контроля состоит в установлении соответствия записей в паспорте и в рецепте, а также в проверке правильности расчетов. Если провизором-аналитиком проведен полный химический контроль качества данного Л С, то на паспорте проставляется номер анализа и подпись провизора-аналитика. Паспорт письменного контроля хранится в аптеке в течение двух месяцев. 5. Опросный контроль.Опросный контроль осуществляется провизором-технологом в течение рабочего дня после изготовления фармацевтом не более пяти ЛФ. Суть опросного контроля состоит в том, что провизор-технолог называет первое входящее в ЛФ лекарственное вещество, а при контроле ЛФ сложного состава указывает также его количество. После этого фармацевт должен назвать все остальные ЛВ, входящие в ЛФ, и их количества. При использовании для приготовления ЛФ полуфабрикатов или концентратов фармацевт называет их состав и концентрацию. 6.Особенности экспресс-анализа лекарственных средств аптечного производства.Необходимость внутриаптечного контроля обусловлена соответствующими высокими требованиями к качеству лекарственных средств, изготовляемых в аптеках. Поскольку изготовление и отпуск лекарственных препаратов в аптеках ограничиваются сжатыми сроками, оценку их качества осуществляют экспресс-методами. Основные требования, предъявляемые к экспресс-анализу: Расход минимальных количеств лекарственных средств при достаточной точности и чувствительности; Простота и быстрота выполнения (по возможности без разделения ингредиентов); Возможность проведения анализа без изъятия приготовленного лекарственного препарата. 6.1.Особенности определения подлинности экспресс-методом.Основное отличие определения подлинности экспресс-методом от макроанализа заключается в использовании малых количеств исследуемых смесей без их разделения. Анализ выполняют капельным методом в микропробирках, фарфоровых чашках, на часовых стеклах, при этом расходуется от 0,001 до 0,01 г порошка или 1-5 капель исследуемой жидкости. Для упрощения анализа достаточно проведения одной реакции для вещества, причем наиболее простой, например, для атропина сульфата достаточно подтвердить наличие сульфат-иона, для папаверина гидрохлорида - хлорид-иона. 6.2.Особенности количественного экспресс-анализа.Количественный анализ может быть выполнен титриметрическими или физико-химическими методами. Титриметрический экспресс-анализ отличается от макрометодов расходом меньших количеств анализируемых препаратов: 0,05-0,1 г порошка или 0,5-2 мл раствора, причем точную массу порошка можно отвешивать на ручных весах; для повышения точности можно использовать разбавленные растворы титрантов: 0,01-0,02 моль/л. Навеску порошка или объем жидкой лекарственной формы берут с таким расчетом, чтобы на определение расходовалось 1-3 мл раствора титранта. Из физико-химических методов в аптечной практике широко используется экономичный метод рефрактометрии при анализе концентратов, полуфабрикатов и других лекарственных форм. 7.Основные этапы экспресс-анализа.7.1.Органолептический контроль.Является обязательным и проводится провизором-технологом или провизором-аналитиком. Органолептический контроль заключается в проверке каждой ЛФ (в т.ч. гомеопатической) по показателям: «Описание», включая внешний вид, запах, однородность, отсутствие механических включений (в жидких ЛФ). На вкус проверяются выборочно ЛФ, предназначенные для детей. Однородность порошков, гомеопатических тритураций, мазей, пилюль, суппозиториев проверяется до разделения массы на дозы в соответствии с требованиями ГФ. Проверка однородности этих ЛФ осуществляется выборочно у каждого фармацевта в течение рабочего дня. 7.2.Физический контроль.Выполняется провизором-аналитиком и заключается в проверке общей массы (объема) ЛФ, количества и массы отдельных доз (не менее трех), входящих в данную ЛФ. Физическому контролю подлежат: каждая серия фасовки и внутриаптечной заготовки (включая фасовку промышленной продукции и гомеопатических ЛС) — не менее трех упаковок; ЛФ, изготавливаемые по индивидуальным рецептам (требованиям), выборочно в течение рабочего дня с учетом всех видов ЛФ, но не менее 3% от количества ЛФ, изготовленных за день; каждая серия ЛФ, требующих стерилизации после расфасовки (до стерилизации), в количестве не менее пяти флаконов (бутылок); число гомеопатических гранул в определенной массе навески в соответствии с требованиями НД. Нормы отклонений, допустимых при изготовлении ЛФ, регламентируются «Инструкцией по оценке ЛС, изготавливаемых в аптеке», утвержденной Приказом МЗ РФ №305 от 16.10.97 г. 7.3.Химический контроль.Выполняется только провизором-аналитиком и заключается в оценке качества изготовленного ЛС по показателям «Подлинность», «Испытания начистоту и допустимые пределы примесей» (качественный анализ) и «Количественное определение» (количественный анализ) лекарственных веществ, входящих в его состав. Качественный анализ выполняется обязательно или выборочно в зависимости от объекта исследования, также обязательным или выборочным может быть полный химический контроль, включающий как качественный, так и количественный анализ. Обязательно подвергаются качественному анализу: вода очищенная, вода для инъекций ежедневно (из каждого баллона, а при подаче воды по трубопроводу — на каждом рабочем месте) на отсутствие: хлоридов Cl-+AgNO3→AgClv+NO3- сульфатов SO42-+BaCl2→BaSO4v+Cl- солей кальция Ca2++C2O42-→C2O4Cav Вода для приготовления инъекционных растворов подвергается дополнительным испытаниям на наличие: восстанавливающих веществ: MnO4+5e-+8H→Mn2++4H2O солей аммония: NH4+2[HgJ4]+2H2O→[J2Hg2NH2]J-+5J-+2H2O диоксида углерода: CO2+Ca(OH)2→CaCO3+H2O (в соответствии с требованиями ГФХ1). Выборочному качественному анализу подлежат: ЛФ, изготовленные по индивидуальным рецептам и требованиям лечебных учреждений, у каждого фармацевта в течение дня, но не менее 10% от общего количества изготовленных ЛФ. Проверке при этом подвергаются различные виды ЛФ, но особое внимание уделяется: ЛФ для детей, ЛФ, применяемым в глазной практике, ЛФ, содержащим наркотические и ядовитые вещества, гомеопатическим ЛФ четвертого десятичного разведения, содержащим ядовитые и сильнодействующие вещества различной химической природы. Результаты качественного анализа регистрируются в журнале. Обязательному полному химическому контролю (качественному и количественному анализу) подвергаются: все растворы для инъекций и инфузий до стерилизации, включая определение рН изотонирующих и стабилизирующих веществ; у тех же растворов после стерилизации проверяются значение рН, подлинность и количественное содержание действующих веществ (стабилизаторы после стерилизации проверяются в случаях, предусмотренных инструкциями и НД); стерильные растворы для наружного применения (интравагинальные, офтальмологические — для орошений, растворы для лечения ожогов, открытых ран и др.; глазные капли и мази, содержащие наркотические и ядовитые вещества (содержание изотонирующих и стабилизирующих веществ в глазных каплях проверяется до стерилизации); все лекарственные формы для новорожденных детей; растворы атропина сульфата и кислоты хлористоводородной (для внутреннего употребления), растворы ртути дихлорида и серебра нитрата; все концентраты, полуфабрикаты, тритурации, в т.ч. жидкие гомеопатические разведения и их тритурации; вся внутриаптечная заготовка ЛС (каждая серия); стабилизаторы, применяемые при приготовлении растворов для инъекций, и буферные растворы, используемые при изготовлении глазных капель; концентрация спирта этилового при разведении в аптеке, в случае необходимости — при приеме в аптеку со склада, а также в водно-спиртовых гомеопатических растворах и каплях (каждая серия); гомеопатические гранулы на распадаемость (каждая серия) в соответствии с требованиями НД. В порядке исключения сложные по своему составу ЛФ для новорожденных детей и гомеопатические ЛФ, не имеющие методик качественного и количественного анализа, изготавливаются под наблюдением провизора-аналитика или провизора-технолога, или на них выполняются только качественные реакции. Выборочному полному химическому контролю подвергаются: ЛФ, изготовленные в аптеке по индивидуальным рецептам или требованиям лечебных учреждений — не менее трех при работе в одну смену с учетом всех видов ЛФ. Особое внимание при этом уделяется на: ЛФ для детей, ЛФ, применяемые в глазной практике, ЛФ, содержащие наркотические и ядовитые вещества, растворы для лечебных клизм. 7.3.1.Испытания на подлинностьДля идентификации компонентов в смесях применяют наиболее специфические и чувствительные реакции. Но, используя наиболее быструю и простую реакцию, не следует забывать о сопутствующих компонентах смеси, которые могут или создавать неблагоприятные условия для ее протекания, или сами вступать во взаимодействие. Типы реакций, применяемых для обнаружения препаратов в смесях, зависят от природы анализируемого вещества. Часто используют реакции осаждения, которые позволяют обнаружить большинство анализируемых ионов; комплексообразования, в результате которых получаются окрашенные продукты. Для ряда соединений характерны реакции флуоресценции, окрашивания пламени и т.д. Анализ лекарственной формы, состоящей из одного ингредиента, прост и сводится к проведению специфической реакции на данный ингредиент. Гораздо чаще в состав лекарственного средства входят несколько ингредиентов, что создает определенные трудности при их идентификации. Сложность анализа лекарственных смесей связана с тем, что один ингредиент часто мешает открытию другого по разным причинам. Так, два или несколько ингредиентов могут реагировать с одним и тем же реактивом. Например, салициловая кислота и резорцин, оба вещества с раствором железа (III) хлорида образуют сине-фиолетовое окрашивание. Иногда препарат не удается обнаружить принятой для него реакцией в связи с тем, что выделяющееся в результате реакции вещество вступает во взаимодействие с другим компонентом лекарственной смеси. Например, невозможно обнаружить бромиды в реакции с калия перманганатом в присутствии больших количеств натрия салицилата, так как выделяющийся бром вступает в реакцию бромирования. В указанных случаях часто приходится прибегать к разделению ингредиентов лекарственной смеси с помощью воды, органических растворителей (эфир, хлороформ и др.), растворов кислот, щелочей. Метод разделения лекарственной смеси трудоемкий и длительный, в связи с этим важно пользоваться реакциями, позволяющими провести идентификацию одного компонента в присутствии другого, а в некоторых случаях использовать возможность определения подлинности двух и более ингредиентов одним реактивом или одной реакцией. Прибавляемый реактив реагирует сначала с одним ингредиентом, а затем со вторым, например в лекарственной смеси состава: Кальция хлорида 0,5 Калия йодида 2,0 Калия бромида 3,0 Воды очищенной до 100,0 мл Определение галогенид-иона реакцией окисления калия перманганатом в кислой среде основано на восстановительных свойствах галогенидов. 1. Так, к 1-2 каплям лекарственной смеси в пробирке прибавляют по 0,5-1 мл кислоты серной разведенной и воды, 1-2 мл хлороформа и 1-2 капли раствора калия перманганата, при встряхивании хлороформный слой окрашивается в розово-фиолетовый цвет (йодид-ион). Продолжают прибавлять по каплям раствор калия перманганата при встряхивании пробирки до исчезновения фиолетового окрашивания хлороформного слоя вследствие окисления йода в йодат-ион и появления желто-бурого окрашивания хлороформа (бромид-ион). Для идентификации хлорид-иона водный слой сливают, обесцвечивают его прибавлением нескольких капель раствора водорода пероксида и прибавляют 1-2 капли раствора серебра нитрата, выделяется белая муть или осадок серебра хлорида. 2. Прибавляемый реактив реагирует одновременно с двумя ингредиентами: например, если в состав лекарственной смеси входят натрия салицилат и натрия бензоат, то их присутствие можно доказать путем прибавления к 1-2 мл исследуемого раствора хлороформа и 3-4 капель раствора меди (II) сульфата. При встряхивании водный слой окрашивается в зеленый цвет (салицилат-ион), хлороформный - в голубой (бензоат-ион). 3. Часто при прибавлении реактива для идентификации одного компонента открывают последовательно остальные компоненты лекарственной смеси. Например, для идентификации анестезина в порошке состава: Натрия гидрокарбоната Анальгина Анестезина по 0,2 проводят реакцию диазотирования и азосочетания. К 0,02 г порошка в фарфоровой чашечке прибавляют 3-4 капли разведенной хлороводородной кислоты, при этом наблюдается выделение пузырьков газа (гидрокарбонат-ион), затем после прибавления 3-4 капель раствора натрия нитрита появляется быстро исчезающее сине-фиолетовое окрашивание (анальгин), а от добавления щелочного раствора-нафтола смесь окрашивается в красный цвет (анестезин). 4. Использование различных видов хроматографии для разделения и идентификации компонентов лекарственной формы. Например, при анализе методом хроматографии в тонком слое используют стандартные пластинки «Силуфол», «Сорбфил», на которые нанося раствор лекарственной формы или хлороформную вытяжку из лекарственной формы (мази, аэрозоли и др.) и раствор стандартного образца вещества-свидетеля. После хроматографирования в предварительно подобранных системах растворителей на хроматограмме проявляют пятна с помощью цветных реакций или просматривают в фильтрованном УФ-свете. 7.3.2. Количественный анализКоличественное определение ингредиентов лекарственной формы состоит из нескольких этапов: расчета массы или объема лекарственной формы, необходимой для анализа, титрования компонентов смеси, расчета результатов анализа и выводов. Титриметрические (объемные) методы анализа основаны на точном измерении количества титранта, израсходованного на реакцию с определяемым веществом. Титрант добавляют небольшими порциями к раствору, содержащему точно известную массу определяемого вещества. Конечную точку титрования (КТТ) в титриметрических методах анализа определяют визуально, чаще всего по изменению окраски раствора либо выпадению осадка, вызываемого исходным соединением, продуктами реакции или индикаторами. Для определения конечной точки титрования можно также использовать физико-химические методы, фиксируя изменение измеряемого параметра -величины рН, потенциала, силы тока и т.д. Реакции, которые используют в титриметрии, должны удовлетворять следующим основным требованиям: • реакция должна протекать количественно; • реакция должна протекать с большой скоростью; • реакция не должна осложняться протеканием побочных процессов; • должен существовать способ определения точки конца титрования. Если реакция не удовлетворяет хотя бы одному из этих требований, она не может быть использована в титриметрическом анализе. 7.3.2.1.Способы выражения концентрации.Для титрования в титриметрических методах анализа используют растворы с точно известной концентрацией, которые называют титрантами или титрованными растворами. Концентрация титрованного раствора обозначается терминами «молярная», «титр» или «титр по определяемому веществу». Молярная концентрация (моль/л) - это выраженное в молях количество растворенного вещества, содержащееся в одном литре раствора. Она вычисляется как отношение количества растворенного вещества к объему раствора в литрах/Моль представляет собой количество вещества, содержащее только специфицированных структурных единиц, сколько атомов содержится в 0,012 кг (12 г) изотопа углерода 12. Молярная концентрация титрованных растворов рекомендована ИЮПАК и принята в ГФ XI. Титр (Т) - это выраженная в граммах масса растворенного вещества, содержащаяся в одном миллилитре раствора (г/мл). Титр титранта по определяемому веществу (Т титранта/опр. в-во) - это выраженная в граммах масса определяемого вещества, эквивалентная одному миллилитру данного титранта (г/мл). Титр по определяемому веществу вычисляют, исходя из молярности по формуле: 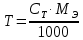 где: Cт - молярная концентрация титранта; МЭ - молярная масса эквивалента определяемого вещества. Молярной массой эквивалента вещества называют массу одного моля эквивалента этого вещества, равную произведению фактора эквивалентности (fЭ) на молярную массу определяемого вещества (М). Фактор эквивалентности –это число, обозначающее какая доля молекулы вещества эквивалента одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Например, при титровании раствора водорода пероксида титрованным раствором калия перманганата fэ(Н2О2)=1/2 Расчет массы (объема) лекарственной формы и объема титранта для анализа. Если анализируется жидкая лекарственная форма, то удобнее всего сначала рассчитать содержание определяемого вещества в 1 мл лекарственной формы и, разделив найденное количество на титр, определить, сколько миллилитров титрованного раствора будет израсходовано на титрование. Например, анализируется натрия бромид в лекарственной форме: Раствора натрия бромида 0,5% - 200,0 мл Кофеина-бензоата натрия 0,5 В 1 мл данного лекарства содержится 0,005 г натрия бромида. При титровании натрия бромида серебра нитратом молярная масса эквивалента натрия бромида равна М. м. (102,9), а титр 0,1 моль/л раствора серебра нитрата по натрия бромиду соответствует 0,01029 г. Таким образом, на титрование 1 мл данной микстуры будет израсходовано 0,005/0,01029 = 0,49 мл 0,1 моль/л раствора серебра нитрата. Далее аналитик решает, сколько он может взять на анализ лекарственной формы, и легко рассчитывает, сколько будет израсходовано титрованного раствора. Так, можно взять на титрование 1 мл микстуры и титровать 0,1 моль/л раствором серебра нитрата из полумикропипетки или 0,02 моль/л раствором серебра нитрата из пипетки. Навеску лекарственно формы на суммарное титрование компонентов смеси рассчитывают таким же образом: определяют содержание каждого компонента в 1 мл микстуры, делят на соответствующий титр и складывают полученные объемы. Например, анализируется микстура: Калия бромида 3,0 Калия йодида 2,0 Воды очищенной 100,0 мл Расчет навески на суммарное титрование: в 1 мл микстуры содержится 0,03 г калия бромида и 0,02 г калия йодида. Титр 0,1 моль/л раствора серебра нитрата по калия бромиду – 0,0119 г/мл, расход титрованного раствора 0,03/0,0119 = 2,52 мл на 1 мл микстуры; титр 0,1 моль/л раствора серебра нитрата по калия йодиду = 0,0166 г/мл, расход титрованного раствора 0,02/0,0166 = 1,21 мл. Всего на 1 мл микстуры будет израсходовано 2,52 + 1,21 = 3,73 мл титрованного раствора. 7.3.2.2.Прямое титрованиеНаиболее простым является расчет содержания вещества в однокомпонентных лекарственных формах при прямом титровании. Концентрацию ингредиентов в процентах (в жидких лекарственных формах, мазях) рассчитывают по формуле: 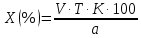 где: Х (%) - содержание определяемого вещества, в %; Т - титр титранта по определяемому веществу, в г/мл; V - объем титрованного раствора, в мл; К - поправочный коэффициент титрованного раствора; а - навеска анализируемого средства (в г или мл). Расчет содержания ингредиентов в граммах проводят, используя следующие формулы: а) для жидких лекарственных форм: 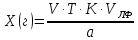 б) для твердых и мягких лекарственных форм: 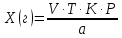 Х (г) - содержание определяемого вещества, в г; Т - титр титранта по определяемому веществу, в г/мл; V - объем титрованного раствора, в мл; К - поправочный коэффициент титрованного раствора; а - навеска анализируемого средства (г), Р - общая масса порошка, мази по прописи, в г; VЛФ - объем жидкой лекарственной формы (по прописи), в мл; Контрольный опыт при прямом титровании проводят в следующих случаях: при алкалиметрическом титровании веществ в мазях (контрольный опыт проводят с мазевой основой, обладающей собственной кислотностью); при алкалиметрическом титровании с использованием растворителей, обладающих кислотными свойствами (например, спирт, ацетон); при комплексонометрическом титровании малых количеств солей кальция, магния, цинка 0,01 моль/л раствором трилона Б; при нитритометрическом определении малых количеств лекарственных веществ 0,02 моль/л раствором натрия нитрита с использованием внутренних индикаторов. 17 При прямом титровании с проведением контрольного опыта содержание ингредиентов рассчитывают по формуле: 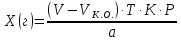 V и VK.O.- объемы титрованного раствора, пошедшего на опыт и контрольный опыт, соответственно. 7.3.2.3.Обратное титрованиеПри количественном определении методом обратного титрования используют два титрованных раствора, один из которых добавляют в избытке. Расчет содержания ингредиентов выполняют по формуле: а) в процентах: 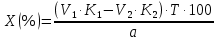 V1 и V2 - объемы титрованных растворов, в мл; К1 и К2 - соответствующие поправочные коэффициенты; б) в граммах: в жидких лекарственных формах: 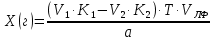 VЛФ – объем жидкой лекарственной формы по прописи, в мл; в порошках и мазях: 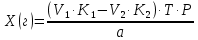 Р – общая масса порошка, мази по прописи, в г. При экспресс-анализе проведение контрольного опыта в случае обратного титрования необходимо при: йодиметрическом определении некоторых лекарственных веществ (например, глюкозы, антипирина и др.); броматометрическом определении препаратов, 18 производных фенолов; йодхлорметрическом определении (например, метилурацила). Содержание ингредиентов с учетом контрольного опыта рассчитывают по формулам: а) в процентах: 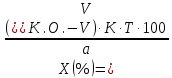 б) в граммах: 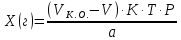 где Vк.о. – объем второго титранта, пошедшего на титрование контрольного опыта, в мл. V – объем второго титранта, пошедшего на титрование основного опыта, мл. Р – масса порошка или мази, г. Постановка контрольного опыта необходима, если в опыте отфильтровывают осадок и титруют избыток титрованного раствора в аликвотной части фильтрата. Расчеты проводят по формулам: 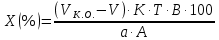 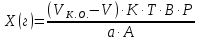 В – объем мерной колбы, мл. A – объем фильтрата, взятый на титрование, мл. Р – масса порошка или мази, г. 7.3.2.4. Заместительное титрованиеЗаместительное титрование – это титрование вещества, образующегося в результате реакции в количестве, эквивалентном определяемому компоненту. Расчеты проводят по формуле прямого титрования, рассчитывая титр не по титруемому заместителю, а по определяемому веществу. Например, при определении теобромина, его осаждают титрованным раствором серебра нитрата, образуется серебра теоброминат и выделяется эквивалентное количество кислоты азотной, которая титруется 0,1 моль/л раствором натрия гидроксида. Рассчитывают молярную массу эквивалента и титр теобромина, а не азотной кислоты. 7.3.2.5.Определение по разности.Если лекарственная смесь содержит несколько компонентов, один из которых невозможно определить индивидуально, то лекарственные вещества титруют суммарно. Ингредиенты, которые возможно определить раздельно, анализируют другими принятыми для них методами. Если при титровании различными методами молярные массы эквивалентов анализируемых веществ не меняются, то содержание данного компонента рассчитывают по формуле: 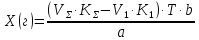 Т - титр по определяемому веществу для компонента, титруемого по сумме; VƩ - объем титрованного раствора, израсходованного на титрование суммы компонентов, в мл. V1 - объем титрованного раствора, пошедшего на титрование 1-го компонента независимым методом, в мл. КƩ, К1 - поправочные коэффициенты титрованных растворов; b - общая масса (г) или объем (мл) ЛФ; а - точная навеска (г) или объем ЛФ (мл), взятых для анализа. Такой расчет возможен только в том случае, если при титровании используют одинаковые массы (объемы) лекарственной смеси и одинаковые концентрации титрованных растворов. 7.3.2.6. Определение допустимых отклонений.Полученные данные количественного анализа компонентов лекарственных форм в граммах или процентах сравниваются с допустимыми пределами (для готовых лекарственных форм), представленными в частных фармакопейных статьях. Для лекарственных форм, изготовленных в аптеках, рассчитывают относительное отклонение полученного результата количественного определения (в %): Абсолютное отклонение отдельного результата: 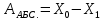 Относительное отклонение: 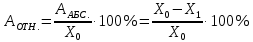 где Х1 - результат количественного определения, в г или в %; Х0 - содержание отдельного ингредиента по прописи, в г или в %. Полученные отклонения сравнивают с нормами отклонений, изложенными в приказе МЗ РФ №305 от 16 октября 1997 г. Заключение.Важнейшим фактором, определяющим качество лекарственных средств, изготовляемых в аптеках, является постановка и выполнение внутриаптечного контроля. Лекарства аптечного производства, а также внутриаптечные заготовки, фасовки, концентраты и полуфабрикаты подвергаются разным видам контроля-в зависимости от характера лекарственной формы. Независимо от источника поступления лекарственные средства подвергаются приемочному контролю. Лекарственные средства, изготовленные в аптеках по индивидуальным рецептам или требованиям лечебных учреждений, подвергаются внутриаптечному контролю: письменному, органолептическому и контролю при отпуске — обязательно; опросному и физическому — выборочно, а также химическому контролю. Провизор-аналитик обязан владеть всеми видами внутриаптечного контроля. Впервые назначенный на должность, провизор-аналитик проходит обязательную стажировку в территориальной контрольно-аналитической лаборатории. Провизор-аналитик, назначенный на должность для выполнения контроля качества гомеопатических лекарственных средств, изготовляемых в аптеке, проходит стажировку на факультетах повышения квалификации провизоров, имеющих образовательную лицензию. Для проведения химического контроля качества ЛС, которые изготавливают в аптеке, выделяется специально оборудованное рабочее место. На нем размещается типовое оборудование, приборы и реактивы. Провизор-аналитик обеспечивается нормативными документами и справочной литературой. Результаты, полученные при контроле качества лекарственных средств, регистрируются в журналах, которые хранятся в аптеке в течение года. Один раз в год отчет о работе по контролю качества ЛС, изготовленных в аптеке, направляется в территориальную контрольно-аналитическую лабораторию или центр контроля качества ЛС. Список литературы.Ермилова, Е.В. Анализ лекарственных средств аптечного и заводского производства: Учеб. пособие/ Е.В. Ермилова, Т.В. Кадырова, В.В. Дудко. - Томск: Сибирский Государственный Медицинский Университет, 2010 -202с. Арзамасцев, А.П. Анализ лекарственных смесей: Учебник/ Арзамасцев А.П., Печенников В.М., Родионова Г.М., Дорофеев В.Л., Аксенова Э.Н.-М: Компания Спутник, 2000. – 275 с. Беликов, В.Г. Фармацевтическая химия: Учебник в 2 ч. Ч. 2./ В.Г. Беликов. – Пятигорск, 1996. – 608 с. Блинникова, А.А. Рефрактометрический метод в анализе лекарственных средств, концентратов, спиртоводных растворов: Учеб. пособие/ под ред. проф. Е.А. Краснова. – Томск, 2002. – 36 с. Блинникова, А.А. Спектрофотометрия и фотоэлектроколориметрия в анализе лекарственных средств: Учеб. пособие / под ред. проф. Е.А. Краснова. – Томск: Изд. ТПУ, 2001. – 92 с. Великанова, В.И. Анализ готовых лекарственных форм и экстемпоральной рецептуры: Учебник/ В.И. Великанова, Е.А. Краснов и др. - Томск, 1980. - 114 с. Государственная фармакопея СССР. Вып. 1. Общие методы анализа / МЗ СССР. – 11-е изд. - М.: Медицина, 1987. – 336 с. Государственная фармакопея СССР. Вып. 2. Общие методы анализа. Лекарственное растительное сырье / МЗ СССР. – 11-е изд., доп. – М.: Медицина, 1989. – 400 с. Дудко В.В. Часть 1. Определение чистоты лекарственных средств химическими, физическими и физико-химическими методами. Часть 2 Титрованные растворы: Учеб. пособие / под ред. Е.А. Краснова. – Томск, 2003. – 103с. Дудко, В.В. Анализ лекарственных веществ по функциональным группам: Учеб. пособие/ В.В. Дудко, Л.А. Тихонова. – Томск, 2001. – 160 с. Ермилова, Е.В. Инфракрасная спектроскопия в анализе лекарственных средств: Учеб. пособие / под ред. проф. Е.А. Краснова. -Томск: Изд. ИОА СОРАН, 2004. – 80 с. Краснов, Е.А. Современные хроматографические методы (ГЖХ, ВЭЖХ) в фармацевтическом анализе: Учебно-методическое пособие/Краснов Е.А., А.А. Блинникова. - Томск, 2003. - 144 с. Кулешова, М.И. Анализ лекарственных форм, изготовляемых в аптеках: Учеб. пособие / М.И. Кулешова, Л.Н. Гусева, О.К.Сивицкая. - М.: Медицина,1989. - 205 с. Лабораторные работы по фармацевтической химии: Учеб. пособие / под ред. В.Г. Беликова. - М.: Высшая шк., 1989. – 375 с. Максютина Н.П. Методы анализа лекарств: Учебник / Н.П. Максютина и [др.]. - Киев: Здоровье, 1984. – 224 с. Сливкин А.И. Контроль качества экстемпоральных лекарственных форм: Учеб. пособие/ А.И. Сливкин, Н.П. Садчикова - Воронеж: Изд. Воронежского Государственного Университета.203. - 264 с. О контроле качества лекарственных средств, изготовляемых в аптеках: Приказ МЗ РФ № 214 от 16 июля 1997 г. Пономарев, В.Д. Аналитическая химия. Т. 1, 2: Учебник/ В.Д. Пономарев- М.: Высш. шк, 1982. Руководство к лабораторным занятиям по фармацевтической химии / под ред. А.П. Арзамасцева. - М.: Медицина, 1987. – 304 с. Сливкин, А.И. Физико-химические и биологические методы оценки качества лекарственных средств: Учебник/ А.И. Сливкин, В.Ф. Селеменев, Е.А. Суховерхова. - Воронеж: Изд. Воронежского ун-та,1999. -368с. |
