|
|
Получение р-элементов. Получение p-элементов Курсовая. Курсовая работа Способы получения простых веществ pэлементов
МИНОБРНАУКИ РОССИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНАЯ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «АСТРАХАНСКИЙ ГОСУДАСТВЕННЫЙ УНИВЕРСИТЕТ»
Химический факультет
Кафедра органической, неорганической и фармацевтической химии
Курсовая работа
«Способы получения простых веществ p-элементов»
Выполнял:
Студент 1 курса, группы ХМ-11
Филимонова Е.А.
Проверил:
Преподаватель
Кривенцева Л.А.
Астрахань − 202
Оглавление
Введение. 3
p-Элементы VII группы — галогены 5
Характеристика 5
Способы получения 5
p-Элементы VI группы 9
Характеристика 9
Способы получения 10
p-Элементы V группы 15
Характеристика 15
Способы получения 15
p-Элементы IV группы 20
Характеристика 20
Способы получения 21
p-Элементы III группы 24
Характеристика 24
Способы получения 24
Заключение 28
Источники информации 29
Введение.
P-элементами называются химические элементы, в атомах которых электрон с наивысшей энергией занимает p-орбиталь.
P-элементы находятся в шести группах, главной подгруппе: VII - фтор, хлор, бром, йод и астат; VI - кислород, сера, селен, теллур и полоний; V - азот, фосфор, мышьяк, сурьма, висмут; IV - углерод и кремний и подгруппу германия; III – бор, аллюминий, галлий, индий, таллий.
Все эти элементы очень важны для населения. Например, фтор, хлор, иод и бром, их производные — важнейшие народнохозяйственные продукты. Применение халькогенов очень разнообразно. Кислород — металлургия, серу используют в борьбе против вредителей, селен в производстве полупроводников, теллур добавляют с свинцу для меньшей коррозии. Элементы VА группы широко используются человеком. Азот и фосфор в производстве удобрений, мышьяк, сурьма и висмут используются как добавки к свинцовым сплавам, увеличивающие их твердость. По значимости тех элементов, которые входят в IV группу, с ней не может сравниться никакая другая группа системы. Углерод является основой органической химии, а кремний, в свою очередь, основой неорганической химии. Германий, олово и свинец используют в производстве. Элементы III А группы компоненты многих современных материалов, крайне необходимых народному хозяйству и оборонной технике. Бор — компонент жаропрочных и коррозионностойких сплавов, боропластиков, полупроводниковых материалов. Алюминий — основа легких сплавов. Галлий и его эвтектический сплав с индием используется как теплоноситель в контурах реакторов. Таллий применяют при изготовлении подшипников, легкоплавких и кислотоустойчивых сплавов.
Элементы данных групп имеют большое значение в жизни людей, поэтому глубокое изучение этой темы достаточно актуально.
Целью данной работы являлся сбор литературных данных о свойствах элементов и способах их получения. Изучить наиболее распространённые способы получения.
p-Элементы VII группы — галогены Характеристика
К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астат At. Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns2np5.
На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств. Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1. Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F - Cl - Br - I - At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
Способы получения
Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия: В расплаве хлорид натрия диссоциирует на ионы:
На катоде восстанавливаются ионы натрия:
K(–):
На аноде окисляются ионы хлора:
A(+):
Ионное уравнение электролиза расплава хлорида натрия:
Суммарное уравнение электролиза расплава хлорида натрия:
Электролиз раствора хлорида натрия: В растворе хлорид натрия диссоциирует на ионы:
На катоде восстанавливаются молекулы воды:
K(–):
На аноде окисляются ионы хлора:
A(+):
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями. Например, взаимодействием соляной кислоты с оксидом марганца (IV):
Или перманганатом калия:
Бертолетова соль также окисляет соляную кислоту:
Бихромат калия окисляет соляную кислоту:
Получение фтора.
Фтор в промышленности получают электролизом расплава гидрофторида калия.
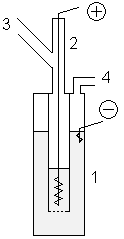 В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина. В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе и при:
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300, разложение фторидов серебра и некоторые другие способы.
Получение брома.
Бром в лаборатории можно получить окислением ионов сильными окислителями. Например, бромоводород окисляется хлором:
Соединения марганца также окисляют бромид-ионы. Например, оксид марганца (IV):
Получение йода.
Йод в лаборатории получают окислением ионов сильными окислителями. Например, хлор окисляет йодид калия:
Соединения марганца также окисляют йодид-ионы. Например, оксид марганца (IV) в кислой среде окисляет йодид калия:
Получение астата.
Астат получают только искусственно. В основном изотопы астата получают облучением металлических висмута или тория α-частицами высокой энергии с последующим отделением астата соосаждением, экстракцией, хроматографией или дистилляцией.
p-Элементы VI группы Характеристика
К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns2np4.
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали. Например, в кислых водных растворах существуют ионы гидроксонию , в которых атом кислорода соединен с тремя атомами водорода ковалентными связями. В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns2np6. Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O - S - Se - Te - Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности. Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических. Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
Способы получения
Получение кислорода
Кислород распространён в природе в виде изотопов 16О, 17О, 18О, которые имеют следующее процентное содержание на Земле – 99,76%, 0,048%, 0,192% соответственно.
В свободном состоянии кислород находится в виде двух аллотропных модификаций: дикислорода – и озона – . Атомарный кислород может быть получен следующим образом:
Кислород входит в состав более 1400 различных минералов и органических веществ, в атмосфере его содержание составляет 21% по объёму. А в человеческом теле содержится до 65% кислорода. Кислород газ без цвета и запаха, мало растворим в воде (в 100 объёмах воды при 20 растворяется 3 объёма кислорода).
В лаборатории кислород получают умеренным нагреванием некоторых веществ: При разложении соединений марганца (+7) и (+4):
При разложении перхлоратов:
При разложении бертолетовой соли:
При разложении на свету солей хлорноватистой кислоты:
При нагревании нитратов:
При разложении пероксидов:
При нагревании оксидов неактивных металлов:
Данный процесс имеет актуальное значение в быту. Дело в том, что посуда, изготовленная из меди или серебра, имея естественный слой оксидной плёнки, при нагревании образует активный кислород, что является антибактериальным эффектом. Растворение солей неактивных металлов, особенно нитратов, также приводит к образованию кислорода. Например, суммарный процесс растворения нитрата серебра можно представить по этапам:
или в суммарном виде:
При нагревании солей хрома высшей степени окисления:
В промышленности кислород получают:
Электролитическим разложением воды:
Взаимодействием углекислого газа с пероксидами:
Данный способ представляет собой незаменимое техническое решение проблемы дыхания в изолированных системах: подводных лодках, шахтах, космических аппаратах.
При взаимодействии озона с восстановителями:
Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс, который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
Накопившиеся протоны способствуют синтезу АТФ:
В темновую фазу происходит преобразование углекислого газа и воды в глюкозу. И побочно выделяется кислород:
Получение серы
Промышленным способом получения серы является очищение самородной серы от примесей расплавлением перегретым водяным паром;
Окислением сероводорода кислородом:
Восстановлением оксида серы (IV) углеродом:
Разложением пирита :
Разложением сероводорода:
Получение селена
Содержание селена в земной коре около 500 мг/т. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены FeSe, PbSe, HgSe, , , . Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4*10-4мг/л.
Селен получают из отходов сернокислотного, целлюлозно-бумажного производства , а также значительные количества получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения селена из шлама: окислительный обжиг с возгонкой ; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементарного селена действием .
Получение теллура
Основной источник — шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ .
Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура , а остается в растворе. Из оксида теллур восстанавливают углём.
Для очистки теллура от серы и селена используют его способность под действием восстановителя (Al, Zn) в щелочной среде переходить в растворимый дителлурид динатрия :
Для осаждения теллура через раствор пропускают воздух или кислород:
Для получения теллура особой чистоты его хлорируют
Образующийся тетрахлорид очищают дистилляцией или ректификацией. Затем тетрахлорид гидролизуют водой:
А образовавшийся восстанавливают водородом:
p-Элементы V группы Характеристика
К p-элементов V группы относятся азот N, фосфор P, мышьяк As, сурьма Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns2np3.
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи. В то же время в связывании могут принимать участие двухэлектронная орбиталь, а в случае элементов, размещенных после азота, - также свободные nd-орбитали. Так, азот способен образовывать четвертая ковалентная связь по донорно-акцепторным механизмом с использованием своей неподеленной пары электронов. Примером может служить ион аммония и его многочисленные производные. Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N - P - As - Sb - Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
Способы получения
Получение азота
Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
Суммарное уравнение процесса:
Азот также образуется при горении аммиака:
Наиболее чистый азот получают разложением азидов щелочных металлов.
Например, разложением азида натрия:
Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре 700 :
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Получение фосфора
Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
Красный и черный фосфор получают из белого фосфора.
Получение мышьяка
Открытие способа получения металлического мышьяка (серого мышьяка) приписывают средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» (триоксид мышьяка) с различными органическими веществами.
Существует множество способов получения мышьяка: сублимацией природного мышьяка, способом термического разложения мышьякового колчедана, восстановлением мышьяковистого ангидрида и др.
В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твёрдый мышьяк в железных трубках, идущих от печей, и в особых керамических приёмниках. Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк окисляется в . Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьякосодержащих руд перерабатывается в белый мышьяк, то есть в триоксид мышьяка — мышьяковистый ангидрид .
Основной способ получения — обжиг сульфидных руд с последующим восстановлением оксида углём (углеродом):
Получение сурьмы
Получают сурьму в виде нестабильного газа действием атомарного водорода на соединения сурьмы или при действии кислот на антимониды магния, цинка.
Получается при воздействии на гидроксид сурьмы III атомарным водородом:
Так же существует возможность реакции антимонида магния с избытком разбавленной соляной кислоты. Получается стибин и хлорид магния:
Кроме того, содержащие соединения реагируют с протонными реагентами (даже с водой):
Оба метода получения имеют недостаток, заключающейся в том, что в результате реакций газообразный стибин получается в смеси с водородом. При охлаждении газа до уровня ниже −17 этот недостаток может быть устранён, потому что стибин конденсируется при такой температуре.
Методом, который позволяет избежать такого недостатка, является последовательная реакция катиона с веществами, содержащими формальный анион с образованием и.
Или, как правило, получают гидрированием хлорида сурьмы III с использованием борогидрида натрия в эфирных растворителях:
Также в водной среде:
Получение висмута
Висмут получают сплавлением сульфида с железом:
Последовательным проведением процессов:
p-Элементы IV группы Характеристика
К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns2np2. Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.
Характер изменения физических свойств элементов и соответствующих простых веществ свидетельствует о закономерное ослабление неметаллических и усиление металлических свойств в ряду C - Si - Ge - Pb.
Углерод и кремний - типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения. Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи. В то же время в германию уже обнаружено некоторое взнос металлической связи. На это указывает заметное уменьшение ширины запрещенной зоны и росту электропроводности. Для олова полупроводниковые свойства сохраняются лишь до температуры 13,2°С, при дальнейшем нагревании олово переходит в металлический состояние. Свинец - металл, который не проявляет полупроводниковых свойств. Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
Способы получения
Получение углерода
Неполное сжигание метана: (сажа);
Сухая перегонка древесины, каменного угля
Получение кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
Восстановление из оксида коксом в электрических печах:
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200:
или цинком:
Также чистый кремний получается при разложении силана:
Получение германия
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида ,который восстанавливают водородом при 600 до простого вещества:
Получение олова
Основным способом получения олова является восстановление металла из руды, содержащей оксид олова(IV) с помощью угля, алюминия или цинка.
Особо чистое олово получают электрохимическим рафинированием или методом зонной плавки.
Получение свинца
Основной источник получения свинца — сульфидные полиметаллические руды, минерал галенит PbS. На первом этапе руду обогащают. Полученный концентрат подвергают окислительному обжигу:
При обжиге добавляют флюсы. Они образуют жидкую фазу, цементирующую шихту. Полученный агломерат содержит 35—45 % Pb. Далее содержащиеся в агломерате свинец (II) и оксид меди восстанавливают коксом:
Черновой свинец получают взаимодействием исходной сульфидной руды с кислородом (автогенный способ). Процесс протекает в два этапа:
Для последующей очистки чернового свинца от примеси Cu, Sb, Sn, Al, Bi, Au и Ag его очищают пирометаллургическим методом или электролизом.
p-Элементы III группы Характеристика
К p-элементов III группе относятся бор B,алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные - металлы. В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам. Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе - металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.
Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns2np1. В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор - достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
Способы получения
Получение бора
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
Метод металлотермии (чаще восстановление магнием или натрием):
Термическое разложение паров бромида бора на раскалённой (1000—1200) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
Получение алюминия
Алюминий образует прочную химическую связь с кислородом. По сравнению с другими металлами, восстановление алюминия до металла из природных оксидов и алюмосиликатов более сложно в связи с его высокой реакционной способностью и с высокой температурой плавления всех его руд, например таких, как бокситы, корунды.
Обычное восстановление до металла обжигом оксида с углеродом (как например, в металлургических процессах восстановления железа) — невозможно, так как сродство к кислороду у алюминия выше, чем у углерода.
Возможно получение алюминия посредством неполного восстановления алюминия с образованием промежуточного продукта — карбида алюминия , который далее подвергается разложению при 1900—2000 с образованием металлического алюминия. Этот способ производства алюминия изучается, предполагается, что он более выгоден, чем классический электролитический способ производства алюминия процесс Холла — Эру, так как требует меньших энергозатрат и приводит к образованию меньшего количества .
Современный метод получения, процесс Холла — Эру, был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии и поэтому получил промышленное применение только в XX веке.
Электролиз в расплаве криолита:
Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году восстановлением металлическим калием безводного хлорида алюминия (реакция протекает при нагревании без доступа воздуха):
Получение галлия
Для получения металлического галлия чаще используют редкий минерал галлит (смешанный сульфид меди и галлия). Его следы постоянно встречаются со сфалеритом, халькопиритом и германитом. Значительно бо́льшие его количества (до 1,5 %) были обнаружены в золе некоторых каменных углей. Однако основным источником получения галлия служат растворы глинозёмного производства при переработке боксита (обычно содержащие незначительные его примеси (до 0,1 %)) и нефелина. Галлий также можно получить с помощью переработки полиметаллических руд, угля. Извлекается он электролизом щёлочных жидкостей, являющихся промежуточным продуктом переработки природных бокситов на технический глинозём. Концентрация галлия в щелочном алюминатном растворе после разложения в процессе Байера: 100—150 мг/л, по способу спекания: 50—65 мг/л. По этим способам галлий отделяют от большей части алюминия карбонизацией, концентрируя в последней фракции осадка. Затем обогащённый осадок обрабатывают известью, галлий переходит в раствор, откуда черновой металл выделяется электролизом. Загрязнённый галлий промывают водой, после этого фильтруют через пористые пластины и нагревают в вакууме для того, чтобы удалить летучие примеси. Для получения галлия высокой чистоты используют химический (реакции между солями), электрохимический (электролиз растворов) и физический (разложение) методы. В очень чистом виде (99,999 %) он был получен путём электролитического рафинирования, а также восстановлением водородом тщательно очищенного GaCl3.
Получение индия
В качестве исходного продукта для получения индия в первую очередь используются полупродукты от выплавки свинца и цинка из руд, содержащих индий. Цинк с относительно высоким содержанием индия обрабатывают соляной кислотой в количестве, недостаточном для полного растворения цинка. Индий при этом остается в шламе, из раствора этого шлама большая часть имеющихся тяжелых металлов осаждается сероводородом. Из фильтрата после прибавления аммиака индий выделяется в виде гидроксида, обычно вместе с железом. Способ отделения железа от индия зависит от содержания последнего.
Получение металлического индия из оксида нагреванием в токе водорода или электролизом кислых растворов не представляет особых трудностей из-за легкой восстанавливаемости соединений индия.
Получение таллия
Технически чистый таллий очищают от других элементов, содержащихся в колошниковой пыли (Ni, Zn, Cd, In, Ge, Pb, As, Se, Te), растворением в тёплой разбавленной кислоте с последующим осаждением нерастворимого сульфата свинца и добавлением HCl для осаждения хлорида таллия (TlCl). Дальнейшая очистка достигается электролизом сульфата таллия в разбавленной серной кислоте с использованием проволоки из платины с последующим плавлением выделившегося таллия в атмосфере водорода при 350—400.
Заключение
Результаты изучения теоретического материала показали, что к p-элементов периодической системы относятся элементы с валентным p-подуровнем. Эти элементы расположены в III, IV, V, VI, VII, VIII группах, главных подгруппах периодической системы Д.И.Менделеева. В периоде орбитальные радиусы атомов с увеличением атомного номера уменьшаются, а энергия ионизации в целом растет. В подгруппах элементов с увеличением номера элемента, размеры атомов в общем увеличиваются, а энергия ионизации уменьшается.
Способы получения данных веществ можно разделить на два типа: промышленное производство и лабораторное. В первом случае чаще всего прибегают к электролизу, во втором к нагреванию и восстановлению, следом идут такие способы получения, как разложение и окисление. Реже всего используют для получения такие способы, как водяная баня, сублимация, насыщение растворов, сплавление и др.
Источники информации
https://dic.academic.ru/dic.nsf/ruwiki/608085
https://chemiday.com/encyclopedia/p_elementy
https://chemege.ru/halogens/#kach
https://prosto-o-slognom.ru/chimia/503_sera_S.html
http://edu.glavsprav.ru/info/at/
https://melscience.com/RU-ru/articles/olovo-stepeni-okisleniya-i-reakcii-s-BB%D1%83%%BB%D1%83%%..BB%D1%83%
Ахметов Н.С. О химии и неорганическая химия Учебник для вузов. - : Высш. шк., 2001.
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 1997
Дроздов Д.А, Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. В 3-х томах. Т.2. Химия непереходных элементов. / Под ред. Ю.Д. Третьякова - М.: Изд. «Академия», 2008
|
|
|
 Скачать 51.85 Kb.
Скачать 51.85 Kb.