Теоретическое обоснование. Курсовая работа термодинамические и кинетические особенности пиролиза углеводородов
 Скачать 151.29 Kb. Скачать 151.29 Kb.
|
|
Зависимость скорости реакции от температуры. известно эмпирическое правило вант-гоффа, которое заключается в том, что при нагревании на 10 ос скорость большинства химических реакций увеличивается в 2–4 раза. чувствительность скорости к температуре определяется только лишь зависимостью константы скорости от температуры. известно уравнение аррениуса k kexp E, (2.20) o RT оно содержит два параметра, характеризующих химическую реакцию: ko — предэкспоненциальный множитель, который не зависит от температуры, а определяется только механизмом реак- ции; E—энергия активации. Энергия активации — это некоторая пороговая энергия, харак- теризующая высоту энергетического барьера на пути реакции. Энергия активации для большинства реакций также не зависит от температуры. ее можно определить, измерив константу скорости при двух температурах. из уравнения аррениуса следует E RT1T2 ln k2 . aT T k 2 1 1 более точно энергию активации определяют по значениям кон- станты скорости при нескольких температурах, т. е. графически. для этого уравнение (2.20) записывают в логарифмической форме: ln k ln ko EaRT 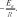 и представляют экспериментальную зависимость логарифма кон- станты скорости от обратной температуры в линеаризованной форме. в этом случае угловой коэффициент прямой на рис. 2.4 и представляют экспериментальную зависимость логарифма кон- станты скорости от обратной температуры в линеаризованной форме. в этом случае угловой коэффициент прямой на рис. 2.4будет равен 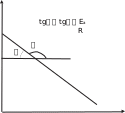 ln k ln k1/ T рис. 2.4 различают истинную и кажущуюся (эффективную или наблю- даемую) энергии активации. если определенная эксперимен- тально величина k является константой скорости одностадийной реакции, то найденная по уравнению аррениуса величина Ea— истинная. если же протекает многостадийная реакция из комбина- ции нескольких зависящих от температуры параметров, то аррени- усовскую энергию активации называют кажущейся (эффективной, наблюдаемой). типовое задание к курсовой работе в идеальной газовой системе возможно протекание несколь- ких реакций, характеризующих процесс пиролиза углеводородов. во всех вариантах приведены по четыре различные реакции. указаны условия проведения эксперимента:
определите наиболее вероятную из приведенных реакций в указанном диапазоне температур. полагая, что все остальные реакции подавлены и в системе протекает только одна, наиболее вероятная реакция, рассчитайте степень термической диссоциации углеводорода (пропана, бутана, гексана) при разных температурах (и давлении 1 атм), а также при разных давлениях (и средней из приведенного диапазона темпера- туре) и постройте графически зависимость степени термической диссоциации пропана (бутана) от температуры и давления. про- анализируйте полученные данные. как будет изменяться степень термической диссоциации углеводорода, если в систему изна- чально будет введен посторонний газ? в табл. 2 прил. 6 приведены данные кинетического экспери- мента, а именно изменяющаяся во времени концентрация углево- дорода в системе (моль/м3) при различных температурах проведе- ния опыта. определите по этой таблице все параметры уравнения формальной кинетики. |
