Теоретическое обоснование. Курсовая работа термодинамические и кинетические особенности пиролиза углеводородов
 Скачать 151.29 Kb. Скачать 151.29 Kb.
|
|
химическАЯ киНетикА курсовая работа «термодинамические и кинетические особенности пиролиза углеводородов» курсовая работа посвящена пиролизу углеводородов. она выполняется студентами после детального изучения раздела «химическая кинетика» рабочей программы по курсам «Физи- ческая химия», «дополнительные главы физической химии». особенностью рассматриваемой курсовой работы является то, что в ней частично используется учебный материал, пройденный в предыдущем семестре, — термодинамический расчет экстенсив- ных свойств системы с протекающей в ней газовой реакцией для определения наиболее вероятной реакции. во второй половине курсовой работы данные термодинамического расчета дополня- ются анализом предоставленных студенту данных кинетического эксперимента. в рамках курсовой работы будут рассмотрены термодинами- ческий и кинетический аспекты процесса пиролиза. цели данной курсовой работы: термодинамическое определение наиболее вероятной реакции, протекающей в газовой системе из четырех предложенных; изучение влияния различных факторов на состав равновес- ной смеси; изучение формальной кинетики процесса. в результате проведения курсовой работы будет термодина- мически обоснован выбор наиболее вероятной реакции, протека- ющей в определенном интервале температур в газовой системе, содержащей бутан; рассмотрено влияние температуры, давления и введения в систему постороннего газа на степень термической диссоциации реагента. на основе анализа кинетических кривых модельных опытов получено кинетическое уравнение; будут найдены порядки реак- ции по реагенту, эффективная константа скорости, величина энер- гии активации и предэкспоненциального множителя. выбор наиболее вероятной реакции и анализ влияния различных факторовна равновесный состав системы в курсовой работе рассматривается газовая система, в которой теоретически возможно протекание четырех реакций. необходимо определить, какая именно реакция будет наиболее вероятна в ука- занном температурном интервале. следует отметить, что опреде- ление возможности протекания реакции в выбранном направле- нии при заданных начальных условиях проводят по уравнению изотермы вант-гоффа, которое для идеальной газовой смеси имеет вид k G p k A R–Tln–Kp RTln k , (2.1) r p,T rgx r [p]  циальное мольное изменение энергии гиббса реакции r; — стандартное мольное изменение энергии гиббса реакции r; — константа равновесия реакции в р-шкале; — парциальное давление компонента k и размерность давления; — стехиоме- трическое число компонента kв данной реакции. циальное мольное изменение энергии гиббса реакции r; — стандартное мольное изменение энергии гиббса реакции r; — константа равновесия реакции в р-шкале; — парциальное давление компонента k и размерность давления; — стехиоме- трическое число компонента kв данной реакции.в уравнениях термодинамики принято учитывать стехиоме- трические числа, которые для продуктов реакции равны стехи- ометрическому коэффициенту с положительным знаком, а для исходных веществ — стехиометрическому коэффициенту с отри- цательным знаком. как видно из уравнения (2.1), величина химического сродства в одной и той же реакции при одной и той же температуре может быть различной и зависит от исходных парциальных давлений или концентраций веществ. для того чтобы иметь возможность срав- нивать химическое сродство различных веществ, было введено понятие стандартного химического сродства. стандартным химическим сродством считается сродство химической реакции, когда исходные парциальные давления или концентрации всех веществ, принимающих участие в реакции, равны единице. сравнивая стандартное химическое сродство раз- личных реакций, мы получаем характеристику их удаленности от состояния равновесия при парциальных давлениях каждого из участников реакции, равных единице. уравнение изотермы химической реакции очень важно, так как по нему можно судить о направлении реакции: будет ли реак- ция в равновесии, пойдет ли она в прямом или в обратном напи- санному уравнению направлении. самопроизвольный процесс сопровождается при постоянстве давления и температуры уменьшением свободной энергии гиббса. следовательно, для того чтобы реакция имела место, величина дифференциального мольного изменения энергии гиббса за счет протекания реакции должна быть отрицательной. 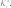 из уравнения изотермы следует, что знак дифференциального мольного изменения энергии гиббса за счет протекания реакции зависит от соотношения между величинами из уравнения изотермы следует, что знак дифференциального мольного изменения энергии гиббса за счет протекания реакции зависит от соотношения между величинами  если а если а модинамически. для того чтобы она протекала, необходимо изме- нить условия: если не изменять температуру, то можно изменить парци- альные давления веществ (или концентрацию) таким образом, чтобы величина если не изменять парциальные давления, то можно изменить температуры таким образом, чтобы увеличить константу равновесия данной реакции на величину, которая бы позволила быть справедливым неравенству уравнение изотермы позволяет определить направление реакций. если сродство реакции положительно (а следовательно, дифференциальное мольное изменение функции гиббса отрица- тельно), то реакция может идти слева направо. чем больше вели- чина химического сродства реакции r, тем более вероятна эта реакция. следовательно, проведя расчеты и определив значение диф- ференциального мольного изменения энергии гиббса разных реакций при определенной температуре, можно сделать вывод: та реакция, у которой величина дифференциального мольного изме- нения энергии гиббса наиболее отрицательна, при выбранной температуре термодинамически будет самой вероятной. иногда оценку вероятности протекания реакции осуществляют только по величине стандартного мольного изменения энергии гиббса за счет протекания реакции. используя эту величину, можно при- ближенно оценить возможность протекания той или иной реакции в прямом направлении. если располагать данными о количествах вещества в какой- либо момент времени, т. е. иметь возможность рассчитать так называемое произведение реакции или второе слагаемое справа в уравнении изотермы вант-гоффа, то вывод о вероятном направ- лении реакции будет более точным. не имея данных для расчета изменения энергии гиббса по уравнению изотермы вант-гоффа теоретически, можно лишь при- ближенно оценить вероятность реакции по величине стандартной мольной энергии гиббса. именно такую приближенную оценку необходимо будет провести при выполнении курсовой работы. как следует из уравнения (2.1), для определения вероятности протекания реакции необходимо рассчитать величину константы равновесия этой реакции при заданных температурах. Этот мате- риал подробно рассмотрен во многих учебниках, в данном посо- бии он будет приведен кратко. константа химического равновесия — это величина gст Kr exp r. (2.2) RT константа равновесия химической реакции является без- размерной величиной. современная запись закона химического равновесия: вравновеснойсистемепроизведениеактивностейкомпонентов — участников реакции в степенях, равных их сте-хиометрическим числам в данной реакции, есть величина посто-янная,зависящаятолькооттемпературыидавленияинезавися-щаяотначальныхконцентрацийкомпонентов. константа равновесия связывает парциальные давления всех веществ, участвующих в реакции; нельзя изменить парциальное давление одного из них, чтобы это не повлекло за собой соот- ветствующего изменения парциальных давлений всех остальных веществ, участвующих в реакции, которое приводит к прежнему численному значению константы равновесия. стандартное мольное изменение энергии гиббса реакции можно найти по формуле r k k,обр gст gст , k где найти стандартную мольную энергию гиббса реакции при 298 K можно по формуле r (298) k k,обр,298 gст gст . к для расчета gcт hст T sст . r (T) r (T) r (T) 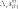 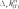 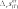 при этом значения и должны быть известны. имеются и другие способы расчета . при этом значения и должны быть известны. имеются и другие способы расчета . gст go o r k k ksk(T). T pk T pk интегрирование уравнения приводит к следующему выраже- нию: r (T) r (298) T r (298) T cст (T) kr r p T gcт gст sст 298 k 298 dTdT. после интегрирования и преобразования полученного выра- жения путем объединения числовых слагаемых, включающих тем- пературу в определенной степени в коэффициенты, получим более простое выражение r r 298 gст (T) hст T sст T aM bM cM cM ], r 298 r r r r 2 o 1 2 где lnT 298 1 Mo ; 298 T T 298 2982 M; 2 2T 1 T2 2982 2983 M; 6 2 3T 2 1 1 2 1 M2 . 2T 2298 298T коэффициенты для проведения курсовой работы разработаны программы, которые позволяют быстро рассчитать величину стандартной мольной энергии гиббса реакции и величину константы равнове- сия при различных температурах. необходимые для расчета спра- вочные материалы приведены в прил. 3. найденное значение величин стандартных мольных энергий гиббса позволит определить, какая из четырех предложенных реакций наиболее вероятна. рассмотрим подробнее, от каких факторов и каким образом зависят величина константы равновесия и величина равновесного выхода продукта. запишем определительное выражение для константы химиче- ского равновесия в логарифмическом виде: r ln Kp gст r . RT чтобы получить уравнение зависимости логарифма кон- станты равновесия от температуры, удобно использовать уравне- ние гиббса — гельмгольца: G T H T T2 . p в этом уравнении связаны между собой изменения энергии гиббса в результате какого-либо процесса и изменение энтальпии в результате этого процесса. запишем данное уравнение в симво- лах мольных величин, рассматривая в качестве процесса химиче- скую реакцию gст r hст T r. (2.3) 2 T p T разделив каждую из частей уравнения (2.3) на −Rи учтя определительное выражение для константы равновесия, получим ln Kp r hст r . (2.4) T p RT2 дифференциальное уравнение (2.4) исторически называют уравнением изобары вант-гоффа или просто уравнением изобары химической реакции. проанализируем это уравнение: если стандартная мольная теплота реакции (или стандарт- ное мольное изменение энтальпии в ходе протекания реакции) не равна нулю, то можно утверждать, что константа химического равновесия будет зависеть от температуры. причем она может как увеличиваться с ростом температуры, так и уменьшаться. если стандартная мольная теплота реакции равна нулю, то константа химического равновесия данной реакции не зависит от температуры. r при интегрировании уравнения (2.4) обычно делают допуще- ние о том, что в небольших обычно исследуемых диапазонах тем- ператур изменение стандартной мольной энтальпии реакции будет несущественным, т. е. можно принять, что Δ hст = const. интегрирование приводит к уравнению вида r dln Kp p hст dT r . R T2 hст 1 ln Kr r const. R T (2.5) из анализа уравнения (2.5) видно, что зависимость натураль- ного логарифма константы равновесия от обратной температуры будет линейной, и в этом случае по угловому коэффициенту этой прямой линии можно определить величину стандартной мольной энтальпии реакции. величины констант равновесия для газовых реакций, записан- ные через мольные доли, а также константы равновесия для жид- ких растворов (через любые концентрационные шкалы) зависят от давления. воспользуемся логарифмическим видом определительного выражения для константы равновесия r ln KN go r . RT возьмем частную производную по давлению от этого выраже- ния при постоянной температуре: ln KN r 1 go r vo r. (2.6) p T RT p T RT 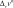  уравнение (2.6) представляет собой зависимость константы равновесия реакции от давления. если то давление не влияет на константу равновесия. если т. е. объем увели- чивается за счет реакции, то из (2.6) следует, что с увеличением давления константа уменьшается. если т. е. объем умень- шается за счет реакции, то с увеличением давления константа увеличивается. уравнение (2.6) представляет собой зависимость константы равновесия реакции от давления. если то давление не влияет на константу равновесия. если т. е. объем увели- чивается за счет реакции, то из (2.6) следует, что с увеличением давления константа уменьшается. если т. е. объем умень- шается за счет реакции, то с увеличением давления константа увеличивается.знание константы равновесия реакции позволяет рассчитать состав равновесной смеси, т. е. определить максимально возмож- ный, или теоретический, выход желаемого продукта. для этого необходимо решить уравнение закона действия масс (или закона химического равновесия). в предположении идеального поведе- ния газов этот закон запишется pkr Kp k , (2.7) k r [ p] где под знаком произведения расположены величины, относящи- еся к состоянию равновесия; причем давление выражено как отно- шение парциального давления к единице размерности давления — в виде безразмерной величины. парциальное давление каждого участника реакции по закону дальтона n p pN p nk . k k k k если теперь выразить числа молей всех компонентов через начальные количества и глубину реакции, то при известном общем давлении в системе и известной величине константы равновесия получится одно уравнение с одной неизвестной величиной — глу- биной реакции. pkr n vkr Kp k,о kr . (2.8) r [ p] k nk,о kr Можно также получить уравнения, связывающие величину константы равновесия реакции в другой переменной степенью термической диссоциации. термическая диссоциация — это распад исходного вещества под действием температуры. рассмотрим, например, реакцию A ⇄ 2B + C. степень термической диссоциации — это отношение числа продиссоциировавших молекул исходного вещества к начальному числу молекул этого вещества Число продиссоциировавших молекул исходного вещества nA . Начальное число молекул исходного вещества nA,o no отсюда легко найти связь между глубиной химической реак- ции и степенью термической диссоциации: nо, где n0 относится к исходному веществу, которое в реакции терми- ческой диссоциации обычно записано с единичным стехиометри- ческим коэффициентом. для любого реактанта в балансовом соотношении справедливо nk nk,o kr nk,o kno. для исходного вещества в реакции термической диссоциации n no r no (1 ). запишем данные для расчета равновесного состава:
о о о о 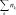 = n(1 − ) + 2n n n(1 − 2) = n(1 − ) + 2n n n(1 − 2)  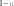    следует обратить внимание на то, что при правильной записи балансовых соотношений введенное нами число молей исходного вещества n0 должно сократиться. закон химического равновесия имеет вид следует обратить внимание на то, что при правильной записи балансовых соотношений введенное нами число молей исходного вещества n0 должно сократиться. закон химического равновесия имеет вид2 p2 p p N2 N Kp B C B C . A p p2 p NA уравнение для расчета состава равновесной газовой смеси при протекании в ней реакции A ⇄ 2B + C p2 43 Kp . (2.9) r p 1 1 22 степень термической диссоциации можно определить графи- чески по рассчитанной зависимости f () и известному значению константы равновесия или аналитически, если выражение закона химического равновесия не содержит высоких степеней при сте- пени термической диссоциации. рассмотрим влияние температуры на выход продукта реакции, анализируя уравнение изобары ln Kp r hст r . (2.10) T p RT2 повышение температуры ведет к увеличению выхода про- дукта эндотермической реакции (принцип смещения равновесия ле-Шателье). причем чем больше стандартная мольная энтальпия реакции, тем интенсивнее увеличивается выход данного продукта. при введении в систему индифферентного по отношению к рассматриваемой реакции газа изменятся общее число молей газообразных веществ и, следовательно, мольные доли всех ком- понентов — участников реакции. k n nk nиг . (2.11) при этом величина константы равновесия останется неизменной. k k n kn k r KN Nk k k r k . r (2.12) nk k nk k  если индифферентный газ на влияет на выход продукта. если индифферентный газ на влияет на выход продукта. если введение индифферентного газа увеличивает выход продукта. если введение индифферентного газа увеличивает выход продукта. если выход продукта уменьшается при введении индифферентного газа. если выход продукта уменьшается при введении индифферентного газа.для определения влияния давления на выход продукта нужно проанализировать уравнение ln KN r 1 vст. (2.13) p T RT 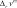 если > 0, то с ростом давления равновесный состав системы смещается в сторону уменьшения мольных долей про- дуктов реакции и увеличения мольных долей исходных веществ. если > 0, то с ростом давления равновесный состав системы смещается в сторону уменьшения мольных долей про- дуктов реакции и увеличения мольных долей исходных веществ. если < 0, то увеличение давления приводит к увеличе- нию выхода продукта. если < 0, то увеличение давления приводит к увеличе- нию выхода продукта. |
