Лабораторная работа 1 Водород Опыт Образование воды при горении водорода
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
|
Лабораторная работа №1 «Водород» Опыт 5. «Образование воды при горении водорода» Цель эксперимента: демонстрация химических свойств водорода. Задачи эксперимента: рассмотрение химической реакции образования воды при горении водорода, демонстрация техники безопасности работы с пламенем и горючим газом, развитие наблюдательности. Темы школьного курса химии: неметаллы (водород и его соединения), окислительно-восстановительные реакции. Вид эксперимента – демонстрационный. Кем выполняется - учителем, так как работа с пламенем и горючим газом. Перечень вопросов для беседы с учащимися: - почему водород собирают в перевернутый вверх дном сосуд? - какие признаки химической реакции вы наблюдаете? - окислительные или восстановительные свойства проявляет водород в реакции своего горения? Реактивы и оборудование: Источник водорода (аппарат Киппа), пробирка, штатив, спиртовка, лучинка. Методика выполнения эксперимента: Из аппарата Киппа получаем в пробирку водород. Держа её вверх дном, подносим к отверстию пробирки зажженную лучинку (проверяем водород на чистоту). Затем держим пробирку наклонно над горящей спиртовкой, поджигаем не сильную струю водорода. На стенках пробирки конденсируются капли воды. Уравнение реакции: О2 + 2Н2 = 2Н2О Техника безопасности: осторожно обращаться с химическим оборудованием, перед началом опыта проверить водород на чистоту, во время поджога пробирку держать дальше от лица. Вывод : Применение данного эксперимента в образовательном процессе позволило наглядно продемонстрировать учащимся химические свойства водорода, как «воду рождающего», что отразилось в его названии (hydrogenium). Отработали технику безопасности при работе с пламенем и горючим газом, а также развили наблюдательность у учащихся. Опыт 6. «Восстановление оксида меди (II)» Цель эксперимента: демонстрация учащимся восстановительных свойств водорода. Задачи эксперимента: продемонстрировать эксперимент по восстановлению меди из оксида меди (II), демонстрация техники работы со штативами и их лапками, отработка навыков написания химической реакции, повышение интереса у учащихся благодаря наглядности и быстроты протекания реакции. Темы школьного курса химии: классы неорганических соединений (оксиды), неметаллы (водород и его соединения), окислительно-восстановительные реакции. Вид эксперимента – демонстрационный. Кем выполняется – учителем, так как работа с пламенем. Перечень вопросов для беседы с учащимися: - почему перед нагреванием оксида меди (II) водород проверяют на чистоту? - почему пробирку с оксидом меди (II) закрепляют в штатив с наклоном? - почему из черного порошка образуется вещество красного цвета? - что является окислителем, а что восстановителем в наблюдаемой реакции? Реактивы и оборудование: Источник водорода (аппарат Киппа), спиртовка, пробирка, штатив, оксид меди (II). Методика выполнения эксперимента: Проверенный на чистоту водород пропускают над нагреваемым оксидом меди (II). Пробирку закрепляют в штативе немного наклонно вниз отверстием для того, чтобы образующаяся при реакции вода стекала. Для лучшего обнаружения красной меди остаток после опыта растирают в фарфоровой ступке, на которой при этом можно заметить налет металлической блестящей меди. Надо иметь в виду, что охлаждать полученную медь надо в токе водорода, иначе часть восстановленной меди снова окислится. Если взять больше оксида меди, то после пропускания водорода и сильного нагревания ее можно на некоторое время оставить. Наблюдается самораскаливание оксида меди, так как восстановление её водородом является реакцией экзотермической.  Уравнение реакции: CuO + H2 = Cu + H2O Техника безопасности: осторожно обращаться с химическим оборудованием, перед началом работы прогреть пробирку по всему объему, затем нагревать ее только в месте нахождения оксида меди. Вывод: Применение данного эксперимента в образовательном процессе продемонстрировало учащимся химические свойства оксида меди (II). Отработали технику работы со штативами (и их лапками) и навыки написания химической реакции. А также повысили интерес учащихся к изучаемой теме. Опыт 1. «Получение водорода в пробирке» Реактивы и оборудование: Пробирка, разбавленная серная кислота, гранулы цинка, свинца, меди, лучинка, спиртовка. Методика выполнения эксперимента: В пробирку на ¼ её объема наливают разбавленную кислоту и кладут 3-4 кусочка цинка. Подождав до вытеснения из неё воздуха, получающийся водород поджигают (проверка на чистоту). Провести реакции с Pb и Cu (рассмотреть, как проблемную ситуацию). Уравнения реакций: Zn + H2SO4 = ZnSO4 + H2 2H2 + O2 = 2H2O Опыт 2. «Устройство и принцип работы аппарата Киппа» Реактивы и оборудование: Аппарат Киппа, гранулы цинка, соляная кислота, пробирка для собирания газа, лучинка, спиртовка. Методика выполнения опыта: В среднем сосуде (1) находятся гранулы цинка, верхний сосуд (2) заполняют кислотой. Когда кран (3) закрыт, и воздух из сосудов (1) и (4) выйти не может, то кислотой можно заполнить только сосуд (4) до отверстия трубки, трубку и сосуд (2). Если же кран (3) открыть, то кислота заполнит сосуд (4), через узкое отверстие пройдет в сосуд (1), после чего начнется выделение водорода. Если же кран закрыть, уровень кислоты станет ниже уровня цинка и прекратится выделение водорода. 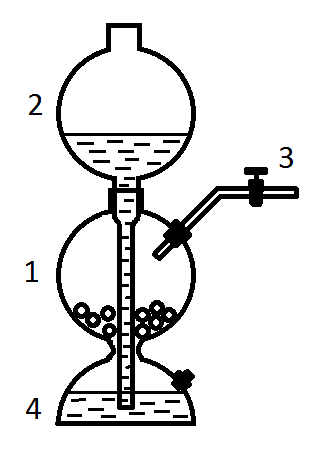 Опыт 3. «Получение водорода в аппарате Киппа» Реактивы и оборудование: Аппарат Киппа, гранулы цинка, соляная кислота, пробирка для собирания газа, лучинка, спиртовка. Методика выполнения эксперимента: Получить водород в аппарате Киппа. Рассказать и показать методы собирания водорода. Доказать, что в пробирке находится водород. 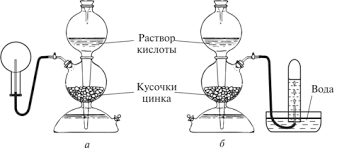 Уравнение реакции: Zu + 2HCl = ZuCl2 + H2 Опыт 4. «Наполнение водородом мыльных пузырей» Реактивы и оборудование: Мыло, глицерин, аппарат Киппа, фарфоровая чашка или кристаллизатор, стеклянная трубка. Методика выполнения эксперимента: Сначала готовят мыльную пену. Для того, чтобы стенки пузырей были более прочными, в мыльную пену можно добавить несколько капель глицерина. К газоотводной трубке от аппарата Киппа (лучше при помощи резиновой трубки) присоединяется аллонж. В аллонж можно вставить ватный тампон. Вата поглощает мельчайшие капельки кислоты, которые способствуют разрушению стенок мыльных пузырей. Пускают ток водорода и конец газоотводной трубки (аллонжа) опускают в мыльную пену. Конец трубки держат слегка наклонно и регулируют краном аппарата Киппа так, чтобы надувались небольшие пузыри. Резким движением руки пузырь отрывают от конца газоотводной трубки, он поднимается вверх.  Опыт 7. «Восстановительные свойства водорода в момент выделения» Реактивы и оборудование: Источник водорода (аппарат Киппа), стеклянная трубка, доходящая до дна пробирки, несколько пробирок, разбавленные растворы перманганата калия и дихромата калия, концентрированная серная кислота, гранулированный цинк. Методика выполнения эксперимента: Разлить приготовленные растворы KMnO4 и K2Cr2O7 в пробирки (для каждого раствора две пробирки). Растворы подкислить серной кислотой. В одну из пробирок с KMnO4 и в одну из пробирок с K2Cr2O7 положить гранулированный цинк. Начинает выделяться водород. В двух других пробирках пропускать водород из аппарата Киппа. Через 3-4 минуты в пробирках, где реагировал водород «в момент выделения», происходят изменения: в пробирке с KMnO4 раствор обесцветится (Mn2+), в пробирке с K2Cr2O7 раствор станет зеленого цвета (Cr3+). В пробирках, в которые водород поступает из аппарата Киппа, никаких изменений не происходит. Решить возникшую проблему с учащимися. Уравнения реакций: 2KMnO4 + 5H2 + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O K2Cr2O7 + 3H2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 7H2O Лабораторная работа № 2 «Углерод и кремний» Опыт 3. «Получение кремниевой кислоты» Цель эксперимента: Демонстрация физических и химических свойств кремниевой кислоты. Задачи эксперимента: демонстрация экспериментального получения кремниевой кислоты, изучение её физических свойств, повторение устройства аппарата Киппа, развитие у учащихся наблюдательности и умения анализировать, сравнивать, делать выводы. Темы школьного курса химии: классы неорганических соединений (кислоты), неметаллы (кремний и его соединения), окислительно-восстановительные реакции. Вид эксперимента – демонстрационный. Кем выполняется – данный эксперимент может выполняться как учителем, так и учеником, потому как данный эксперимент не содержит в себе опасных веществ и не является сложным в плане исполнения. Перечень вопросов для беседы с учащимися: - что будет образовываться при взаимодействии полисиликата натрия и соляной кислоты? - для чего мы добавляем несколько капель раствора фенолфталеина? - что произойдёт при добавлении щелочи к получившемуся золю? - что представляет собой кремниевая кислота? - какие соединения называют «жидким» стеклом? Способ 1 Реактивы и оборудование: Химический стакан, стеклянная палочка для перемешивания, свежеприготовленный водный 10%-ный раствор полисиликата натрия (Na2SiO3)x , разбавленная (1:2) соляная кислота. Методика выполнения эксперимента: В химический стакан наливают раствор полисиликата натрия и несколько капель раствора фенолфталеина. Помешивая раствор стеклянной палочкой, добавляют 10 мл раствора соляной кислоты (розовая окраска фенолфталеина не должна исчезать). Вскоре раствор начинает мутнеть, а через 2-3 минуты всё содержимое стакана застывает в виде студенистой массы розового цвета. Уравнение реакции: Na2SiO3 + 2HCI = H2SiO3 + 2NaCI Кремниевую кислоту нельзя получить в чистом виде. В водных растворах она образует коллоидный раствор или золь, который существует очень малый промежуток времени. Золь далее коагулирует, и образуется гель. При высушивании геля образуются продукты с пористой структурой – силикагели, применяемые в качестве осушителей и адсорбентов. Техника безопасности: техника безопасности при работе с реактивами и химической посудой, все реактивы должны быть плотно закупорены и подписаны. Способ 2 Реактивы и оборудование: Прибор для получения углекислого газа (прибор Киппа), химический стакан, стеклянная палочка, раствор силиката натрия, оксид углерода из пробирки. Методика выполнения эксперимента: Через раствор Na2SiO3 пропускают CO2 из аппарата Киппа. Постепенно в стакане образуется студенистая масса кремниевой кислоты. Уравнение реакции: Na2SiO3 + H2O + CO2 = Na2CO3 + H2SiO3  Техника безопасности: соблюдать правила работы с аппаратом Киппа. Вывод: В результате проведения данного опыта наглядно продемонстрировали учащимся образование кремниевой кислоты и изучили ее химические и физические свойства. Повторили устройство прибора Киппа. Постарались развить у учащихся умения анализировать, сравнивать, делать выводы. Опыт 4. «Горение древесного угля в расплаве нитрата калия» Цель эксперимента: продемонстрировать данным опытом восстановительные свойства углерода. Задачи эксперимента: демонстрация взаимодействия угля с расплавом нитрата калия и изучение химических свойств углерода, демонстрация техники безопасности при работе с пламенем, отработка навыков написания химической реакции, повышение интереса учащихся к данной теме. Темы школьного курса химии: неметаллы ( углерод и его соединения), окислительно – восстановительные реакции. Вид эксперимента – демонстрационный, занимательный. Кем выполняется – учителем, так как работа с пламенем. Перечень вопросов для беседы с учащим - какие признаки химической реакции вы набл - какой газ выделяется в процессе реакции? - окислительные или восстановительные свойства проявляет углерод при горении? Реактивы и оборудование: Фарфоровая чашка, фарфоровая чашка с песком, железная ложечка для плавления веществ, щипцы, спиртовка, древесный уголь, кристаллический KNO3. Методика выполнения эксперимента: В фарфоровую чашку насыпать кристаллического KNO3 и расплавить его над пламенем спиртовки. Затем аккуратно поставить чашку с расплавом в фарфоровую емкость с песком. Взять немного древесного угля и раскалить его над пламенем спиртовки. Тлеющие угольки высыпать в расплав KNO3. Уравнение реакции: C + 2KNO3 → CO2↑ + 2KNO2 Углерод проявляет восстановительные свойства. Техника безопасности: соблюдать технику безопасности при работе со спиртовкой – нельзя перемещать или переносить спиртовку с горящим пламенем, нельзя держать рядом со спиртовкой вещества или материалы, способные легко воспламеняться от кратковременного воздействия источника зажигания с низкой тепловой энергией, запрещается зажигать фитиль спиртовки посредством другой спиртовки, гасить пламя спиртовки только колпачком спиртовки и др. Использовалась фарфоровая чашка, так как фарфор обладает меньшей теплопроводностью. Вывод: Данным опытом продемонстрировали восстановительные свойства углерода, отработали технику безопасности при работе со спиртовками, повысили интерес учащихся к данной теме. Опыт 1. «Получение диоксида углерода» Реактивы и оборудование: Аппарат Киппа, лучинка, спиртовка, химические стаканы, мрамор, соляная кислота, гидроксид аммония. Методика проведения опыта: В аппарате для получения газов (аппарате Киппа) заливают кусочки мрамора (карбоната кальция СаСО3) 20%-ым раствором соляной кислоты. Уравнение реакции: CaCO3 + 2HCI = CaCI2 + H2O + CO2 Полученный в аппарате диоксид углерода собирают в пробирку или стакан вытеснением воздуха. Диоксид углерода тяжелее воздуха, 1 л его при 00С и 760 мм.рт.ст. весит 1,977 г, поэтому им можно наполнить стоячий сосуд, опустив газоотводную трубку на самое дно сосуда. Так как горящая лучина гаснет в атмосфере углекислого газа, то таким образом можно проверить, наполнился ли сосуд. Можно сделать газ видимым. Для этого в стакан с газом добавим две капли концентрированной соляной кислоты и две капли концентрированного гидроксида аммония, затем осторожно перемешаем стеклянной палочкой образовавшийся туман хлорида аммония с диоксидом углерода. Опыт 2. «Химические свойства СО2» Реактивы и оборудование: Аппарат Киппа для получения СО2, небольшой цилиндр, лучинка, спички, раствор соляной кислоты (1:2), мрамор, раствор гидроксида натрия (конц.), шпатель, лакмус, известковая вода, фенолфталеин. Методика выполнения эксперимента: 1). В цилиндр без носика наливают концентрированный раствор гидроксида натрия и опускают газоотводную трубку от аппарата Киппа до поверхности раствора. Открывают зажим и дают сильный ток углекислого газа, чтобы быстро вытеснить весь воздух. Затем вынимают трубку из цилиндра и перекрывают ток углекислого газа. Цилиндр быстро закрывают ладонью и слегка покачивают. Углекислый газ реагирует с гидрооксидом натрия. Уравнение реакции: CO2 + 2NaOH → Na2CO3 + H2O Чтобы убедиться в образовании карбонатов, в цилиндр по стенке осторожно приливают раствор соляной кислоты. Происходит вспенивание – активное выделение углекислого газа. Уравнение реакции: Na2CO3 + 2HCI → 2NaCI + CO2 + H2O 2). Пропуск углекислого газа через пробирки: - с водой, подкрашенной раствором лакмуса; - с известковой водой: Уравнения реакции: CO2 + Ca(OH)2 → CaCO3 + H2O CO2 + Ca (OH)2 + H2O → Ca(HCO3)2 - c раствором щелочи и несколькими каплями фенолфталеина: Уравнение реакции: 2NaOH + CO2 → Na2CO3 + H2O 3). Провести реакции: a) Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O Ca(HCO3)2 → (t) CaCO3 + CO2 + H2O в) гидролиз соли CaCO3 CaCO3 + H2O ≠ Опыт 5. «Выращивание водорослей» Реактивы и оборудование: Химический стакан, силикат натрия, хлорид железа (III) и другие соли. Методика проведения опыта: В стакан налейте «жидкое» стекло, разбавленное водой в 2-3 раза. Поместите в жидкость несколько кусочков FeCL3 (сросшихся кристалликов) величиной с горошину (можно взять и другие соли). Почти сразу же начнется рост бурых извивающихся водорослей. Их рост происходит во все стороны. За 15-30 минут бурые водоросли могут вырасти длиной более 20 см. Уравнение реакции: 3Na2SiO3 + 2FeCI3 → Fe2(SiO3)3 + 6NaCI Лабораторная работа №3 «Азот и фосфор» Опыт 4. «Занимательный опыт – дымящиеся угли» Цель эксперимента: демонстрация химических свойств аммиака. Задачи эксперимента: рассмотреть химическую реакцию взаимодействия аммиака с концентрированной соляной кислотой, изучить строение молекулы аммиака, демонстрация техники безопасности работы с концентрированной соляной кислотой и газообразными токсичными парами, развитие наблюдательности у учащихся. Темы школьного курса: классы неорганических соединений (кислоты, соли), неметаллы ( азот и его соединения), химическая связь (донорно-акцепторная). Вид эксперимента – демонстрационный, занимательный. Кем выполняется – учителем, так как работа с концентрированной соляной кислотой и токсичными парами соляной кислоты и аммиака. Перечень вопросов для беседы с учащимися: -какие признаки химической реакции вы наблюдаете? -какие еще признаки химической реакции вы знаете? -какое вещество образуется в результате данной реакции? -какие механизмы ковалентной связи вы знаете? Реактивы и оборудование. Бюксы, пинцет, концентрированная соляная кислота, концентрированный раствор аммиака. Методика выполнения эксперимента. Хлорид аммония можно получить взаимодействием аммиака и хлороводорода, адсорбированных древесными углями. Для получения «дымящих углей» налейте в бюксы с притертыми крышками немного: в один – концентрированной соляной кислоты, в другой – концентрированного раствора аммиака и поместите в них просушенные древесные угли. Угли через некоторое время адсорбируют хлороводород и аммиак и внешне будут выглядеть сухими. Взяв угли пинцетами, сблизьте их – появится дым хлорида аммония. В бюксах с притертыми крышками «дымящие угли» могут храниться длительное время. Уравнение реакции: NH3 + HCI = NH4CI Техника безопасности: соблюдать технику безопасности при работе с концентрированной соляной кислотой и токсичными газообразными парами аммиака и соляной кислоты, использовать средства индивидуальной защиты (очки, перчатки), работу проводить в вытяжном шкафу. Вывод: Данным опытом продемонстрировали химические свойства аммиака, изучили строение молекулы аммиака, отработали технику безопасности при работе с концентрированной соляной кислотой и токсичными парами аммиака и соляной кислоты, занимательный эксперимент повысил интерес учащихся к обучению и к данной теме. Опыт 2. «Получение аммиака и его определение» Реактивы и оборудование. Пробирки, газоотводная трубка, спиртовка, штатив, хлорид аммония, гидроксид кальция, индикатор. Методика проведения опыта. Смесь равных по объему порций твердого хлорида аммония и порошка гидроксида кальция нагревают в пробирке с газоотводной трубкой. При этом будет выделяться аммиак, который надо собрать в другую сухую пробирку, расположенную отверстием вниз.  Уравнение реакции: 2NH4CI + Ca(OH)2 → CaCI2 + 2NH3↑ + 2H2O Определить аммиак можно по характерному резкому запаху (аммиаком пахнет имеющийся в аптечке нашатырный спирт – водный раствор аммиака). При растворении аммиака в воде образуется гидроксид аммония. А также по изменению цвета лакмуса или фенолфталеина. Опыт 2. «Разложение дихромата аммония (вулкан)» Реактивы и оборудование. Фарфоровая чашка, спиртовка, лучинка, дихромат аммония. Методика выполнения эксперимента. В фарфоровую ступку или чашку насыпают горкой около 4 г дихромата аммония. Стеклянную палочку или деревянную лучинку нагревают в пламени горелки и осторожно подносят к «вершине» горки. Начинается бурная экзотермическая реакция разложения, сопровождаемая разбрасыванием зеленого «пепла». Уравнение реакции: (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O Реакция началась от горячей лучинки, но не прекратилась, когда лучинку убрали, а стала еще интенсивней. Дело в том, что в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается до тех пор, пока вся масса дихромата не превратиться в оксид хрома (III), азот и воду. Оксид хрома – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок. При проведении опыта следует остерегаться попадания на кожу дихроматов – эти вещества вызывают аллергию и являются канцерогенными. Оксид хрома является опасным веществом, опыт проводить под тягой, соблюдать правила пожарной безопасности. Опыт 3. «Каталитическое окисление аммиака» Реактивы и оборудование. Колба, железная ложка для сжигания веществ, спиртовка, концентрированный раствор аммиака, оксид хрома (III). Методика проведения опыта. В большую колбу или бутыль налить несколько миллилитров концентрированного раствора аммиака и встряхиванием сосуда перемешайте выделяющийся из раствора газообразный аммиак с воздухом. Накалите в железной ложке для сжигания веществ свежеприготовленный оксид хрома (III) (получается разложением дихромата аммония). Внесите оксид хрома в колбу – он раскалится. В конце колба наполнится дымом, состоящим из частичек нитрита и нитрата аммония. Уравнения реакций: 4NH3 + 5O2 → 4NO + 6H2O 2NO + O2 → 2NO2 2NO2 + H2O → HNO3 + HNO2 NH4OH + HNO3 → NH4NO3 + H2O NH4OH + HNO2 → NH4NO2 + H2O Опыт 5. «Гидролиз фосфата и дигидрофосфата натрия» Реактивы и оборудование. Пробирки, индикатор, фосфат натрия, дигидрофосфат натрия. Методика выполнения эксперимента. Провести гидролиз солей, определить среду гидролиза и объяснить наблюдения. Записать уравнения реакций. Уравнения реакций: 1). Na3PO4 + H2O ↔ Na2HPO4 + NaOH Соль образована сильным основанием и слабой кислотой. Реакция щелочная. Гидролиз по аниону. PO43+ + H2O ↔ (HPO4)2‾ + OH‾ 2). NaH2PO4 + H2O ↔ NaOH + H3PO4 H2PO4‾ + H2O ↔ H3PO4 + OH‾ |
