Фотометрия. Лабораторная работа 3. 4 Фотометрическое определение содержания никеля (II) в присутствии окислителей
 Скачать 355.24 Kb. Скачать 355.24 Kb.
|
|
Лабораторная работа №3.4 Фотометрическое определение содержания никеля (II) в присутствии окислителей Цель работы. Изучение фотометрического метода и его применение для анализа однокомпонентных систем. Задание. Определить содержание ионов никеля в растворе по поглощению его комплексного соединения с диметилглиоксимом в присутствии иода. Выполнить статистическую обработку и обсуждение результатов. Теоретическое введение. Под названием спектральный анализ мы понимаем физический метод анализа химического состава вещества, основанный на исследовании спектров испускания и поглощения атомов или молекул. Эти спектры определяются свойствами электронных оболочек атомов и молекул, колебаниями атомных ядер в молекулах и вращением молекул, а также воздействием массы и структуры атомных ядер на положение энергетических уровней; кроме того они зависят от взаимодействия атомов и молекул с окружающей средой. В соответствии с этим спектральный анализ использует широкий интервал длин волн — от рентгеновых до микрорадиоволн. Спектральный анализ используется для определения разнообразных органических соединений, а также минеральных элементов с концентрацией 10-2 – 10-6 моля. Спектральные методы дают широкие возможности для наблюдения и исследования соответствующих аналитических сигналов в различных областях электромагнитного спектра – рентгеновское излучение, ультрафиолетовое (УФ) излучение, видимый свет; инфракрасное (ИК), а также микро- и радиоволновое излучение. По применяемым методам: · эмиссионный, использующий спектры излучения, главным образом атомов. Однако возможен эмиссионный анализ и молекулярного состава, например в случае определения состава радикалов в пламенах и газовом разряде. Особым случаем эмиссионного анализа является люминесцентный анализ; · абсорбционный, использующий спектры поглощения, главным образом молекул и их структурных частей; возможен анализ по спектрам поглощения атомов; · комбинационный, использующий спектры комбинационного рассеяния твердых, жидких и газообразных проб, возбуждаемые монохроматическим излучением, обычно — светом отдельных линий ртутной лампы; · люминесцентный, использующий спектры люминесценции вещества, возбуждаемые главным образом ультрафиолетовым излучением или катодными лучами; · рентгеновский, использующий а) рентгеновские спектры атомов, получающиеся при переходах внутренних электронов в атомах, б) дифракцию рентгеновых лучей при прохождении их через исследуемый объект для изучения структуры вещества; · радиоспектроскопический, использующий спектры поглощения молекул в микроволновом участке спектра с длинами волн больше 1 мм. По характеру получаемых результатов: · качественный, когда в результате анализа определяется состав без указания на количественное соотношение компонентов или дается оценка — много, мало, очень мало, следы; · полуколичественный, или грубоколичественный, или приближенный. В этом случае результат выдается в виде оценки содержания компонентов в некоторых более или менее узких интервалах концентраций в зависимости от применяемого метода приближенной количественной оценки. Этот метод благодаря его быстроте нашел широкое применение при решении задач, нетребующих точного количественного определения. · количественный, при котором выдается точное количественное содержание определяемых элементов или соединений в пробе. · Все эти типы анализа, за исключением качественных, используют упрощенные или точные методы фотометрирования спектров. По способу регистрации спектров различаются следующие методы: · Визуальные при наблюдении спектров в видимой области с помощью простых или специализированных спектроскопов (стилоскоп, стилометр). В ультрафиолетовой области возможно наблюдение сравнительно ярких спектров с помощью флуоресцирующих экранов, располагаемых вместо фотографической пластинки в кварцевых спектрографах. Применение электронно-оптических преобразователей позволяет визуально наблюдать спектры в ультрафиолетовой и ближней инфракрасной областях (до 12000А). · Фотографические, использующие фотографическую пластинку или пленку для регистрации спектров с последующей обработкой. · Фотоэлектрическиедля ультрафиолетовой, видимой и ближней инфракрасной областей, использующие фотоэлементы разных типов, фотоумножители и фотосопротивления (инфракрасная область). Фотоэлектрические методы иногда называются методами прямого анализа, т. е. анализа без посредства фотографической пластинки. · Термоэлектрические для инфракрасной области, в том числе далекой, с использованием термоэлементов, болометров и других типов термоэлектрических приемников. Спектрофотометрия – метод исследования и анализа, основанный на измерении спектров поглощения в оптической области электромагнитного излучения. Спектрофотометрия широко применяется для исследования органических и неорганических веществ, для качественного и количественного определения различных веществ, для контроля технологических процессов и окружающей среды. По типам изучаемых систем спектрофотометрию обычно делят на атомную и молекулярную. Спектры возникают при переходе системы из одного стационарного состояния в другое. При этом система поглощает или испускает энергию в виде кванта, величина которого равна разности энергии двух состояний: hν = E2 – E1 где h – постоянная Планка; ν – частота кванта света. Вместо частоты ν используют волновое число ω = ν/с = 1/λ, где с – скорость света; λ – длина волны. Волновое число ω также называют частотой. Тогда частота спектральных линий определяется по формуле: ω = (Е2 – Е1)/сh П. Бугер (1729г.) и И. Ламберт (1760 г.) установили взаимосвязь поглощения с толщиной слоя раствора. А. Бер (1852 г.) выявил зависимость поглощения от концентрации вещества. Указанные зависимости легли в основу закона светопоглощения, названного законом Бугера – Ламберта – Бера: «Интенсивность поглощения света растворами вещества пропорциональна их концентрации и толщине поглощающего слоя». Или «Растворы одного и того же окрашенного вещества при одинаковой концентрации вещества и толщине слоя раствора поглощают равное количество световой энергии (светопоглощение таких растворов одинаковое)». Математическое выражение этого закона следующее: Ib = Iо ·10 –ε с l, (3) где ε– коэффициент поглощения, л.моль-1 .см-1; l– толщина слоя раствора, см; c– концентрация вещества, моль/л. Удобнее выражать этот закон в таком виде: А =ε . b. С Молярный коэффициент поглощения (ε) – представляет собой оптическую плотность раствора с концентрацией вещества 1 моль/л при толщине слоя 1см. Закон Бугера – Ламберта – Бера справедлив только для строго монохроматического излучения. При графическом выражении зависимость поглощения от концентрации (при прочих постоянных условиях) имеет вид прямой линии, выходящей из начала осей координат (рисунок 1a). В случае отклонений прямолинейная зависимость искажается. Поэтому одной из причин отклонения от линейной зависимости оптической плотности растворов от концентрации является недостаточная монохроматичность светового потока. Другой причиной отклонения от закона Бугера – Ламберта – Бера является изменение состояния поглощающего веществав растворе. b  a c Рисунок 1– Отклонения от закона Бугера –Ламберта–Бера Некоторые окрашенные вещества при разбавлении или действия посторонних веществ разрушаются с образованием бесцветных продуктов взаимодействия. При этом может образовываться осадок и раствор обесцвечивается. Вследствие этого наблюдается нарушение линейной зависимости между Aи С в положительную (рисунок 1b) или в отрицательную (рисунок 1с) сторону. Фотометрическое определение компонентов следует проводить при условиях, обеспечивающих полноту образования поглощающего (окрашенного) соединения в растворе, отсутствие (или минимизация) отклонения от основного закона светопоглощения, способствует наибольшей точности и чувствительности анализа. Для измерения светопоглощения исследуемого раствора выбирают длину волны светового потока, соответствующую максимуму поглощения. Д A ля этого измеряют оптическую плотность раствора при разных длинах волны и строят график зависимостиA= f () – спектр поглощения (рисунок 2). Р 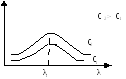 исунок 2 – Зависимость оптической плотности от длины волны исунок 2 – Зависимость оптической плотности от длины волныРабота в области максимума поглощения обеспечивает наибольшую чувствительность и точность определения. Поглощение исследуемого раствора обычно измеряют относительно раствора сравнения, поглощение которого условно принимается равным нулю. Если раствор сравнения представляет собой чистый растворитель или так называемый «раствор контрольного опыта» (т.е. раствор, подвергнутый той же обработке и содержащий все компоненты измеряемого раствора за исключением исследуемого вещества), то такой метод измерения называют абсолютным. С целью повышения точности молекулярного абсорбционного анализа и расширения диапазона определяемых концентраций используют дифференциальные методы. Различают метод определения высоких концентраций веществ, метод определения малых концентраций веществ и метод предельной точности. В аналитической практике наибольшее распространение получил метод определения высоких концентраций веществ. В этом методе в качестве раствора сравнения используют стандартный раствор с концентрацией сo. Измеряемая этим методом относительная оптическая плотность исследуемого раствора Аотн с концентрацией вещества сх равна: Аотн=Ах - Ао=ε(сх- сo), (1.5) где Ах и Ао – оптические плотности исследуемого раствора и раствора сравнения, измеренные абсолютным методом. Выбор раствора сравнения является наиболее ответственной процедурой при выполнении дифференциальных измерений. Для достижения максимальной точности определения концентрации вещества следует использовать раствор сравнения, для которого значение условной оптической плотности εlcо максимально. Точность дифференциальных определений приближается к точности классических методов анализа, характеризующихся погрешностями 0.2-0.5%. Обоснование методики. В щелочной среде (аммиак, щелочь) в присутствии окислителя (бром, иод, пероксид водорода, персульфат аммония) никель (II) образует с диметилглиоксимом (Н2Д) растворимый в воде красно-коричневый комплекс. В результате реакции происходит окисление никеля (II) до трехвалентного состояния (Ni(III)). В зависимости от того, проводится ли реакция в среде аммиака или щелочи, образуются два различных вида комплексных соединений, отличающихся своими спектральными характеристиками. Комплекс, образующийся в щелочной среде, характеризуется интенсивной полосой поглощения с λмакс. = 470 нм и молярным коэффициентом поглощения в максимуме полосы поглощения εмакс. = 1,3·104 . Молярное соотношение Ni:H2Д, где Н2Д – молекула диметилглиоксима, в комплексном соединении равно 1: 3. Для аналитических целей лучшим окислителем является иод, так как получающееся в его присутствии комплексное соединение более устойчиво во времени. Избыток иода в растворе не окисляет диметилглиоксим, что позволяет добиваться хорошей воспроизводимости результатов фотометрических определений. Определению никеля мешают большинство элементов. Их чаще всего маскируют тартратами или цитратами. Экспериментальная часть Реактивы и оборудование. Колориметр фотоэлектрический концентрационный КФК-2. Пипетки градуированные вместимостью 5,00 и 10,00 мл. Колбы мерные вместимостью 50,00 мл. Стандартный раствор никеля (II), 0,0100 мг/мл. Иод, 0,05 М раствор. Диметилглиоксим, 1%-ный раствор в 20 %-ом растворе NaOH. Выполнение определения. В 5 мерных колб вместимостью 50,00 мл цилиндром приливают по 20 мл дистиллированной воды, градуированной пипеткой стандартный раствор с содержанием никеля (II), соответственно, (мг): 0,0200; 0,0400; 0,0600; 0,0800 и 0,100, по 0,5 мл раствора иода и раствора диметилглиоксима, разбавляют дистиллированной водой до метки и тщательно перемешивают. Через 10 мин растворы фотометрируют относительно воды. Результаты записывают в таблицу и строят градуировочный график в координатах «оптическая плотность – концентрация (содержание) никеля (II)» (Для построения графика используют миллиметровую бумагу).
Анализируемый раствор, содержащий никель (II) получают у преподавателя в мерной колбе вместимостью 50,00 мл, разбавляют до метки дистиллированной водой и тщательно перемешивают. В мерную колбу вместимостью 50,00 мл цилиндром наливают 20 мл дистиллированной воды, вводят аликвоту анализируемого раствора (см. таблицу) и далее проводят те же операции и в той же последовательности, что и при приготовлении серии стандартных растворов. Спустя 10 мин после приготовления, раствор фотометрируют относительно дистиллированной воды. Результаты записывают в таблицу.
По градуировочному графику находят концентрацию никеля (II) и, учитывая разведение, рассчитывают его содержание в анализируемом растворе. Проводят статистическую обработку результатов. Расчет. Содержание никеля (II) (m, мг) в анализируемом растворе вычисляют по формуле:  где СNi – концентрация никеля, найденная по градуировочному графику, мг/50мл; Vм.к. – вместимость мерной колбы, мл; Vал. – объём аликвоты, мл. Ситуационная задача. Из навески стали массой 0,2542 г после соответствующей обработки получили 100,0 мл раствора, содержащего диметилглиоксимат никеля. Оптическая плотность этого раствора относительно раствора сравнения, содержащего 6,00 мг Ni в 100,0 мл равна 0,440. Для построения градуировочного графика взяли три стандартных раствора с содержанием 4,00; 8,00; 10,00 мг никеля в 100,0 мл и получили при тех же условиях относительные оптические плотности соответственно: -0,240; 0,240; 0,460. Вычислить массовую долю (%) никеля в стали. А1 = А х - А ср, А 2 = А ст - А ср А1/А2=Сх-Сср/Сст-Сср Сх=А1/А2(Сст-Сср)+Сср Сх=0,440/0,240(0,08-0,06)+0,06=9,67*10^-2 мг/мл Массовая доля W=9,67*10^-2*100*10^-3/0,2542=3,86% 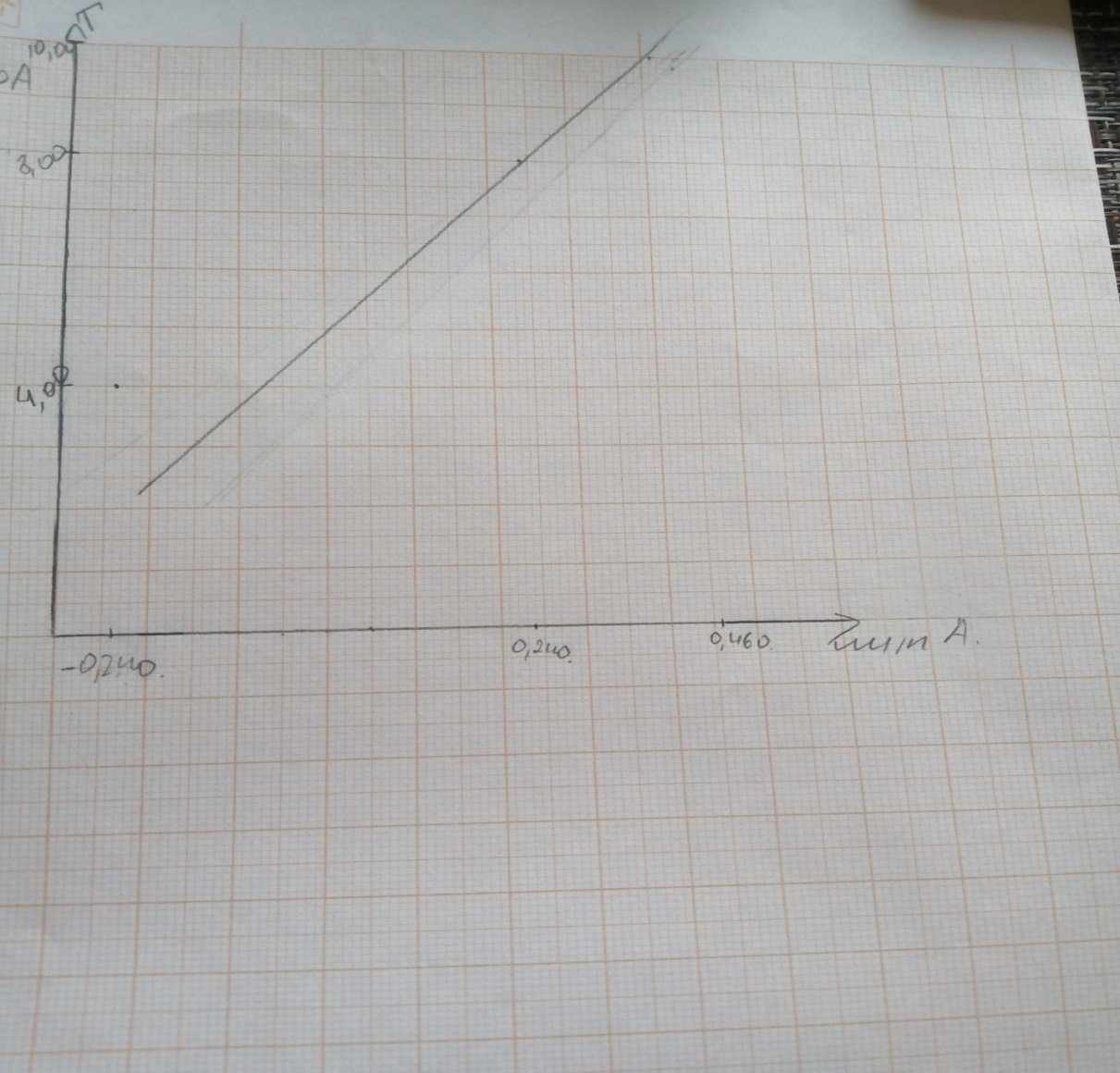 |
