Лекции по физико-химическим методам анализа. Лекции по физикохимическим методам анализа. Лекции по физикохимическим методам анализа
 Скачать 281.5 Kb. Скачать 281.5 Kb.
|
ЛЕКЦИЯ 6. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗАЭти методы используются для анализа питьевой воды, природных и сточных вод и продуктов питания. Любой электрический параметр - потенциал Е, сила тока I, сопротивление R, заряд - зависит от состава анализируемого раствора и может служить аналитическим сигналом. Классификация электрохимических методов по измеряемому параметру.
6.1. ПОТЕНЦИОМЕТРИЯЭтот метод анализа основан на уравнении Нернста. Измерение потенциала электрода в равновесных обратимых условиях, то-есть при отсутствии тока, позволяет определить активность ионов. Измеряют ЭДС цепи, составленной из индикаторного и эталонного электродов. В качестве индикаторных электродов применяют металлические либо ионоселективные (мембранные). Ионометрия- перспективный и быстро развивающийся раздел потенциометрии, основанный на ион-селективных электродах. Главная часть ионоселективного электрода - мембрана, проницаемая для одного вида ионов. Мембрана разделяет внутренний раствор с известной концентрацией ионов и внешний, исследуемый раствор с неизвестной концентрацией. В каждом из растворов находится металлический электрод. Исследуемые ионы проходят через мембрану в сторону меньшей концентрации, накапливаются, устанавливается динамическое равновесие и на поверхности мембраны возникает мембранный потенциал, противодействующий дальнейшему движению ионов. Измеряемая разность потенциалов между металлическими электродами описывается уравнением Нернста и позволяет рассчитать активность (концентрацию) ионов в широком интервале (до 5 порядков). Даже тысячекратный избыток посторонних ионов не влияет на работу электродов. Мембраны бывают:
а) из кристаллического вещества, малорастворимого в воде и обладающего ионной проводимостью, ионы перемещаются по дефектам кристаллической решетки. Пример - б) Стеклянные - ионный обмен Н+ происходит в тонком гелеобразном поверхностном слое стекла, образующимся после выдерживания в водном растворе. Стеклянные электроды широко применяются для измерения рН. в) гетерогенные из различных кристаллов.
Промышленностью выпускаются ион-чувствительные электроды для многих ионов: галогенид-ионов, нитрит- и нитрат-ионов, цианид-ионов, катионов лития, натрия, калия, кальция, серебра, меди, кадмия, свинца, на общую (Са-магниевую) жёсткость воды, на ПАВ. Есть разновидность - газочувствительные электроды - на NH3, NO2, CO2. Внутри находится буферный раствор с определённым значением рН. Молекулы газа проникают через мембрану, реагируют с буферным раствором и изменяют его рН, а рН измеряется вспомогательным стеклянным электродом. Преимущества ионометрии: простота, малогабаритность, дешевизна, экспрессность, возможность непрерывного измерения. Второй вариант потенциометрии -потенциометрическое титрование. Измерение зависимости потенциала электрода от состава раствора используют для определения конечной точки титрования. Вблизи точки эквивалентности происходит скачок потенциала (связан с заменой одной электрохимической реакции другой). 6.2. КУЛОНОМЕТРИЯЭлектролиз - химическая реакция окисления или восстановления на электроде под действием электрического тока. Для измерения количества прошедшего через ячейку заряда применяются кулонометры или электронные интеграторы. В кулонометре протекает известная реакция с 100%-ным выходом по току. Измерение массы образовавшегося в кулонометре вещества позволяет рассчитать прошедший заряд. Кулонометрический метод анализа использует законы электролиза Фарадея: 1. Количество восстановленного или окисленного в результате электролиза вещества прямо пропорционально количеству прошедшего электричества. 2. Массы различных веществ, выделенных на электроде при прохождении 1 Кулона электричества, равны их электрохимическим эквивалентам. Электролиз начинается при определенном напряжении между электродами, называемом потенциалом разложения. Для того чтобы электролиз проходил быстро, напряжение в цепи поддерживают выше потенциала разложения. Если раствор содержит несколько компонентов, имеющих различные потенциалы разложения, можно выделять их из смеси в определенной последовательности, регулируя напряжение. При увеличении напряжения сначала выделяются на катоде металлы, имеющие меньший потенциал разложения. Например, из раствора ионов Pb+2 и Cd+2 (с единичными активностями) сначала будут восстанавливаться на катоде ионы свинца (E0Pb= - 0126 В, Е0Сd= - 0,402 В). Если потенциал катода сделать равным - 0,35 В, то будут восстанавливаться только ионы свинца, а ионы кадмия останутся в растворе. При прохождении тока изменяется потенциал электрода по сравнению с равновесным (определяемым уравнением Нернста), это явление называется поляризацией электрода. Причины - 1) накопление на электродах продуктов восстановления и окисления, которые образуют как бы новый гальванический элемент, ЭДС которого направлена против внешнего источника (химическая поляризация), 2) изменение концентрации ионов вблизи электродов по сравнению с объемом раствора, то-есть возникновение концентрационного гальванического элемента, ЭДС которого также направлена против напряжения внешнего источника тока (концентрационная поляризация). Количественной мерой поляризации является перенапряжение (разность равновесной ЭДС и разностью потенциалов при прохождении тока).. Кулонометрия - высокочувствительный и точный метод анализа, позволяющий определить до 10-9 г вещества. Однако, необходимо правильно подобрать напряжение (потенциал) электролиза, для того чтобы исключить протекание побочных реакций. и автоматизации контроля. 6.3. ВОЛЬТАМПЕРОМЕТРИЯ (ПОЛЯРОГРАФИЯ).Метод основан на расшифровке кривых зависимости тока от потенциала (поляризационных кривых), измеренных в ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения. Наиболее распространённый вариант метода с ртутным капающим электродом называется полярографией. Это высокочувствительный и быстрый метод определения неорганических и органических веществ, один из универсальных методов определения следовых количеств веществ, позволяющий одновременно определять несколько компонентов в смеси. Особенность ячейки для полярографии - сильно различающиеся площади поверхности электродов. Плотность тока на меньшем электроде в несколько тысяч раз больше, чем на электроде сравнения, благодаря чему около него максимальная плотность тока и происходит реакция восстановления катионов. Концентрация катионов быстро уменьшается, наступает динамическое равновесие, когда все катионы, подходящие к капле за счёт диффузии, разряжаются и сила тока постоянна (предельный, или диффузионный ток). Устройство ячейки показано на рис. Первый электрод - ртуть, капающая из капилляра в исследуемый раствор. Второй электрод - донная ртуть, на нём очень малая плотность тока и вблизи него изменение концентрации очень мало и не влияет на реакцию. На ячейку подаётся постоянный потенциал и его медленно изменяют, при этом изменяется ток. Полученный график зависимости тока от потенциала называется полярограммой и показан на рисунке. Он состоит из трех участков: А-Б от начала записи до начала реакции (медленно растёт по закону Ома);  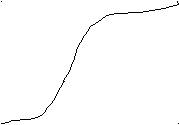 Б-В резкий подъем тока за счет реакции, В-Г- установление практически постоянного диффузионного тока. Б-В резкий подъем тока за счет реакции, В-Г- установление практически постоянного диффузионного тока.  При достижении Е1 (потенциала выделения) начинается реакция восстановления, катионы забирают предлагаемые им отрицательно заряженным электродом электроны и превращаются в атомы. Новые катионы подходят за счёт диффузии, ток возрастает (называется волной). При достижении Е1 (потенциала выделения) начинается реакция восстановления, катионы забирают предлагаемые им отрицательно заряженным электродом электроны и превращаются в атомы. Новые катионы подходят за счёт диффузии, ток возрастает (называется волной).  При определённом потенциале скорость восстановления становится равной скорости подхода катионов за счёт диффузии. Потенциал в точке максимального наклона называется потенциалом полуволны, Е1/2. При определённом потенциале скорость восстановления становится равной скорости подхода катионов за счёт диффузии. Потенциал в точке максимального наклона называется потенциалом полуволны, Е1/2.Предельный ток в точке В ограничен скоростью диффузии ионов к поверхности ртути и называется диффузионным, Id. Он пропорционален концентрации ионов (С) в растворе (уравнение Ильковича): Id=607n(D)1/2m2/3t1/6C, где n - число электронов, участвующих в реакции, D - коэффициент диффузии ионов, m - скорость вытекания ртути, t - период капания, С - концентрация ионов. Если в растворе присутствуют несколько типов ионов с различными потенциалами восстановления, они дадут более сложную кривую, но волны могут чётко разделяться. На рис. пример полярограммы раствора, в котором есть катионы свинца, цинка и кадмия. Доказано, что Е1/2 не зависит от тока и является качественной характеристикой иона, поэтому эта величина используется для качественного анализа. Для количественного используется величина предельного диффузионного тока, так как он пропорционален концентрации ионов. Полярография применима не только для определения катионов, но и для органических веществ, способных восстанавливаться. Например, альдегидов, кетонов, перекисей, молекул с группами >C=N-, -NO2, -NHOH, -S-S-. 6.4. КОНДУКТОМЕТРИЯИзмерение электропроводности используется для определения качества воды, так как электропроводность определяется вкладами электропроводностей всех ионов в растворе. Чаще всего кондуктометрия используется для кондуктометрического титрования. Применимо к реакциям кислотно-основным или осадительным, которые сопровождаются заметным изменением электропроводности вследствие образования слабо диссоциирующих электролитов или малорастворимых соединений. Пример: HCl+NaOH=NaCl+H2O. В точке эквивалентности титрования образуется слабо диссоциированная вода, и электропроводность уменьшается. Дальнейшее добавление NaOH приводит к росту электропроводности. |
