Лекции по химии. Лекция 1. Литература Карпин. Курс химии. Общая химия. Соколовская, изд. Мгу 1989г
 Скачать 10.13 Mb. Скачать 10.13 Mb.
|
Кинетика гетерогенных реакцийТри стадии гетерогенных реакций:
Стадии протекают последовательно. Скорость самой медленной стадии и определяет общую скорость процесса. При низких температурах наиболее медленная стадия – химическое превращение При высоких температурах – лимитирующая стадия (диффузия) Температура больше влияет на скорость реакции, чем на скорость диффузии. КАТАЛИЗКатализ - изменение скорости реакции под действием особых веществ (катализаторов)Увеличение скорости химической реакции – катализ. Уменьшение скорости – антикатвлиз Вещества ингибиторы (расходуемые вещества) Катализаторы не оказывают влияния на свободную энергию. Используя катализатор нельзя сместить полож. химической реакции можно лишь ускорить достижение этого. Применяя катализатор невозможно увеличить выход водного продукта, но можно его получить за значительно меньший промежуток времени. Катализаторы обладают селективными свойствами: Существует катализ г   омогенный и гетерогенный омогенный и гетерогенныйВсе вещества в одной Катализатор находится вфазе Ускоряет действие катализатора работает поверхность ускоряющее Получаются нестойкие соединения действие катализ. 1. 2. Роль катализатора - уменьшение Процесс абсорбции потенциального барьера, т.е. А…Kat С…Kat увеличение скорости реакции. B…Kat D…Kat Ослабление межмолекулярных связей, молекулы становятся возбужденными По Баландину: чтобы ускорить ту или иную реакцию, необходимо выдержать геометрическое расположение между молекулами и активными центрами. ЛЕКЦИЯ №9РастворыРаствор – термодинамическая равновесная (гомогенная) система, состоящая из двух или более фаз. Истинный раствор, когда размеры частиц соизмеримы с размерами молекул, ионов Коллоидный раствор (НМ) Суспензия ( Фаза, в которой больше – растворитель, меньше – растворимое вещество g – процентная концентрация 1мл.=1см3 С, СМ, М – молярность СН, Н – нормальность M – моляльность Т – титр N – мольная доля Виды растворов:
Растворимость газов в газах: растворяются неограниченно, в любых пропорциях. Растворимость газов в жидкостях: Справедлив закон Генри: при постоянной температуре растворимость газа пропорциональна его давлению. С=ГР Г – постоянная Генри. С ростом температуры – растворимость уменьшается. Закон Дальтона: Растворимость газа из смеси газа пропорциональна его парциальному давлению. Растворимость жидкостей в жидкостях: 2 случая
Растворимость меняется при изменении температуры: при низкой – неполная растворимость, при высокой – полная. 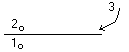 1 – не растворяется в 2 1 – не растворяется в 23 – растворяется и в 1 и в 2 К – коэф-т распределения Пример: раствор йода в воде – хотим убрать йод, добавим хлороформ. Йод – 3, хлороформ – 2, вода – 1 К=130 (раствор йода в хлороформе) |
