|
|
Лекции по химии. Лекция 1. Литература Карпин. Курс химии. Общая химия. Соколовская, изд. Мгу 1989г
Процесс – экстракция
1. Процесс отрыва молекулы от кристалла 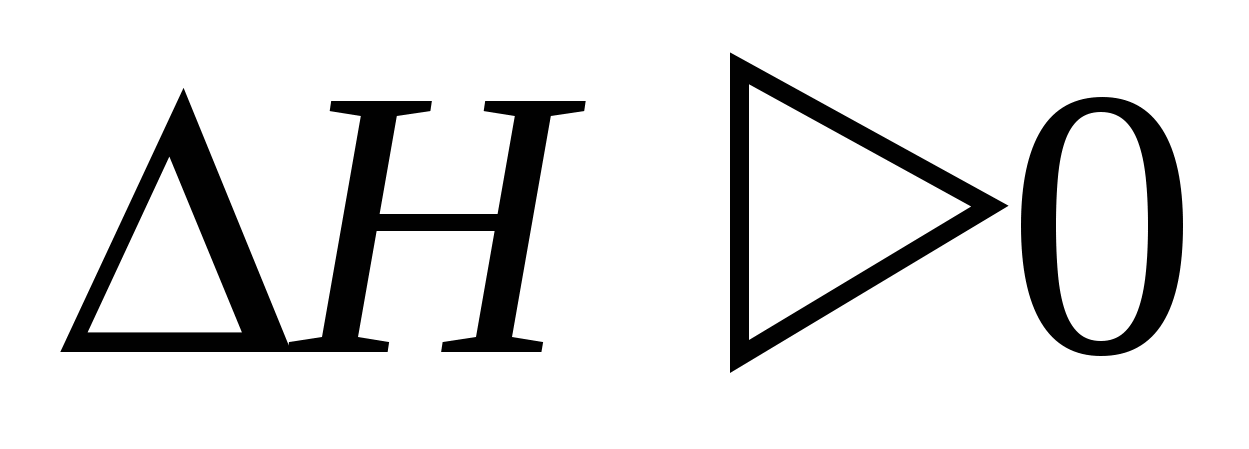
эндотермический процесс)
2. диффузия 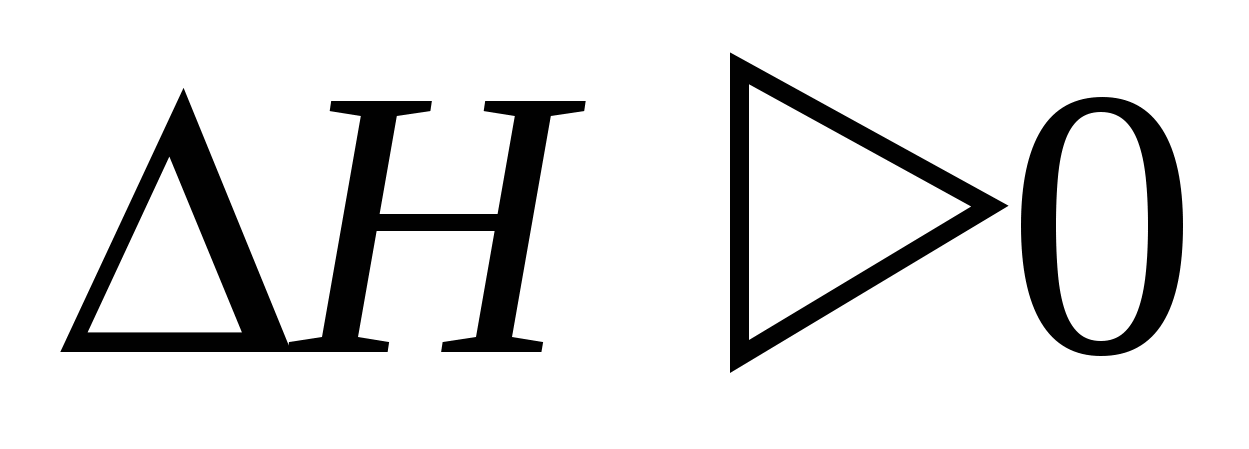 (затраты энергии) (затраты энергии)
3. Химическое взаимодействие молекул среды с оторванными молекулами вещества 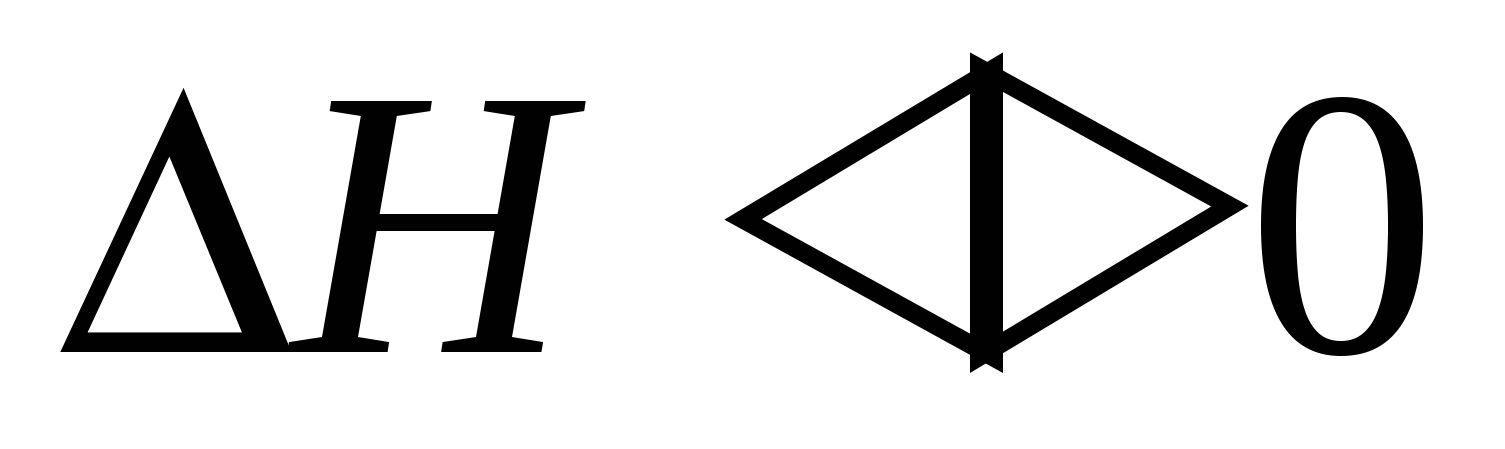
Сольваты – могут образовываться комплексы. Процесс – сольватация
Гидрация – гидраты в воде, процесс гидротация
Зависимость растворимости от температуры
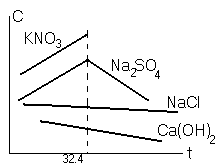  С ростом температуры растворимость С ростом температуры растворимость
  увеличивается увеличивается
Давление паров раствора

Р1 Р2 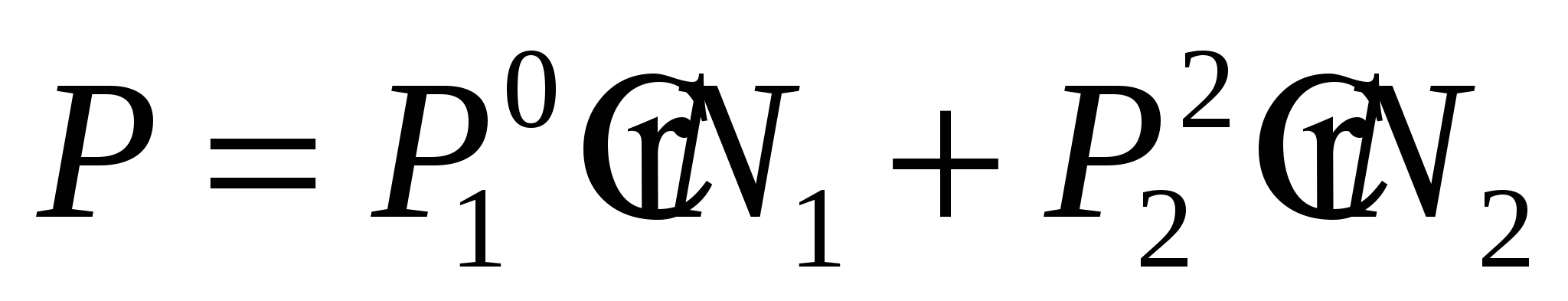
Р – парциальное давление N – мольные доли N1 – растворитель
N2 – растворяемое вещество
N1=1- N2 т.к. ничего кроме растворителя и растворяемого вещества нет
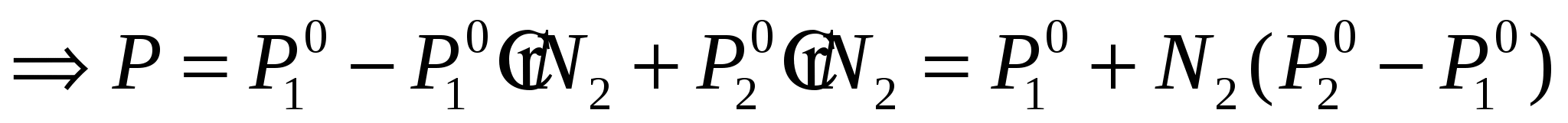
Если раствор разбавленный, то тогда 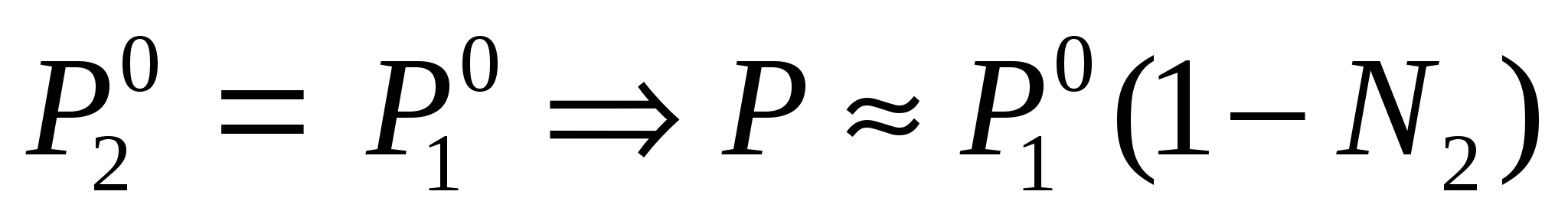
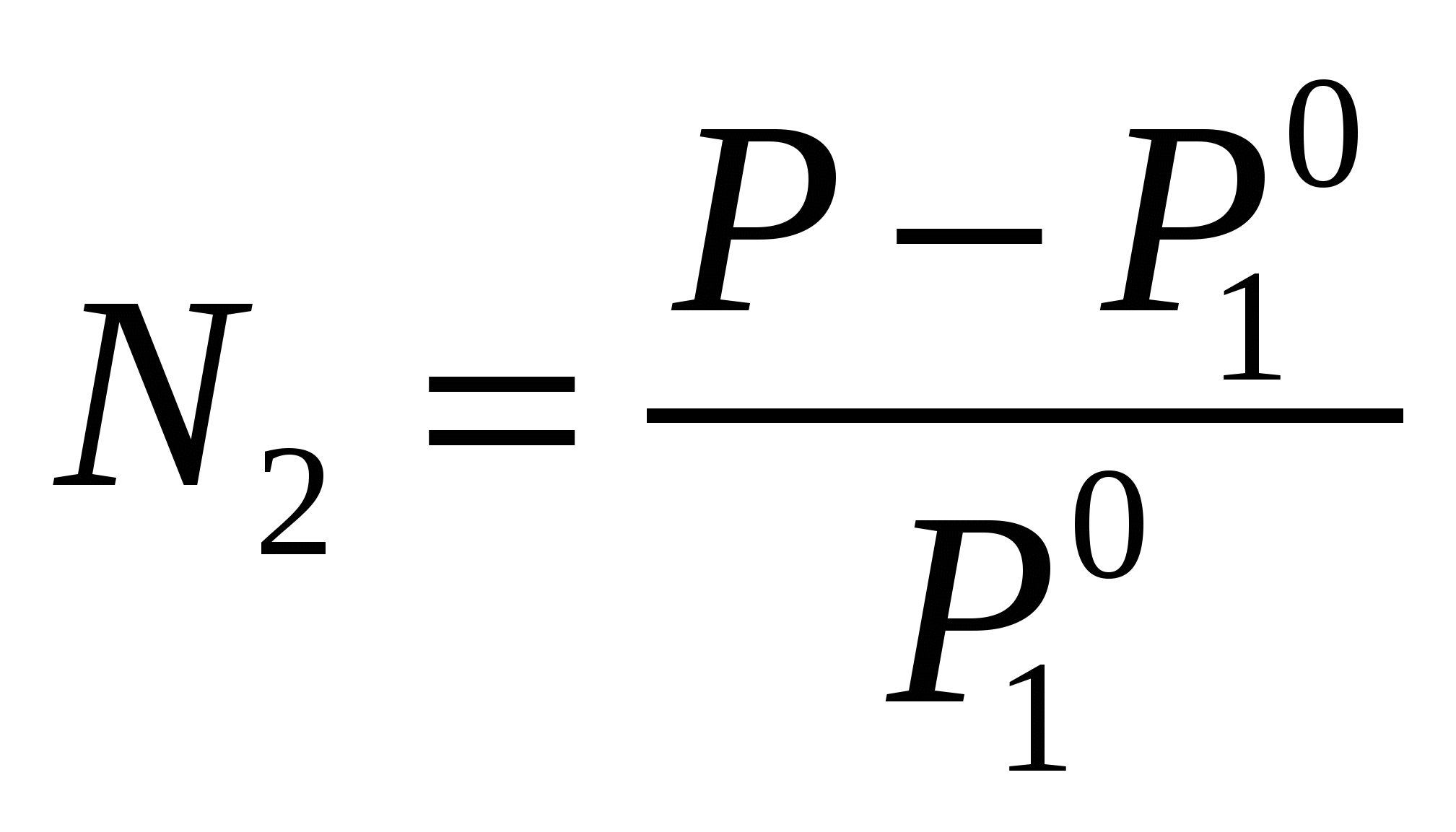 Первый закон Рауля – относительное понижение давления насыщенного пара над растворителем, равно мольной доле растворенного вещества. Первый закон Рауля – относительное понижение давления насыщенного пара над растворителем, равно мольной доле растворенного вещества.
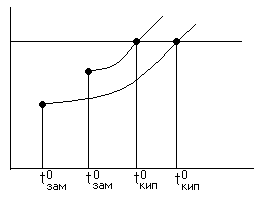   Жидкость кипела Жидкость кипела
Если в жидкость добавили что-то, то темпер.
кипения повышается, а замерзания уменьшается 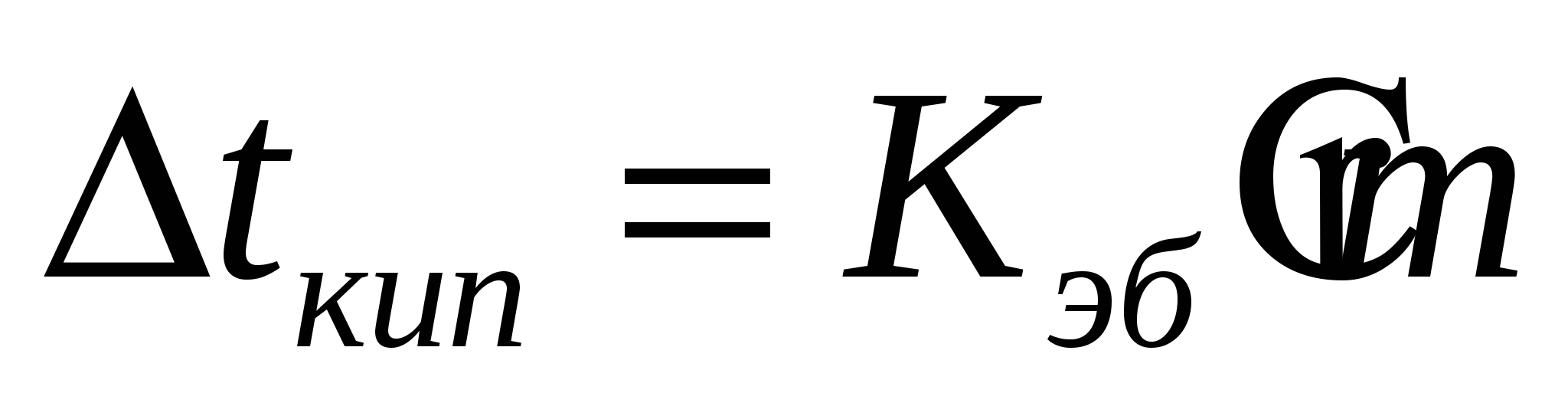 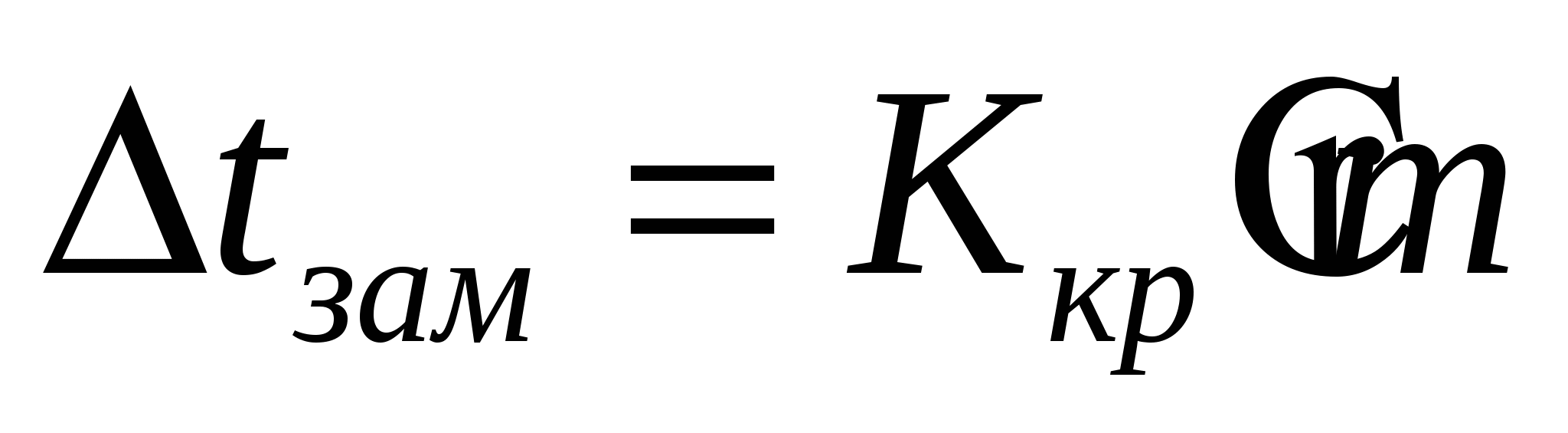
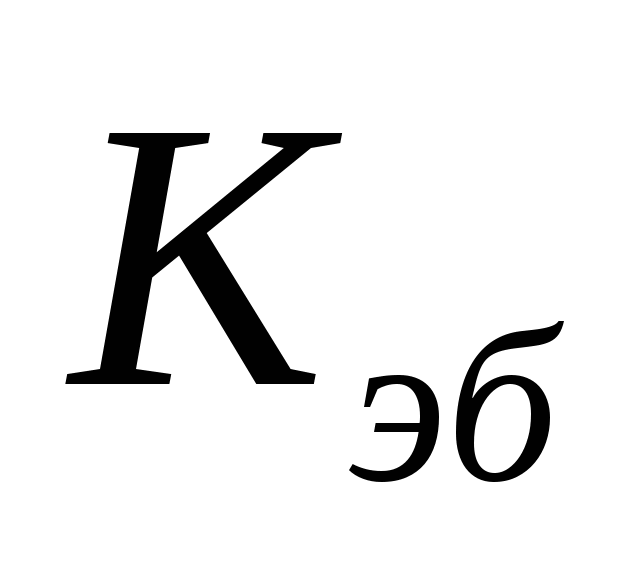 - эбупиоскопическая константа - эбупиоскопическая константа
для воды 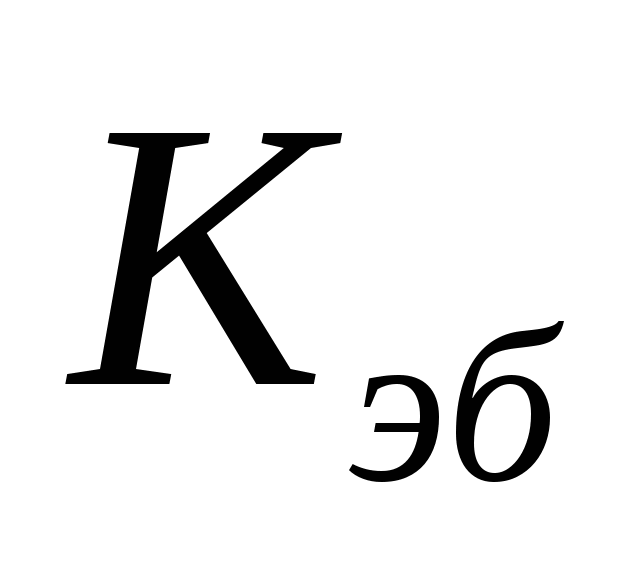 =0,5120 =0,5120
Эбупиоскопия – способ определения
моляльного весов
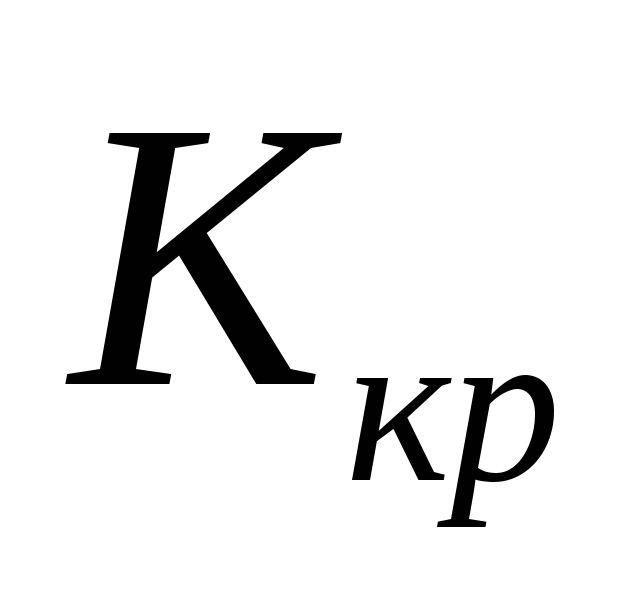 - криоскопическая константа, для воды - криоскопическая константа, для воды
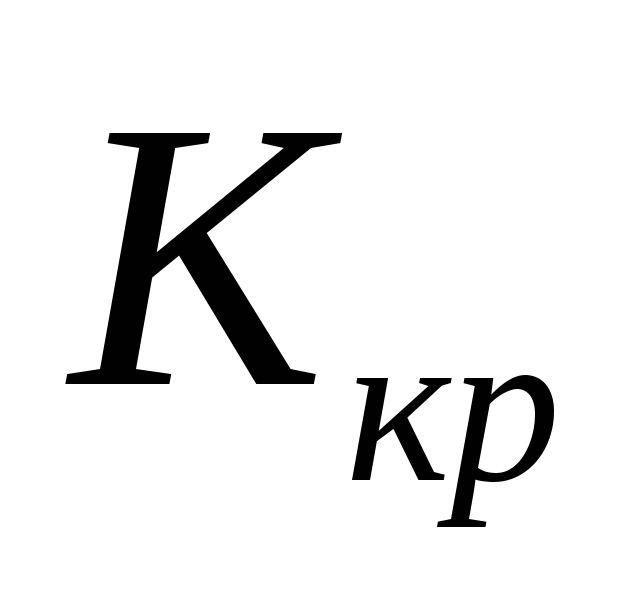 =1,860 =1,860
Второй закон Рауля: 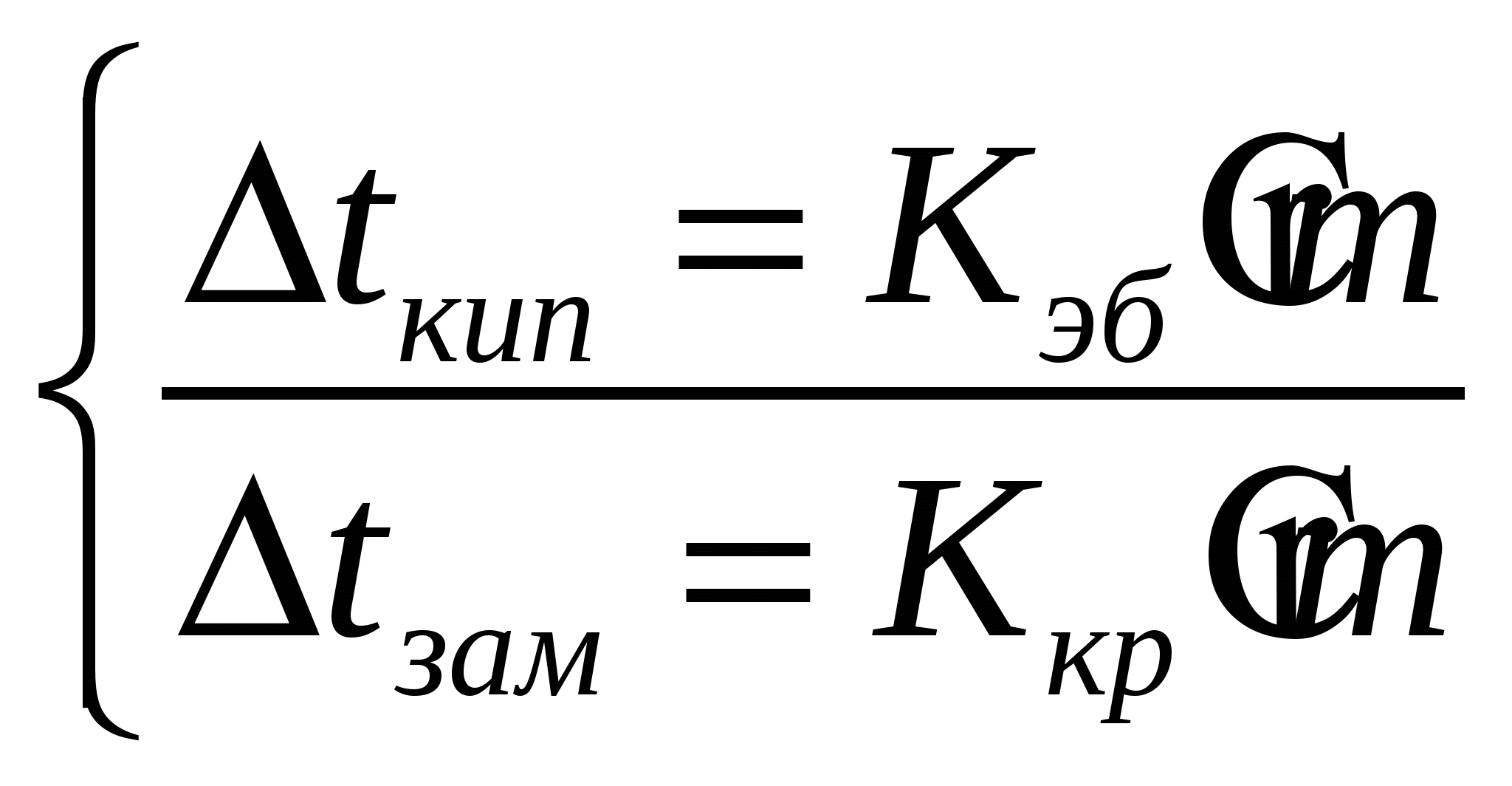
Законы справедливы не всегда (точнее численные значения отличаются в несколько раз от тех, которые должны быть по законам)
Электролиты
Учитывается распад частиц на ионы
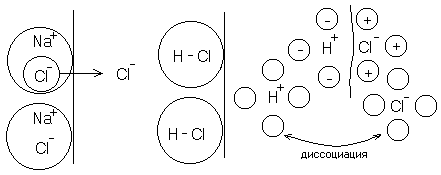  подойдут молекулы подойдут молекулы
с противоположным
ионом (знаком)
Растворитель должен быть полярной жидкостью.
Для воды 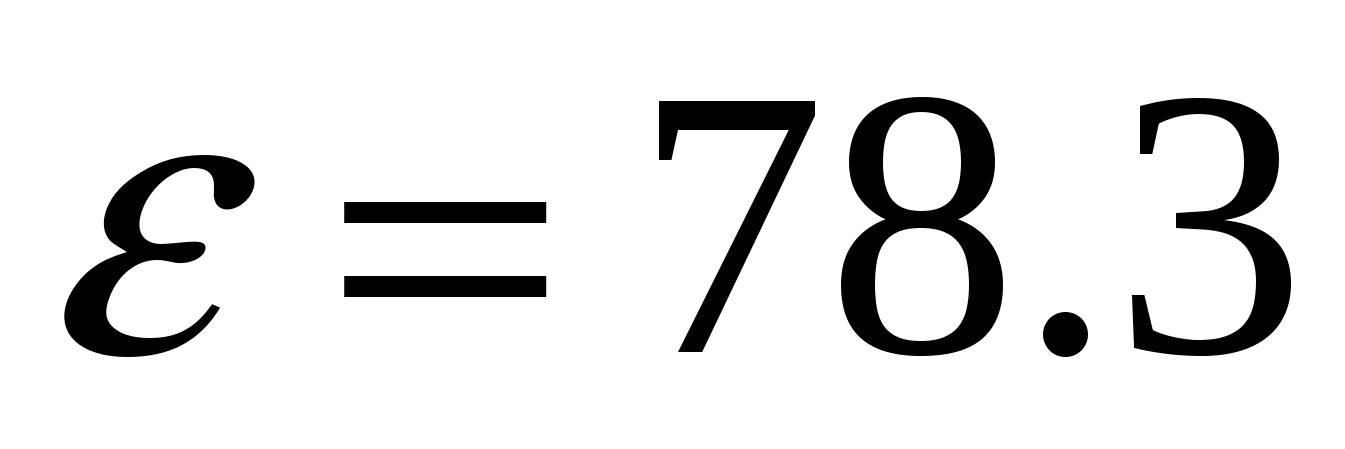
уксус 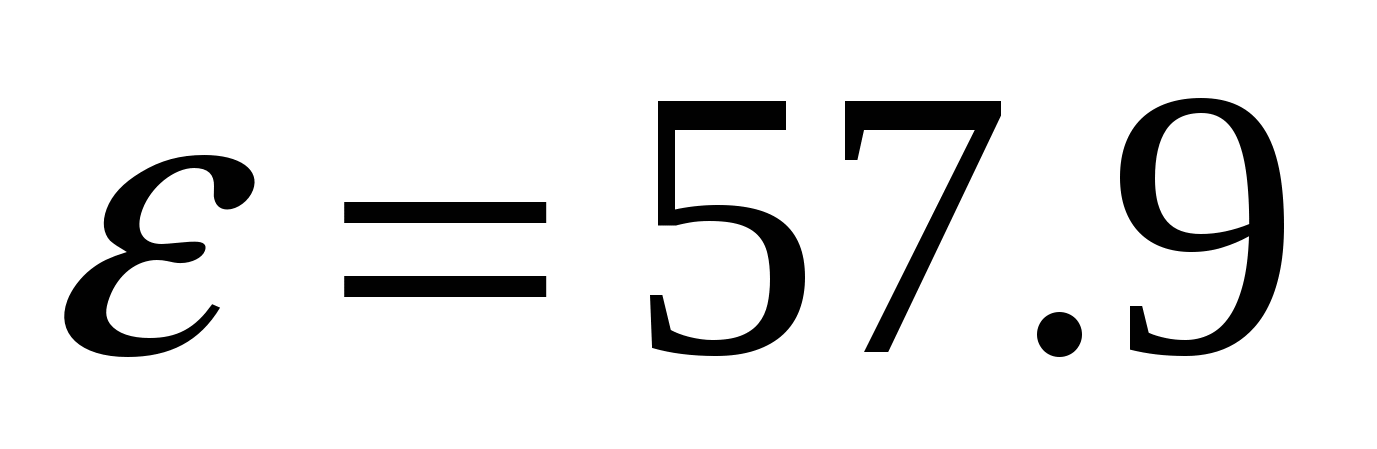
спирт 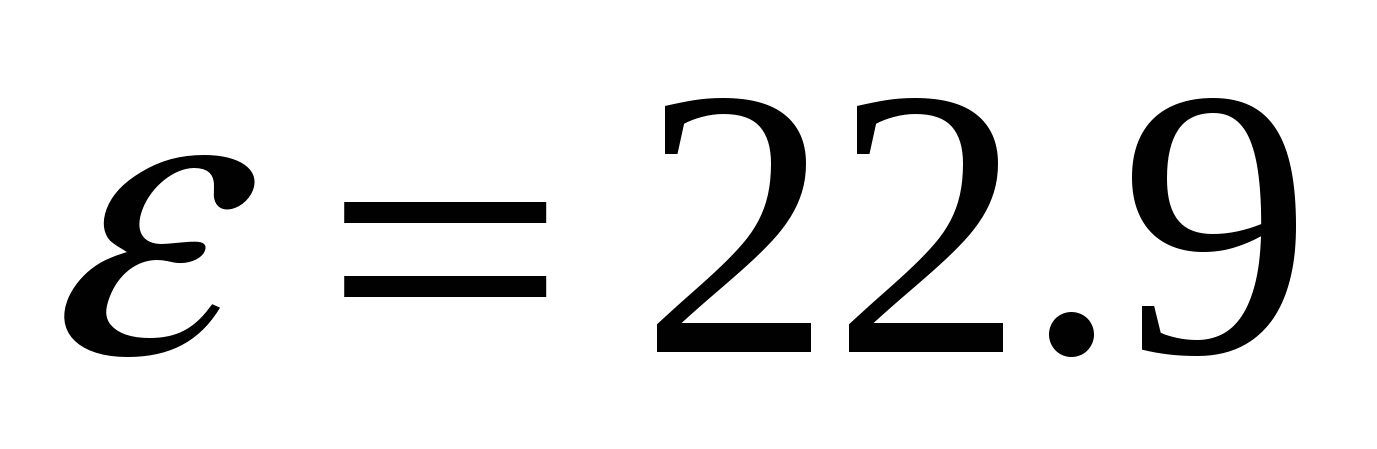
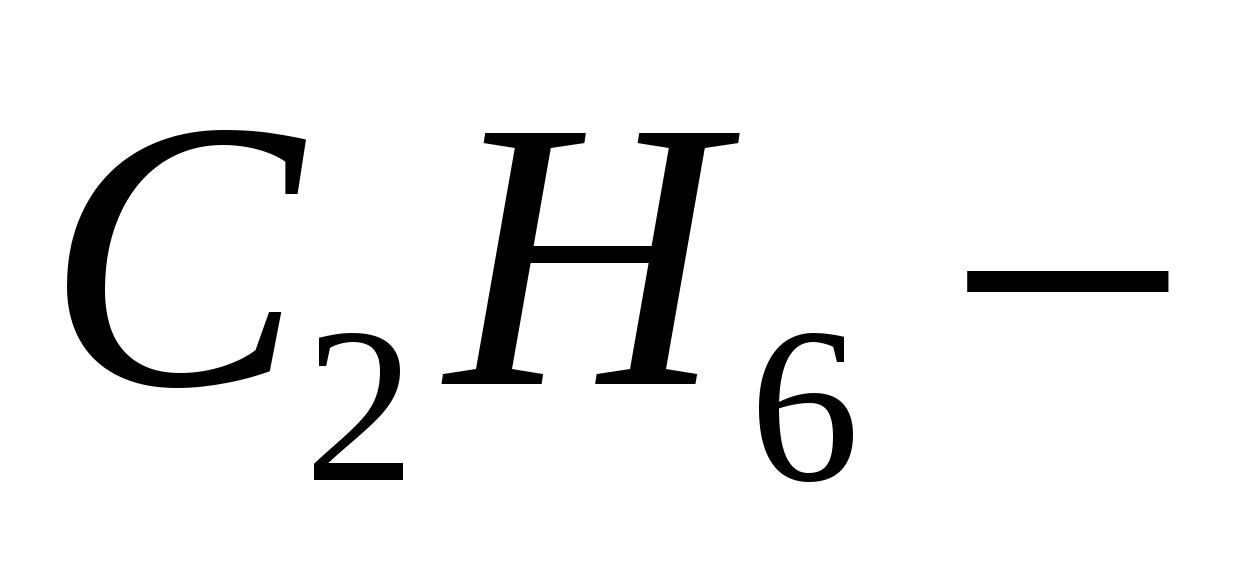 полярности никакой, диссоциации нет. полярности никакой, диссоциации нет.
Диссоциация: 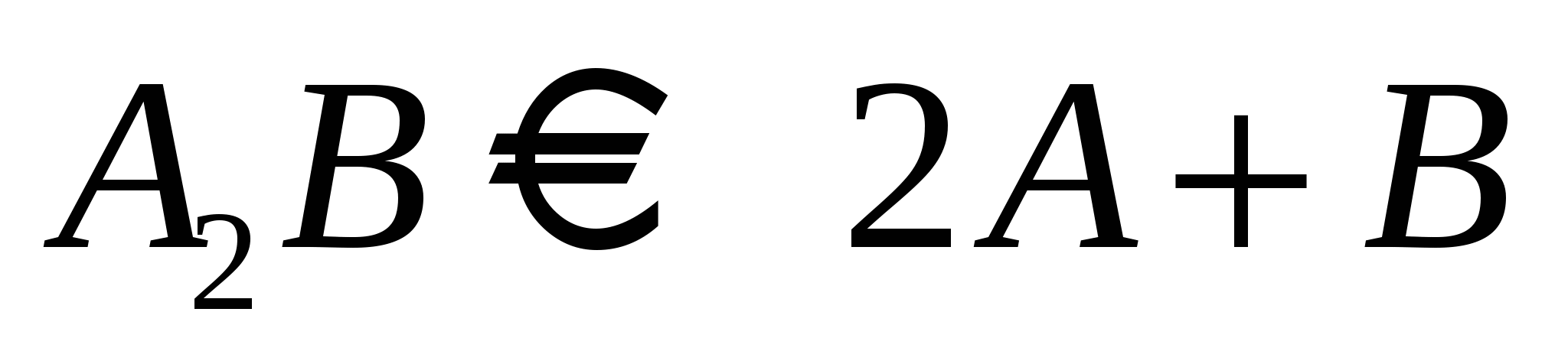 К – константа диссоциации К – константа диссоциации
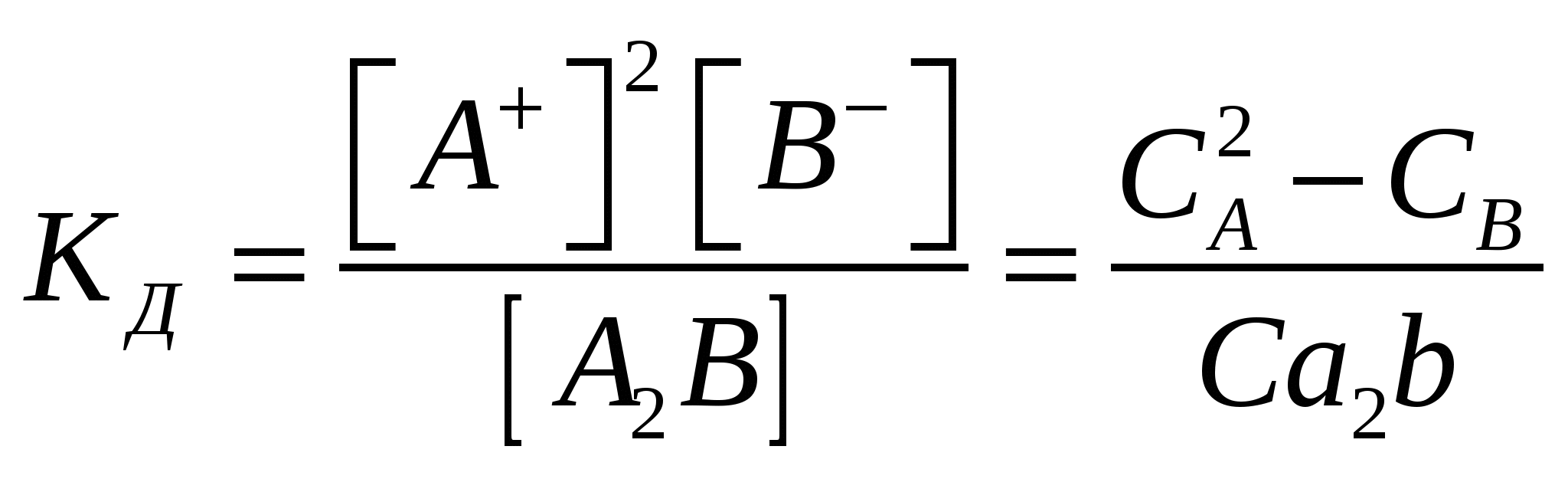
 Молярные концентрации Молярные концентрации
Величина 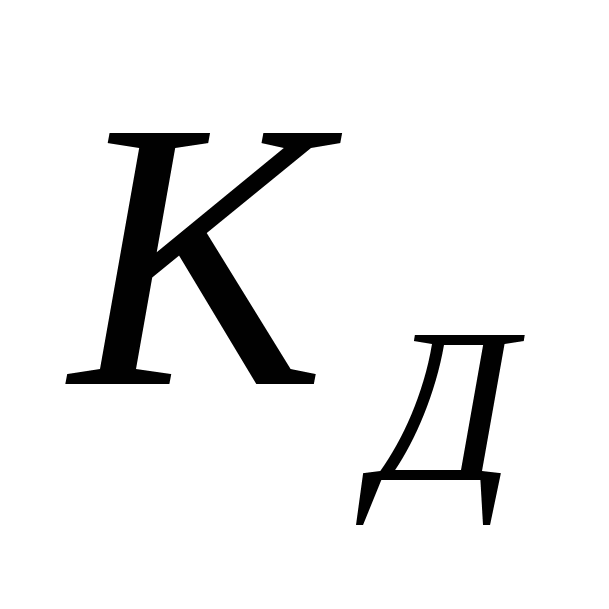 зависит от природы электролита, растворителя, Т, не зависит от концентрации зависит от природы электролита, растворителя, Т, не зависит от концентрации
 - степень диссоциации - степень диссоциации  - кол-во диссоциир. Частиц к общему количеству растворенных частиц Если - кол-во диссоциир. Частиц к общему количеству растворенных частиц Если  близко к 1 – сильный электролит (все соли, сильные кислоты, сильные основания) близко к 1 – сильный электролит (все соли, сильные кислоты, сильные основания)
Если  меньше 0,3 – слабый электролит (все органические соединения) меньше 0,3 – слабый электролит (все органические соединения)
Если 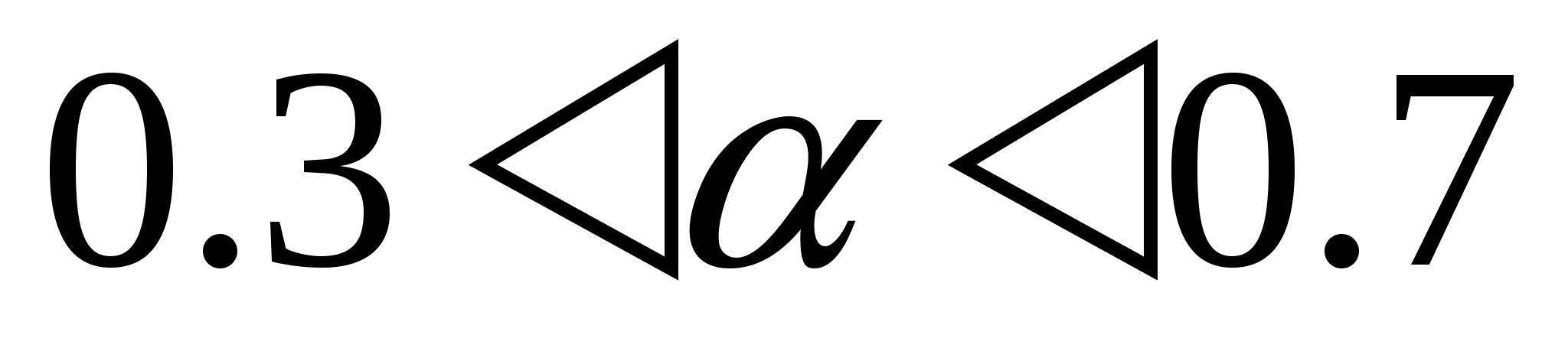 - средний электролит - средний электролит
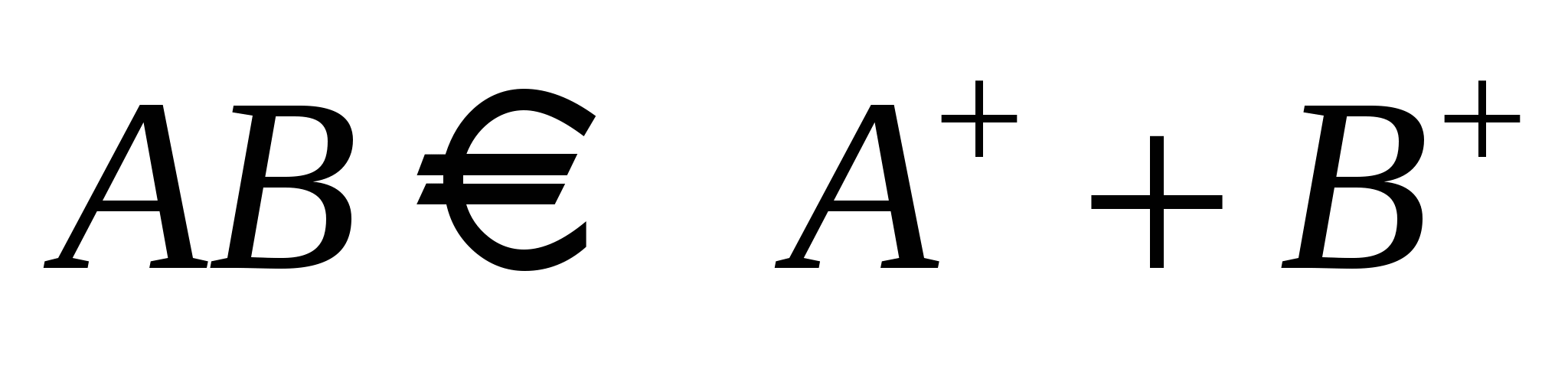 С (исходная концентрация АВ) АВ–равнов. концентрация = С(1- С (исходная концентрация АВ) АВ–равнов. концентрация = С(1- ) )
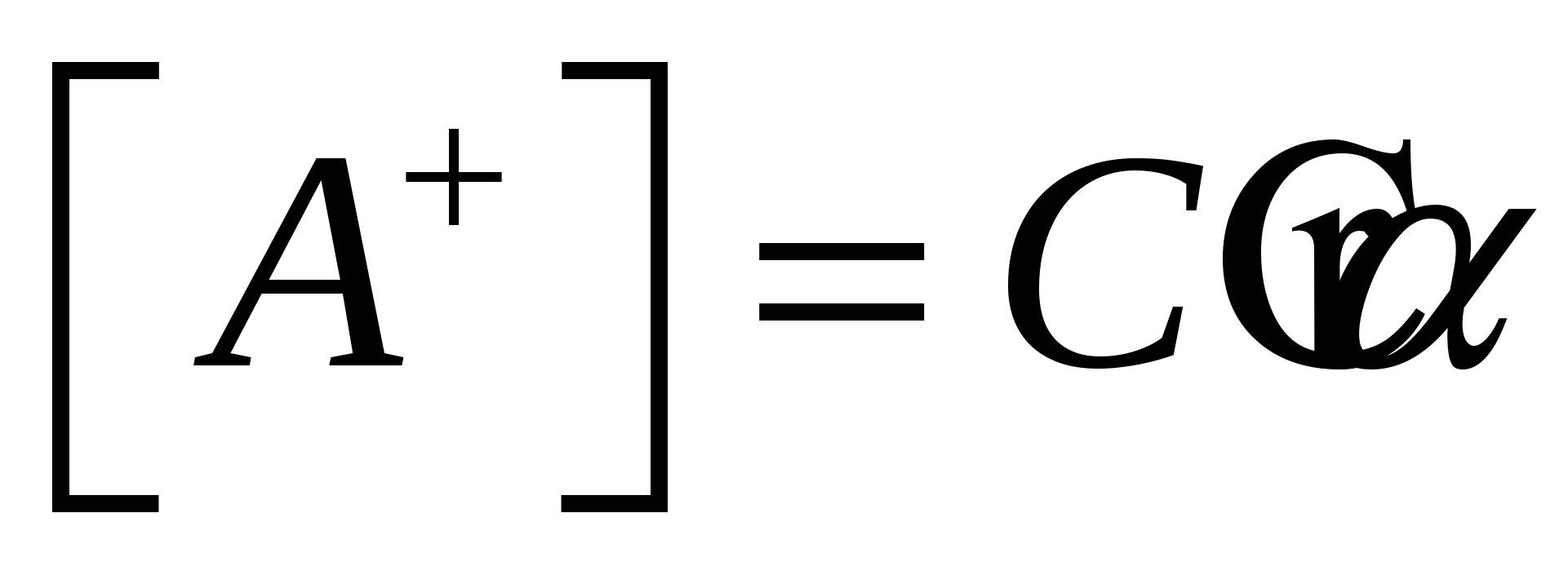 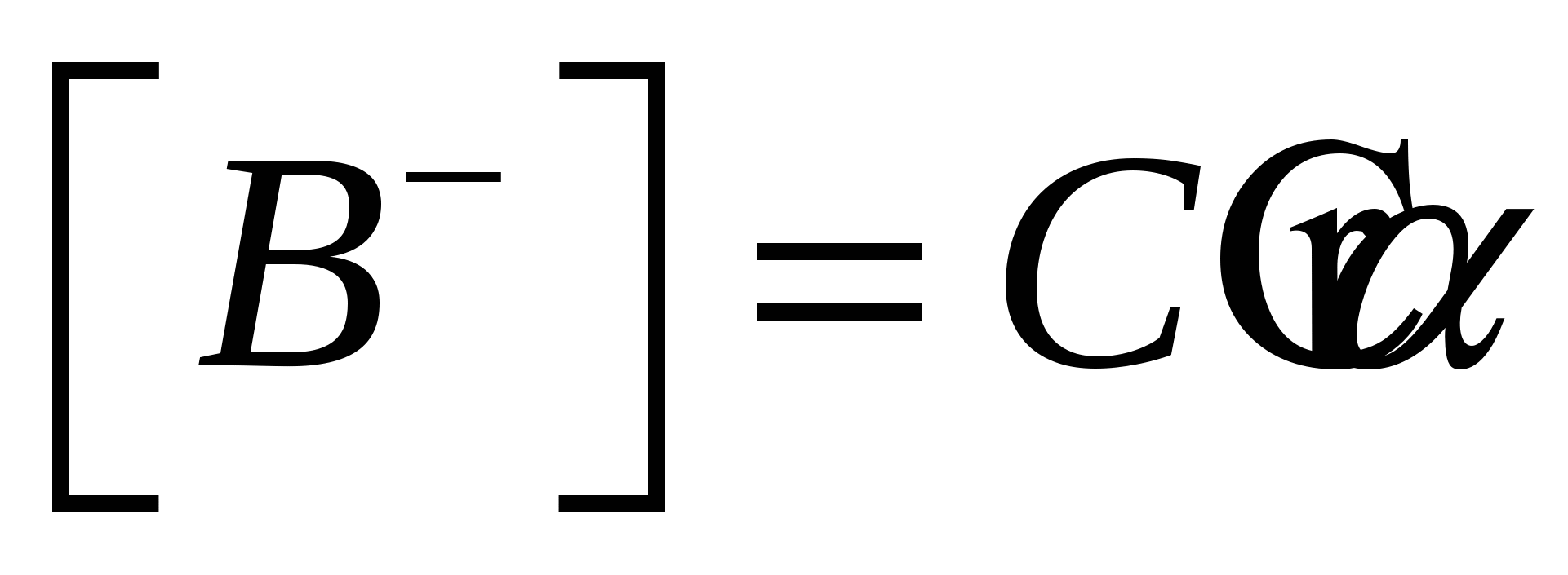 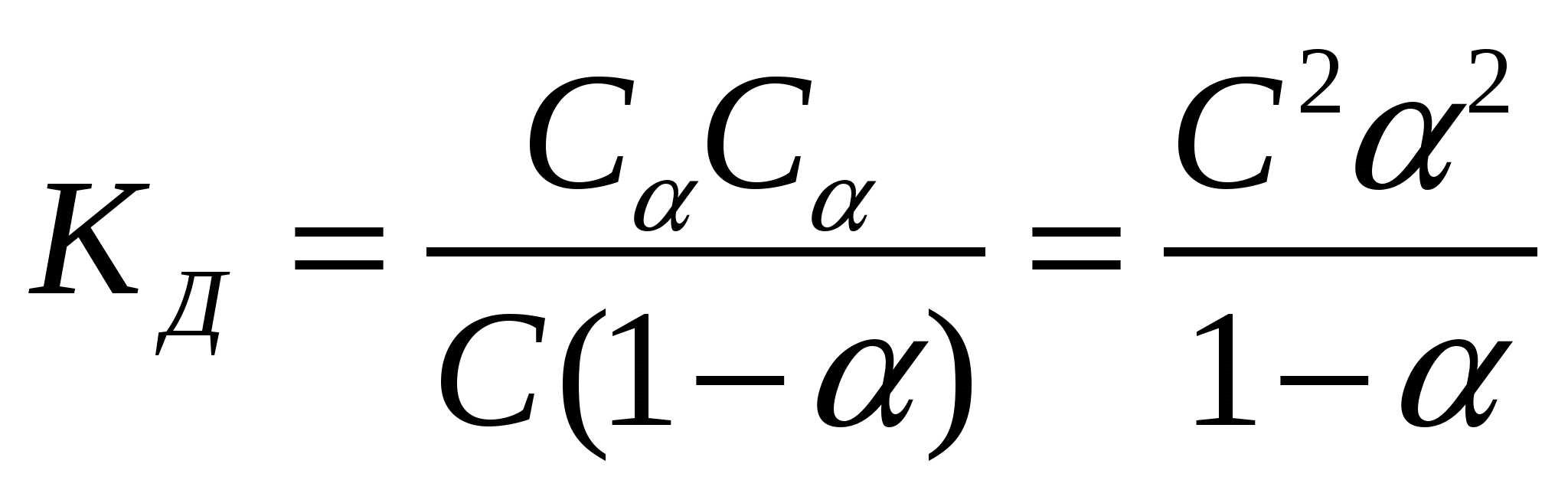 - закон разбавления Оствальда - закон разбавления Оствальда
Частный случай: 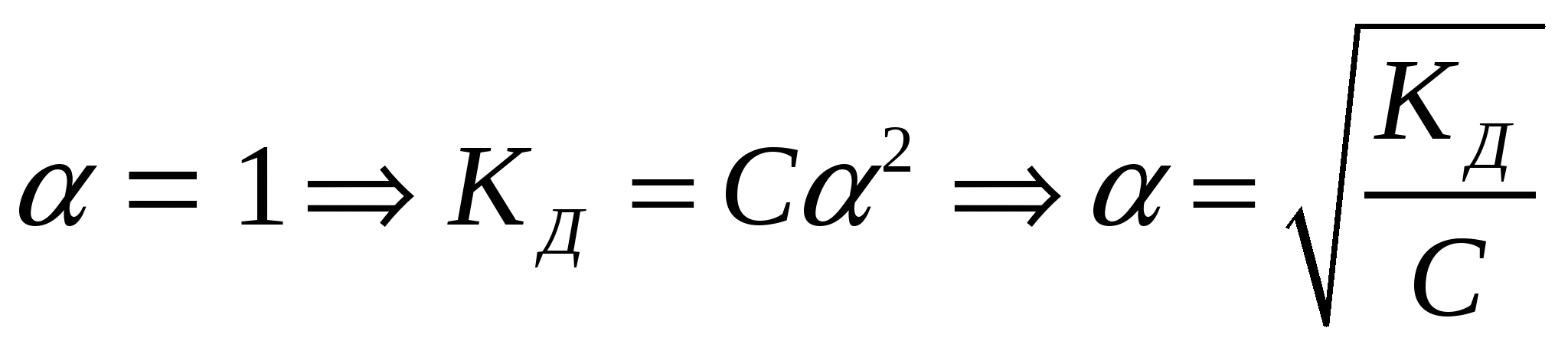
кажущаяся степень диссоциации (коэффициент активности) 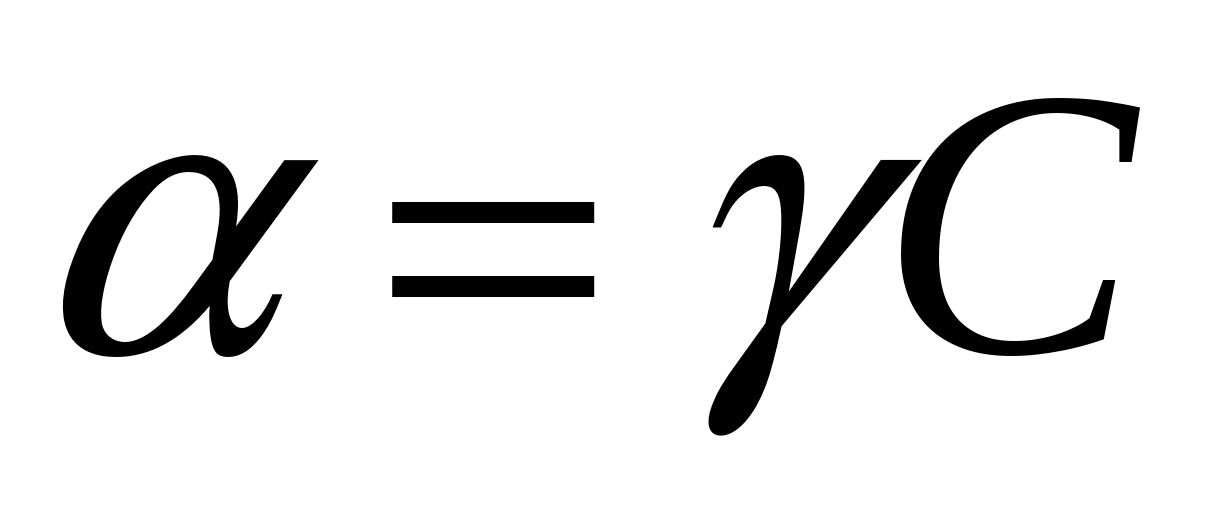
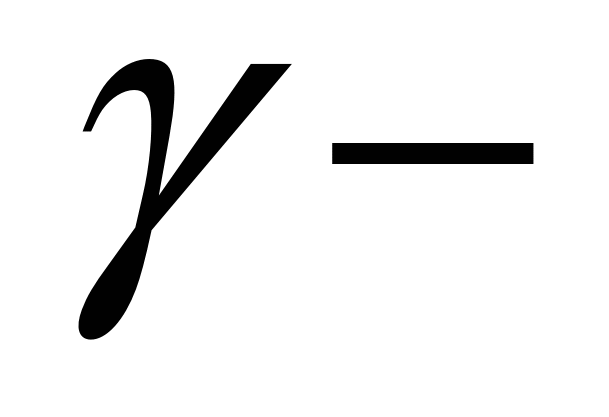 коэф-т активности – показывает на сколько мы можем считать концентрацию близкой к исходной Если коэф-т активности – показывает на сколько мы можем считать концентрацию близкой к исходной Если 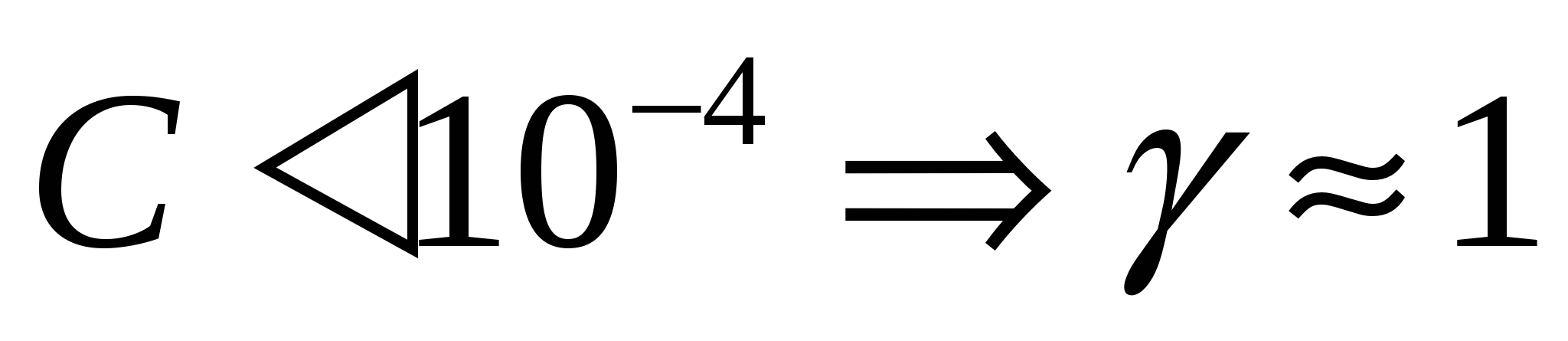
|
|
|
 Скачать 10.13 Mb.
Скачать 10.13 Mb.