Лекции по химии. Лекция 1. Литература Карпин. Курс химии. Общая химия. Соколовская, изд. Мгу 1989г
 Скачать 10.13 Mb. Скачать 10.13 Mb.
|
Валентность как правило определяется S и P электронами (…..)Схема заполнения уровней и подуровней по Клечковскому.1 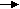 S2 2S2 2P6 3S2 3P6 4S2 3d10 4p6 – 5S2 – 4d10 - 5p6 –6S2 – 5d1 – 4f4 - 5d2-10 – 6p6 – 7s2 - 6d1 –5f14 - 6d2-10 – 7p6 S2 2S2 2P6 3S2 3P6 4S2 3d10 4p6 – 5S2 – 4d10 - 5p6 –6S2 – 5d1 – 4f4 - 5d2-10 – 6p6 – 7s2 - 6d1 –5f14 - 6d2-10 – 7p6 Лантонойды и октенойды. Химическая связь и строение малекул. Химический процесс – процесс разрыва одних и образования других связей. Характеристикой свойств хим. Связи определяется химическое взоимодействие, т.е. форму движения малекул. Энергия молекул складывается из: движения электронов в поле ядер, колебания ядер около полжения равновесия, вращение молекул вокруг центра масс. 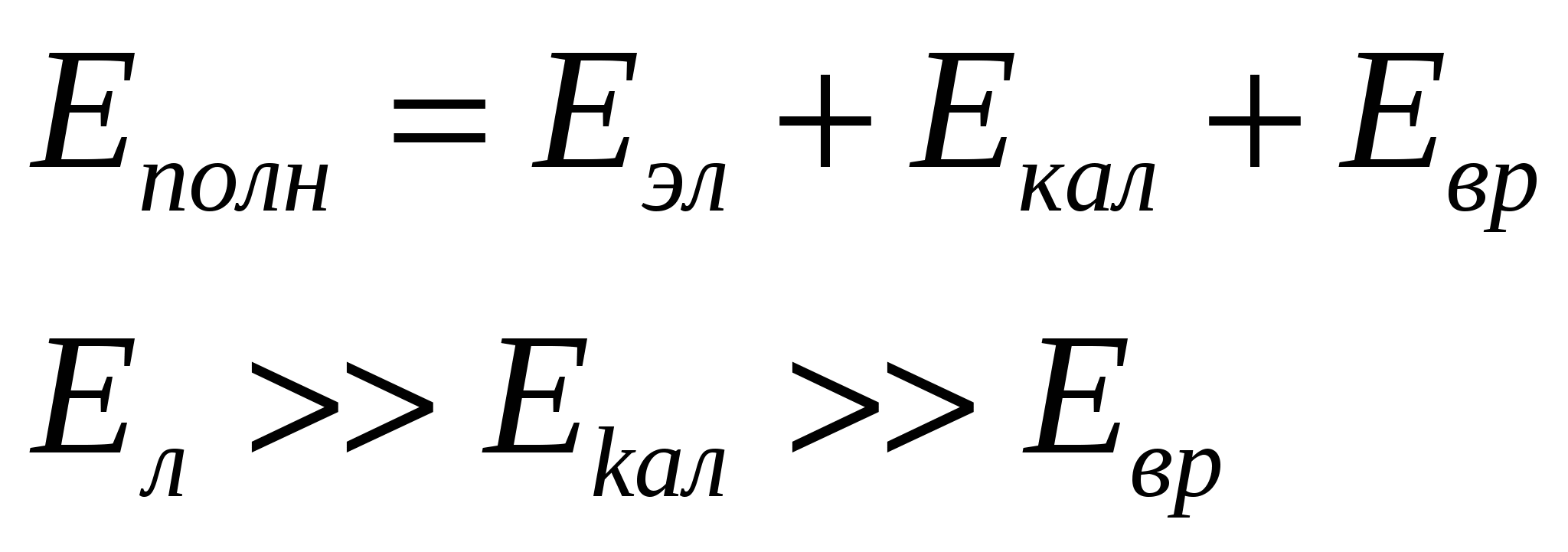 Основной вклад вносит движение электронов в поле ядер. Теория хим. Связи строется на решении квантовой задачи движение электронов в поле ядер. Несколько методов решения. Решение : различная притяженность для разных вычислений. М основные етод валентных связей. Молекулярных орбиталей МВС (1) Пологается что каждая молекула состоит из атомов и для обьяснения электоронного строения применены атомные орбитали состав. ее атома. ММО(2) Рассматривается молекула как единое целое. Эфективн.ММО Метод валентных связей.
Направленность спинов: 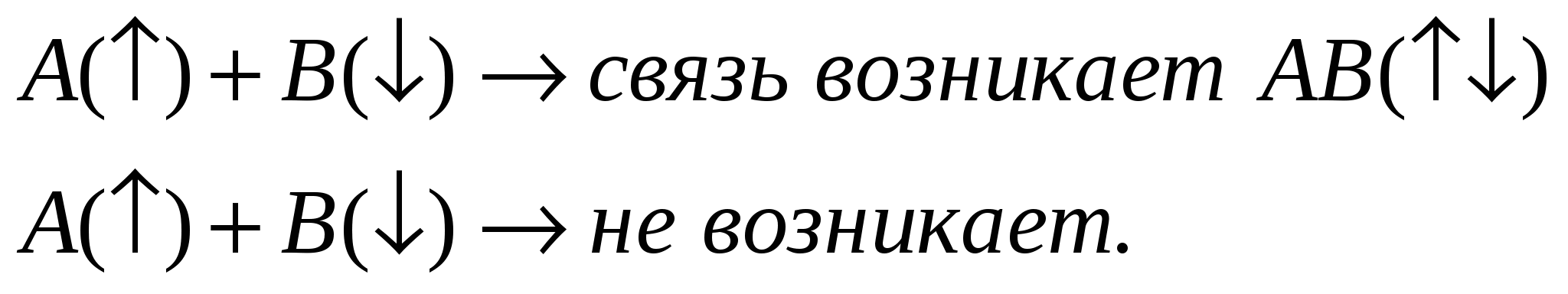 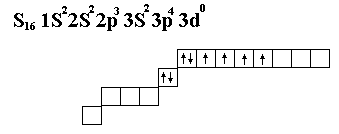 Энергия связи. Под ней понимается та энергия, которая выделяется в результате взоимодействия данных атомов , участвующих в реакции. Если соединение двух атомно; m0-атомарная энергия обр. (тепловой эффект ), есть енергия связи П  ример: ример: 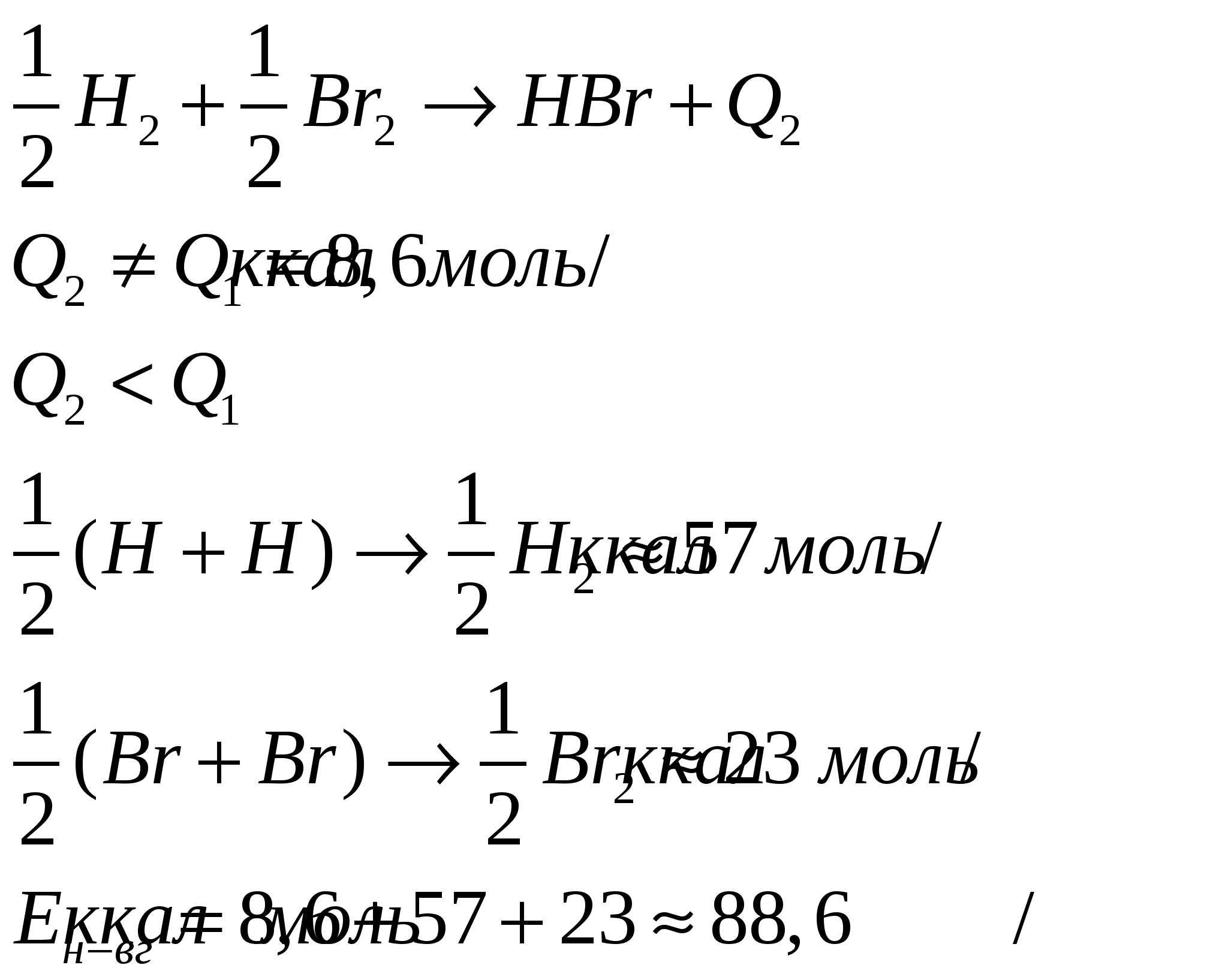 Метод молекулярных орбиталей: Характеристики:
2.1 Молекулярная орбиталь многоцентр –я. 3.Каждой молекулярной орбитали соответствует своя энергия, которая Совокупность молекулярных орбиталей молекулы называют её эл конфигураций, в основе которой лежат два принципа:
Движение электр в молекуле рассматривается как взаимодействие. Электронная энергия молекал есть сумма энергий орбиталей за вычетом суммы энергий межэлектронного отталкивания + сумма энергий отталкивания между ядрами. Направленность ковалентных связей. Виды ковалентных связей:
K и F Na и Cl [Na+] + [Cl-] Na – e Cl + e Взаимодействие осуществляется за счёт сил электростатического взаимодействия. За счёт перераспределения электроны образуют те или иные связи. (2) Связь возникает между атомами, незначительно различными по энергии электроотрицательности. Практически отсутствует обмен Е, возникают общие электронные пары. 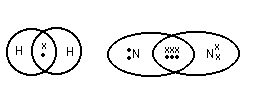 Каждая пара находится на своей орбитали. Разновидностями является Ковалентная полярная связь: ковалентные связи в случае их полярности имеют определённые направленности и определённую форму молекулы. П 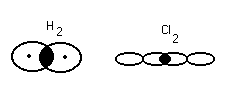 ример: 1. неполярная ковалентная связь ример: 1. неполярная ковалентная связь2. 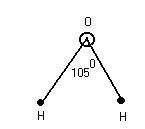 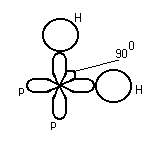 Этот L определяет отчасти сложные свойства воды 3. Г 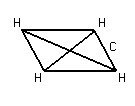 ибридизация электронных облаков ибридизация электронных облаков 4. 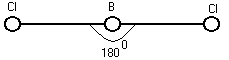 |
