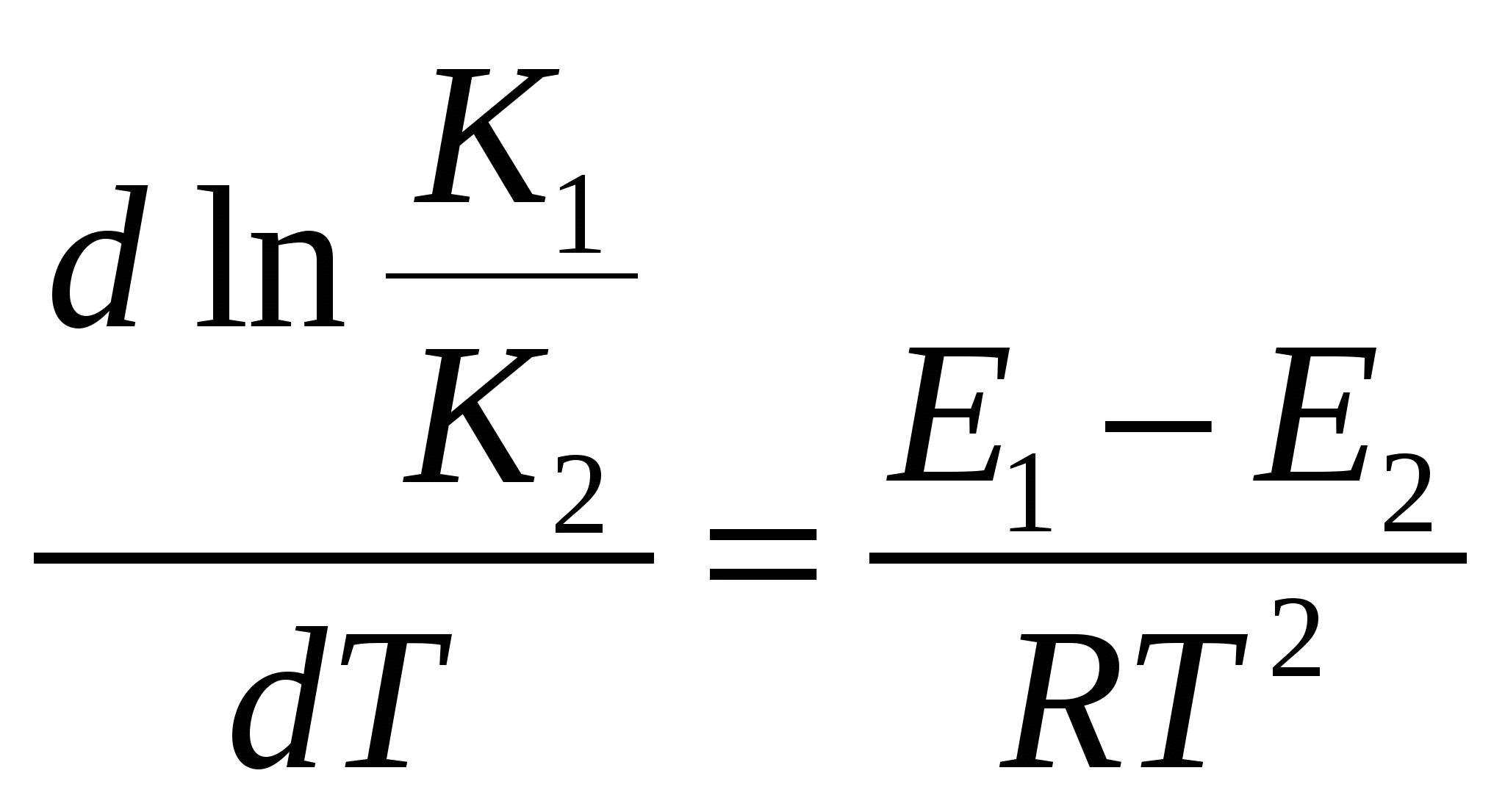|
|
Лекции по химии. Лекция 1. Литература Карпин. Курс химии. Общая химия. Соколовская, изд. Мгу 1989г
Химические реакции
 
гомогенные гетерогенные
+ поверхность (её состояния)
Лекция №8
Основы химической кинетики.
Кинетика позволяет устанавливать, с какой скоростью проходит данное химическое превращение.
Одна из главных задач – установить элементарные факторы определения реакции.
Скорость реакции количественно определяется по изменению концентрации в единицу времени, в единицу реагирующего пространства.
  Скорость Скорость
Средняя – изменение концентрации Истинная – полный дифференциал
за время  . . 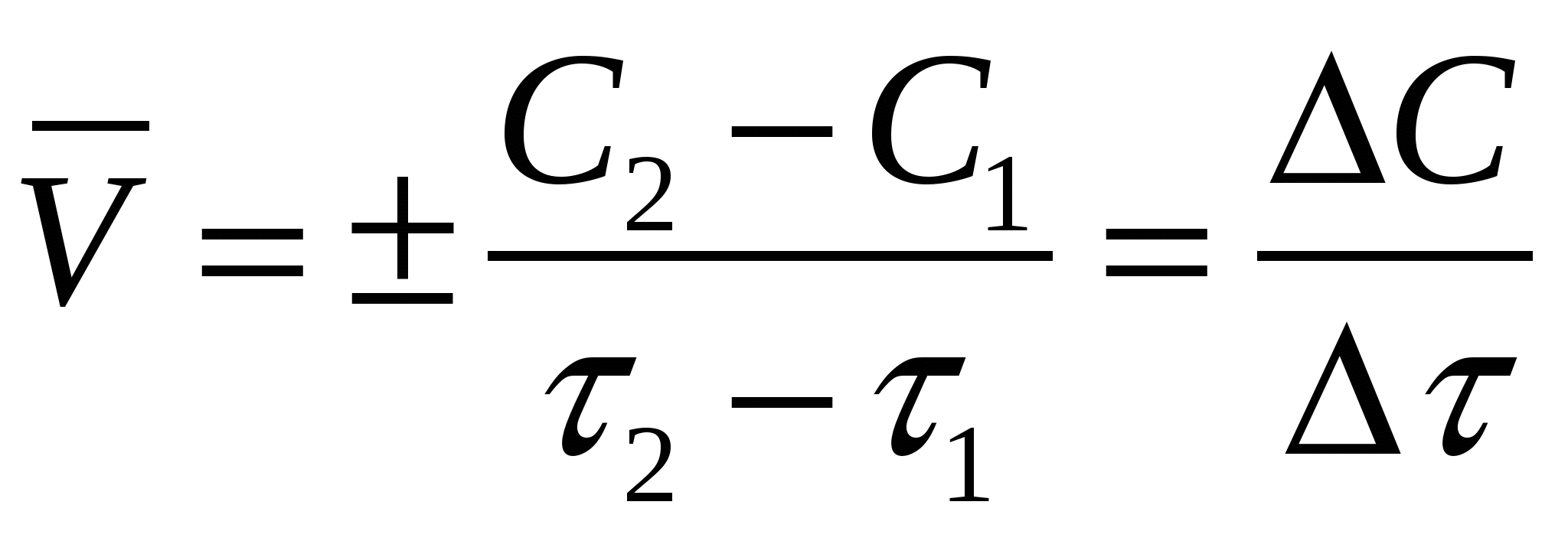 от концентрации по времени. от концентрации по времени.
На скорость гетерогенной реакции влияет состояние границы раздела.
Единица реакции пространства – S.
На скорость гомогенной реакции
Единица реакции пространства – V весь объем.
Закон действующих масс.
Действующая масса – масса вещества в ед. объема V (м3)
A+B=D
Согласно закону действующих масс, скорость реакции при постоянной температуре, пропорциональна концентрации реагирующих веществ.
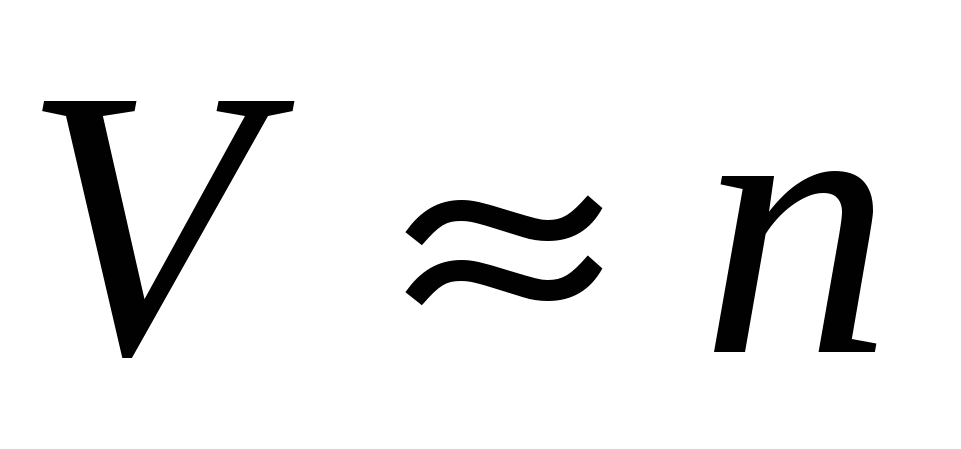 , ,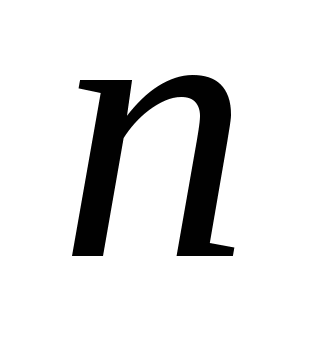 - концентрация - концентрация
А+2В = АВ2
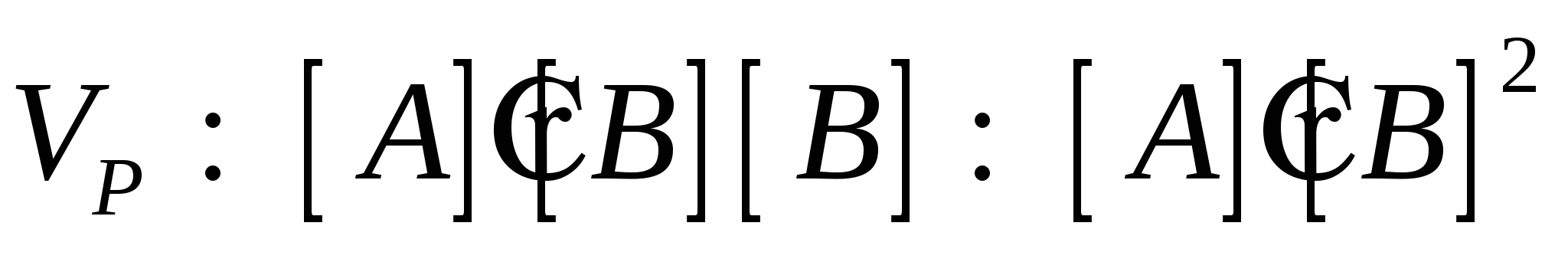 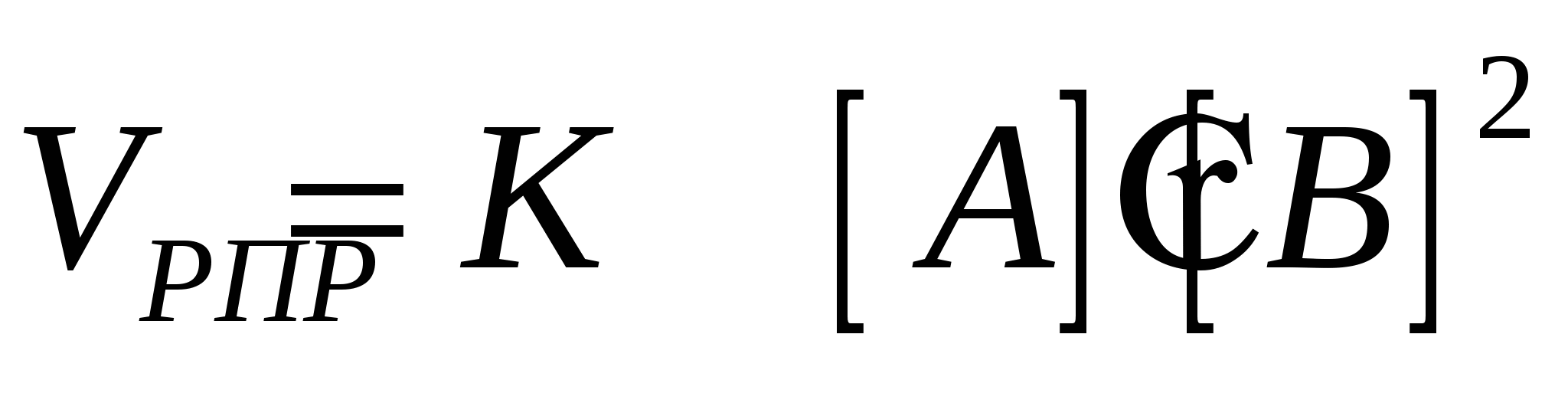
Кпр – константа прямой реакции, учитывает природу реагирующих веществ
 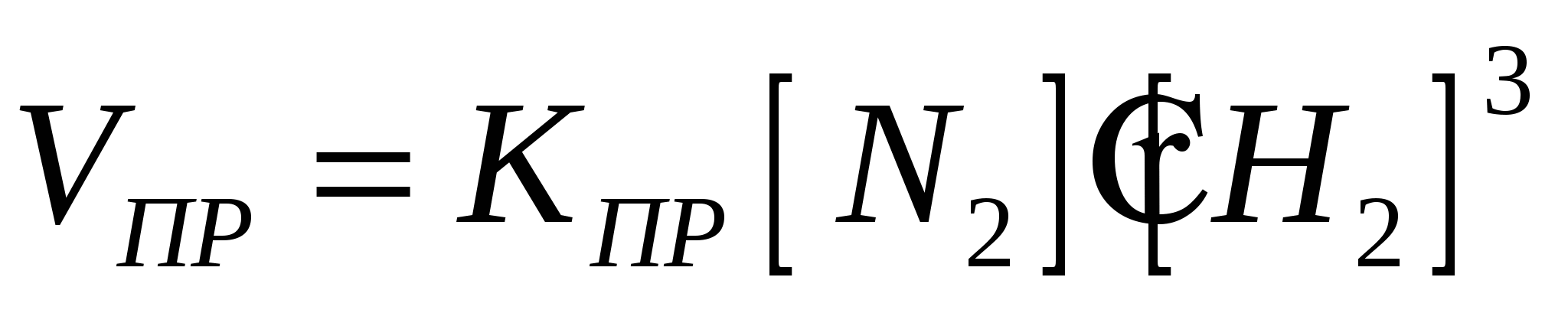 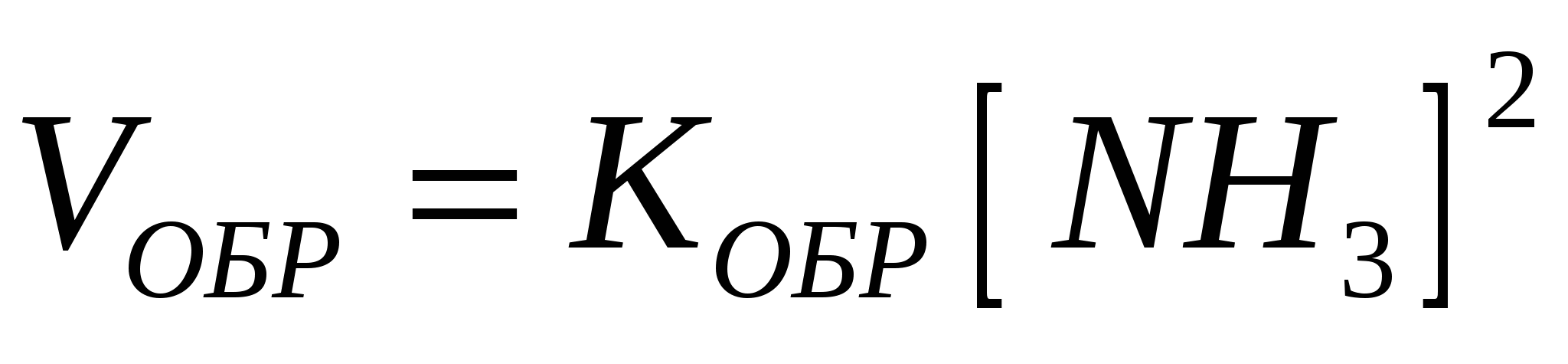
Молекулярность. Порядок реакции.
С точки зрения числа частиц реакции имеют:
Молекулярность – число частиц, одновременное соударение которых вызывает активность химического превращения.
Реакции бывают: одно- , двух- , и трехмолекулярные.
1.  одномолекулярная одномолекулярная 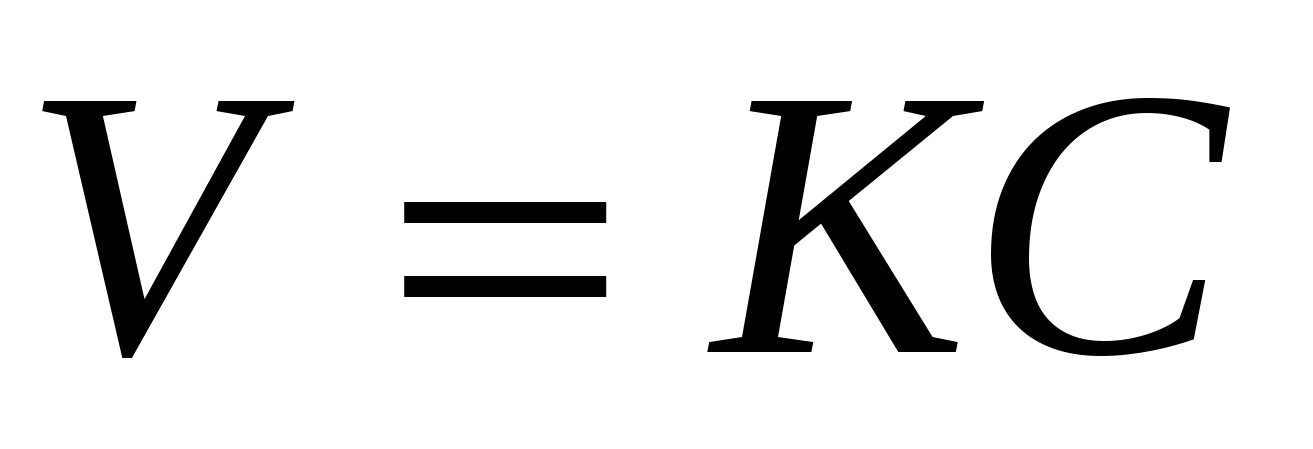 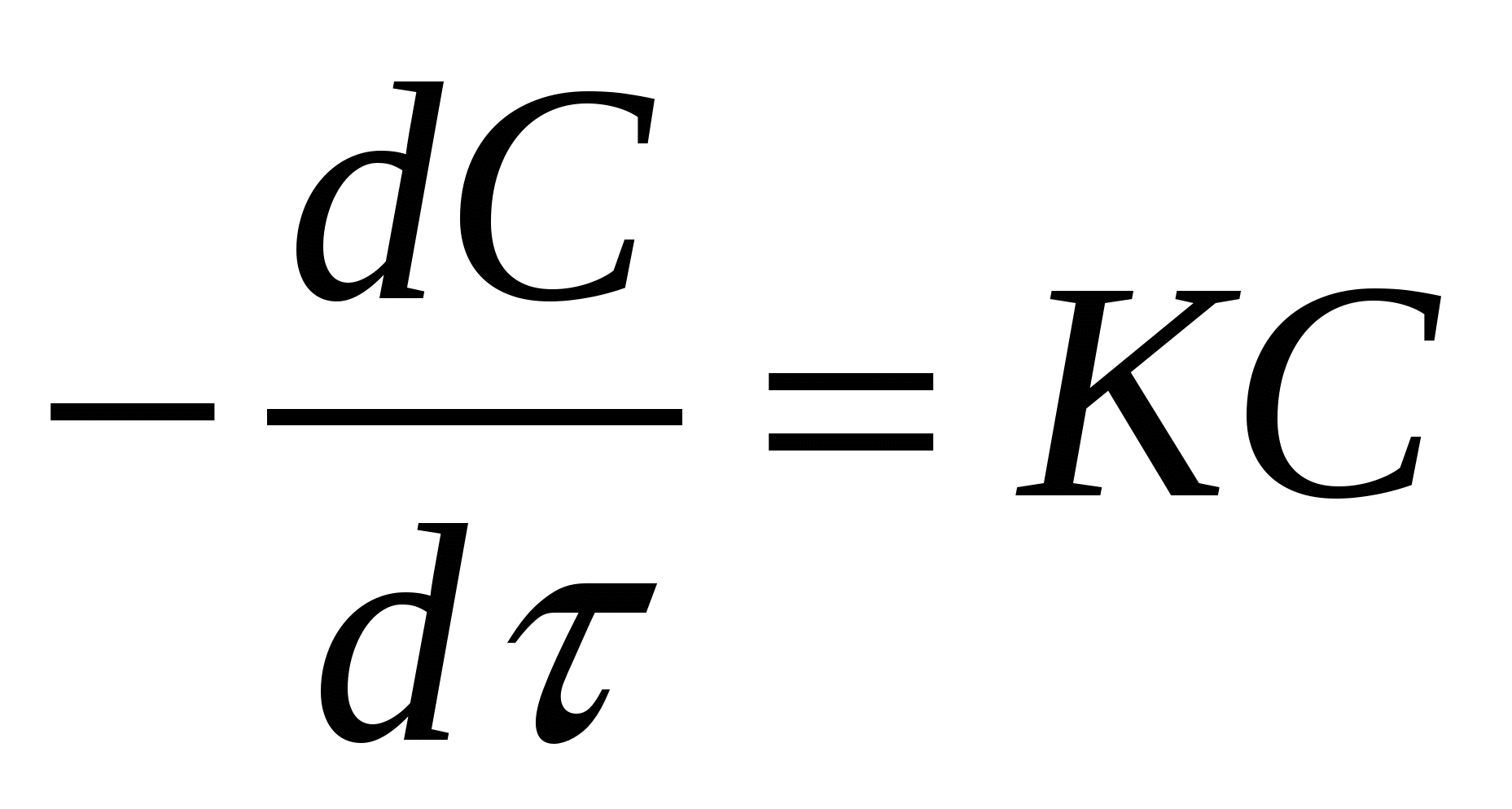 минус, т.к. скорость реакции убывает с течением времени минус, т.к. скорость реакции убывает с течением времени
2. 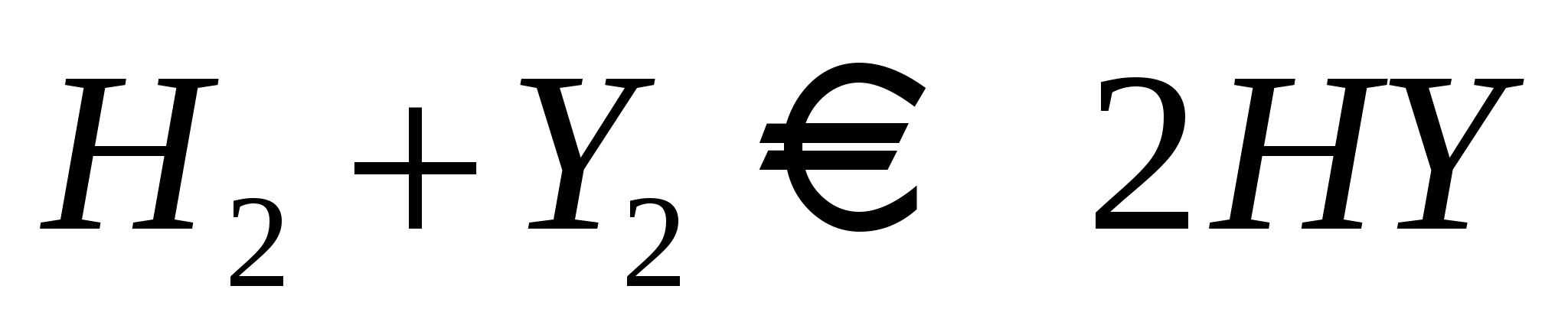 двухмолекулярная двухмолекулярная 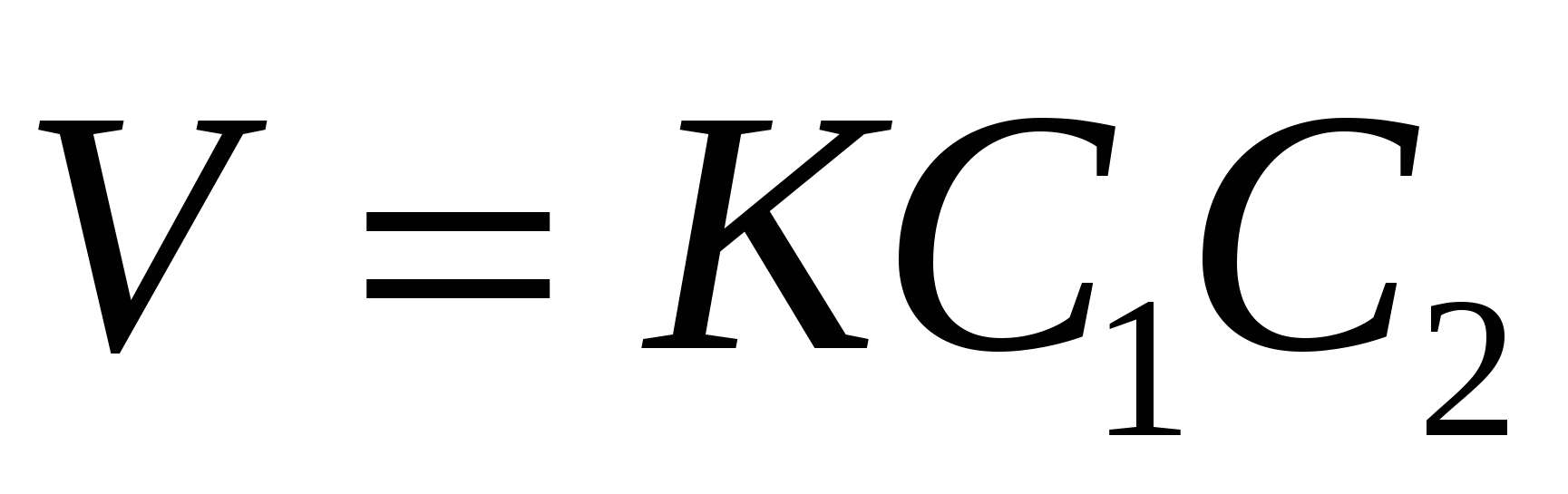 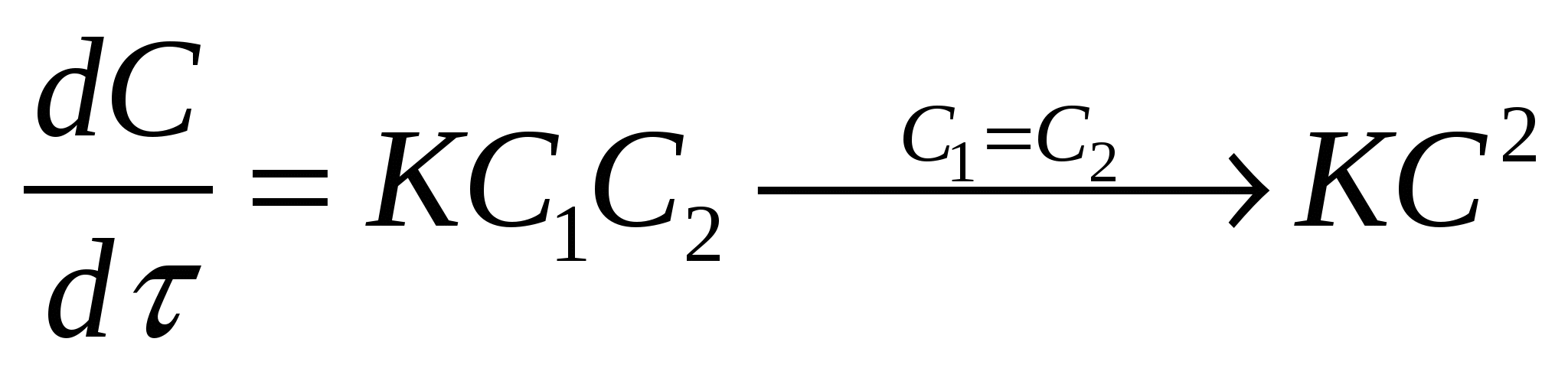
Порядок реакции: определяется как сумма показателей степеней при концентрации реагирующих веществ в законе действующих масс.
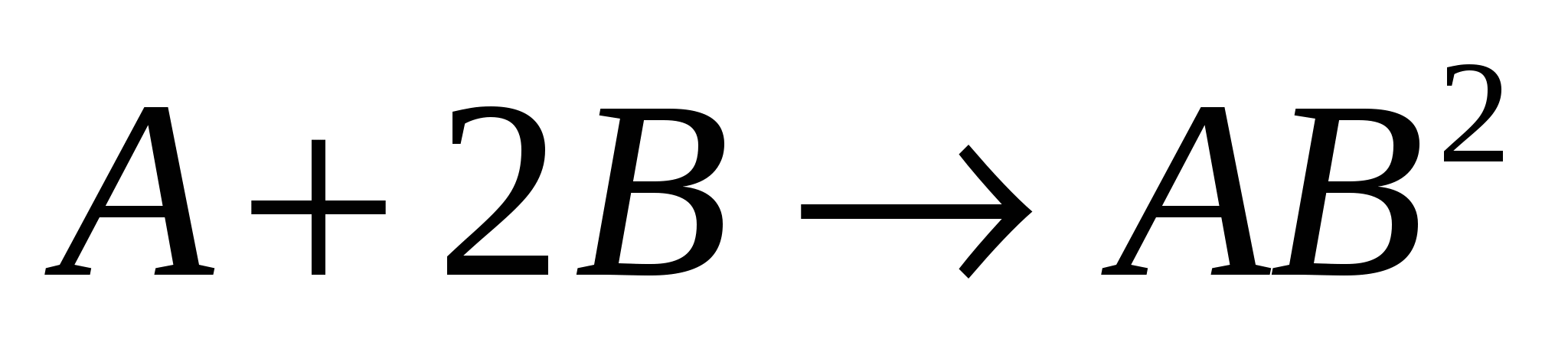 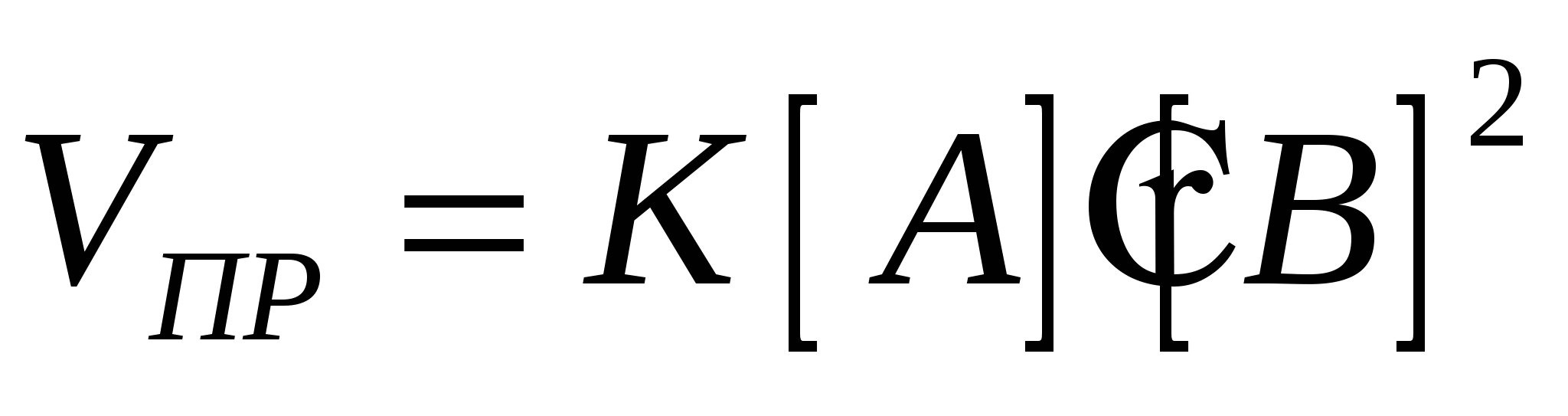
Двухмолекулярные реакции, как правило, первого порядка
Химическая реакция проходит по стадиям  трехмолекулярная реакция может быть второго порядка. трехмолекулярная реакция может быть второго порядка.
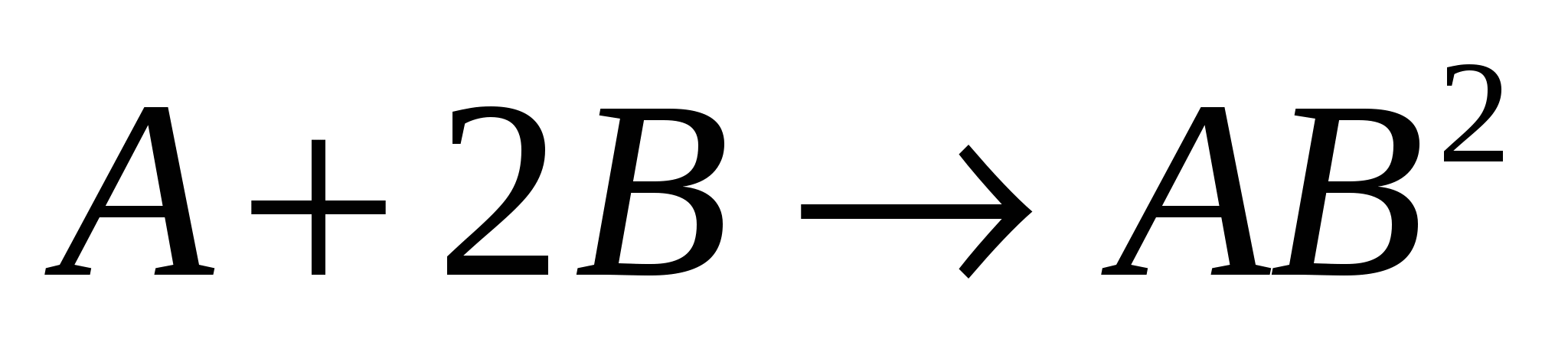
1) 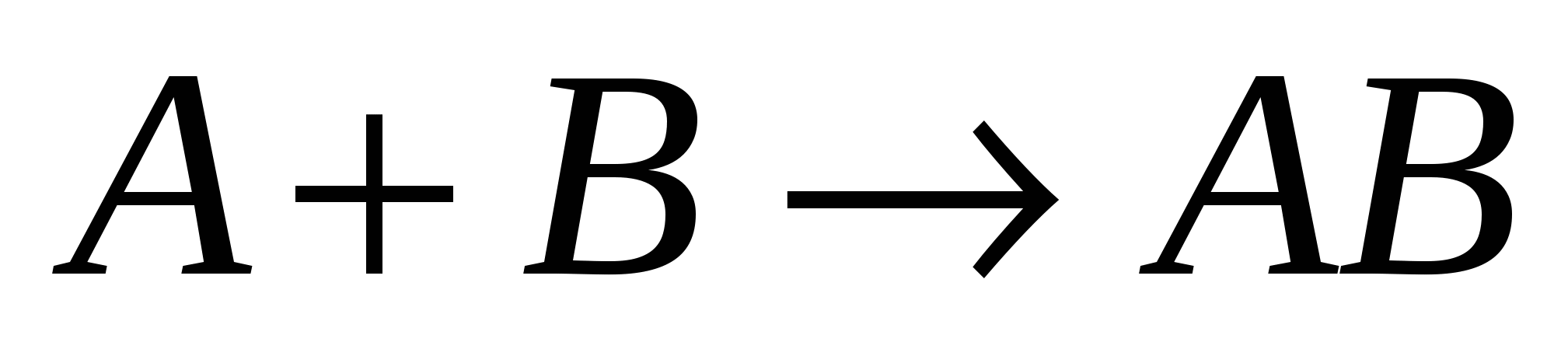 медл. медл.
2) 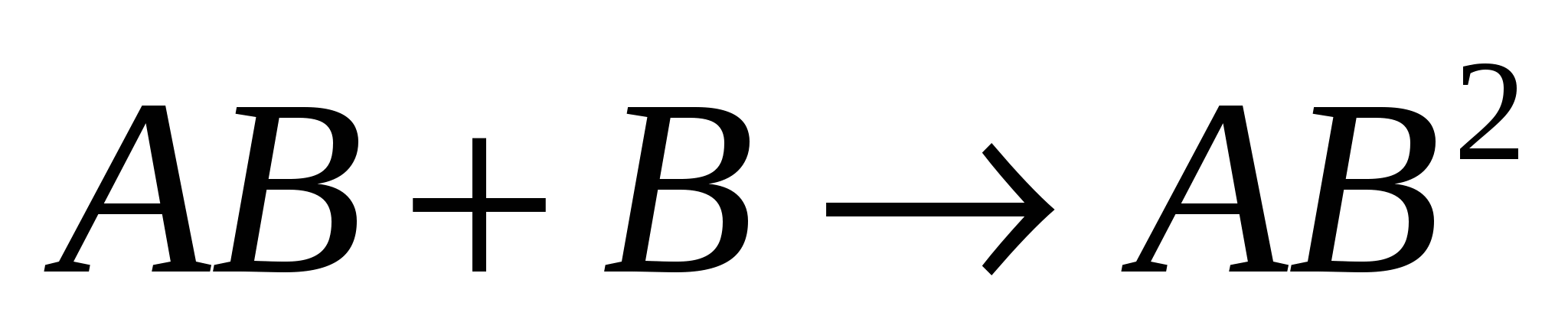 быстр. быстр.
Интегрирование дифференциальных уравнений скорости.
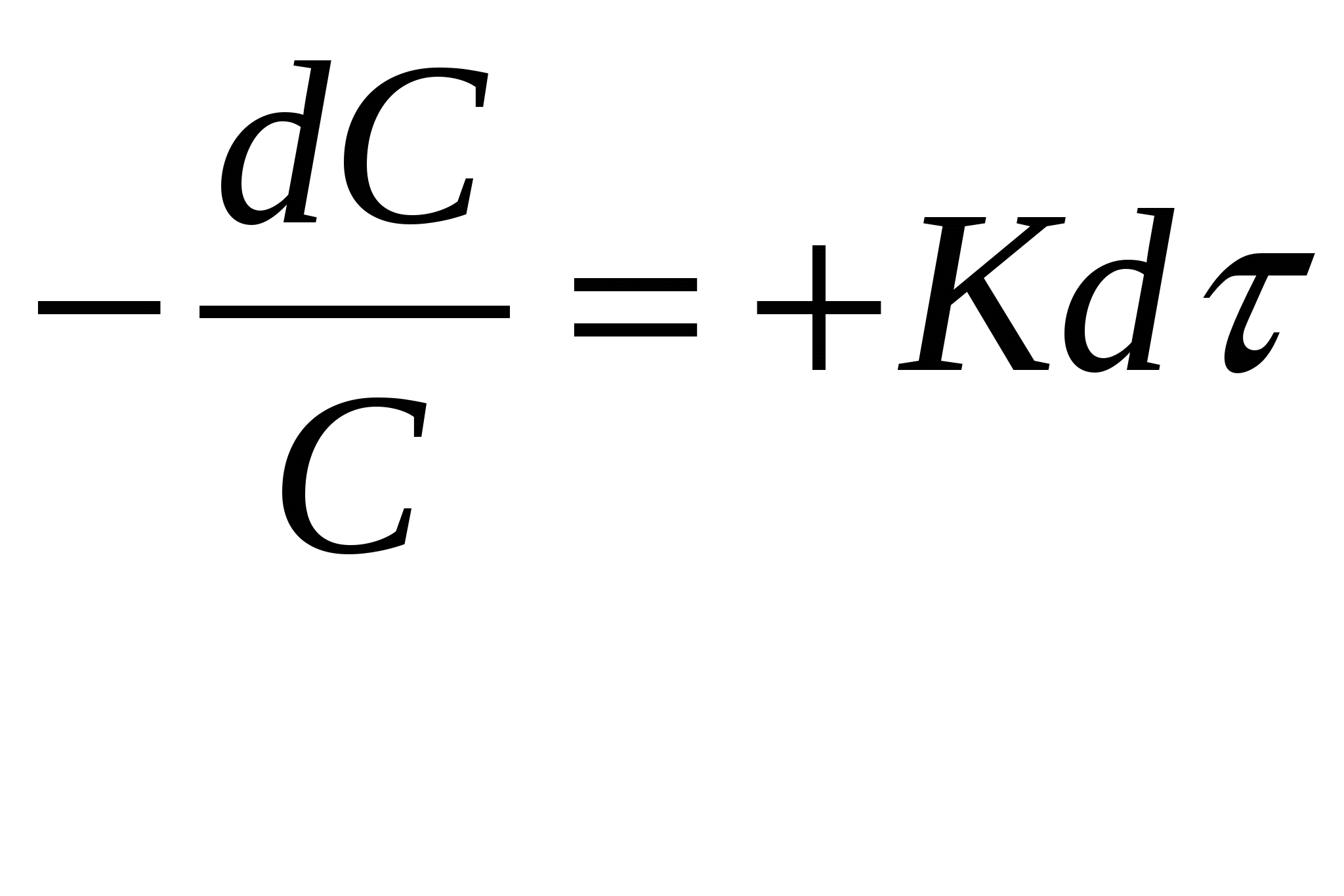 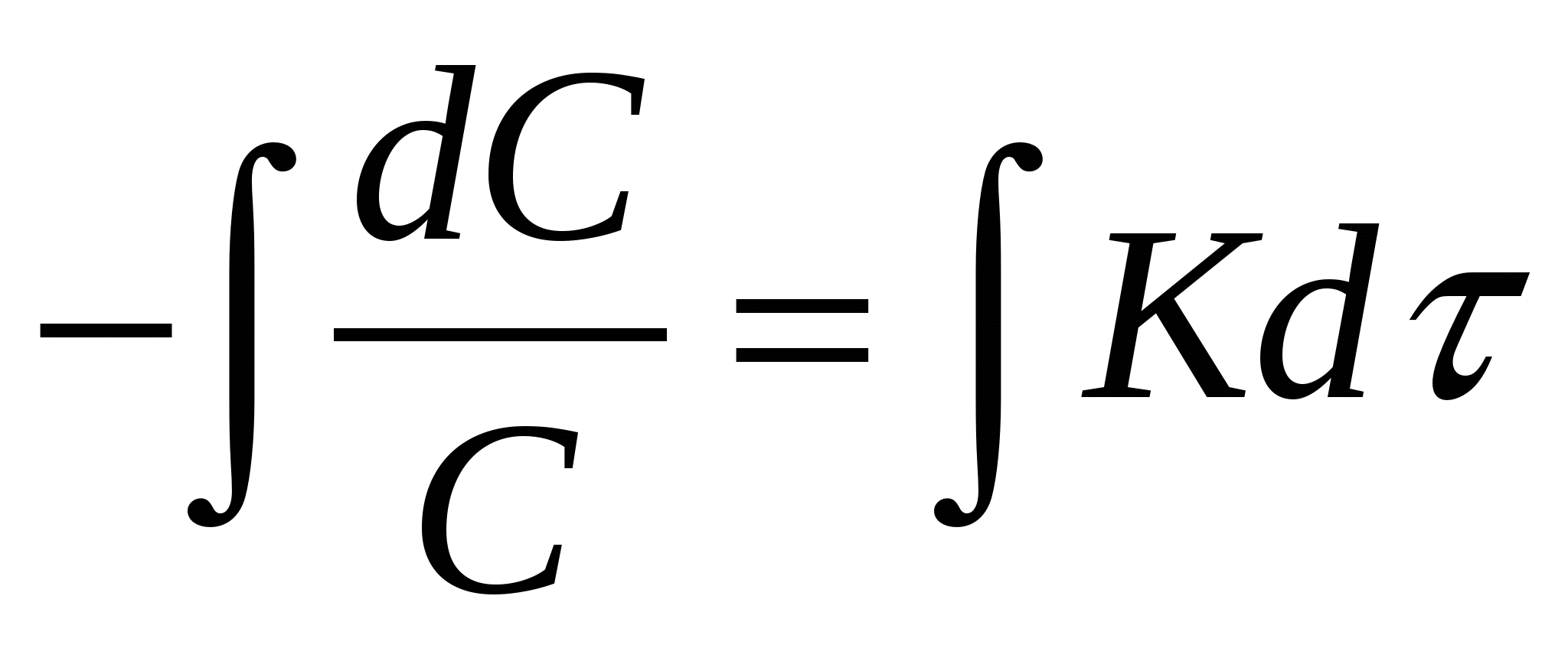 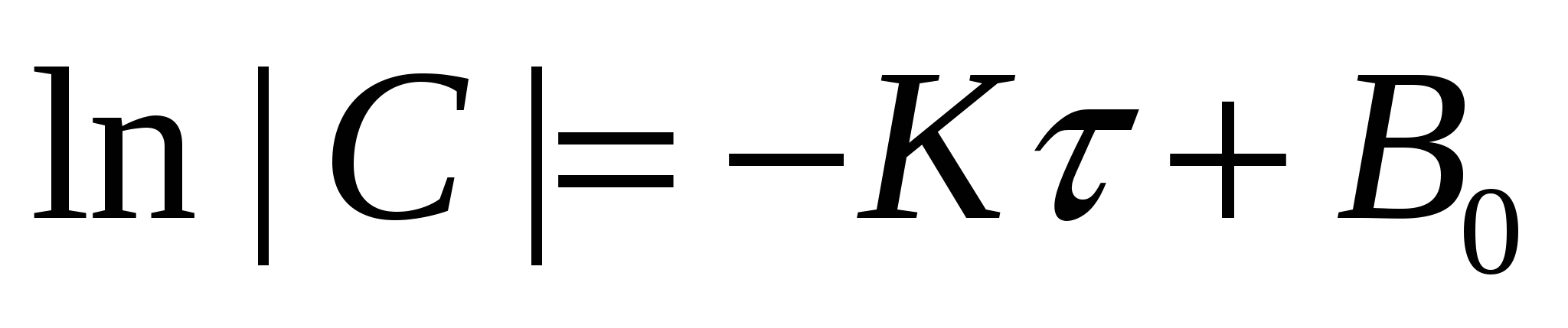 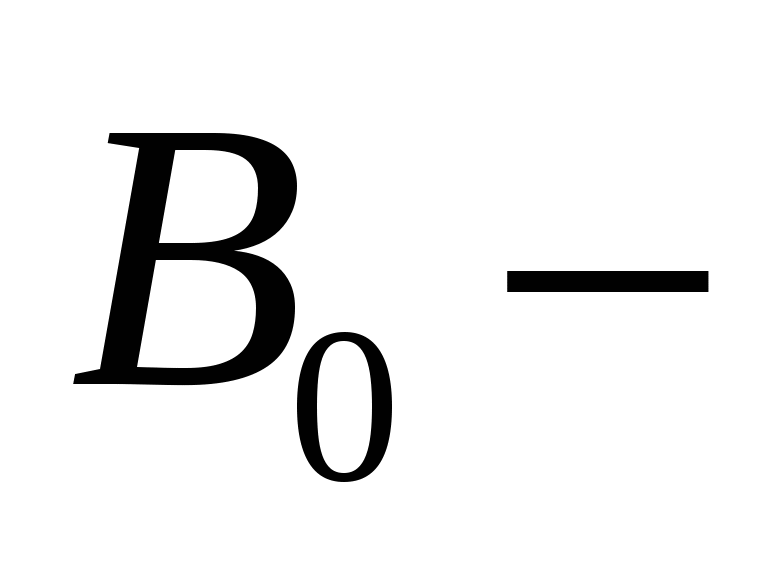 коэф-т коэф-т
рассмотрим уравнение при 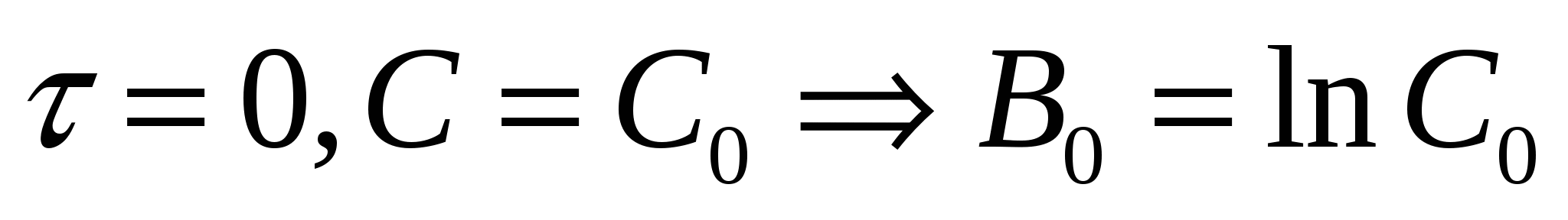 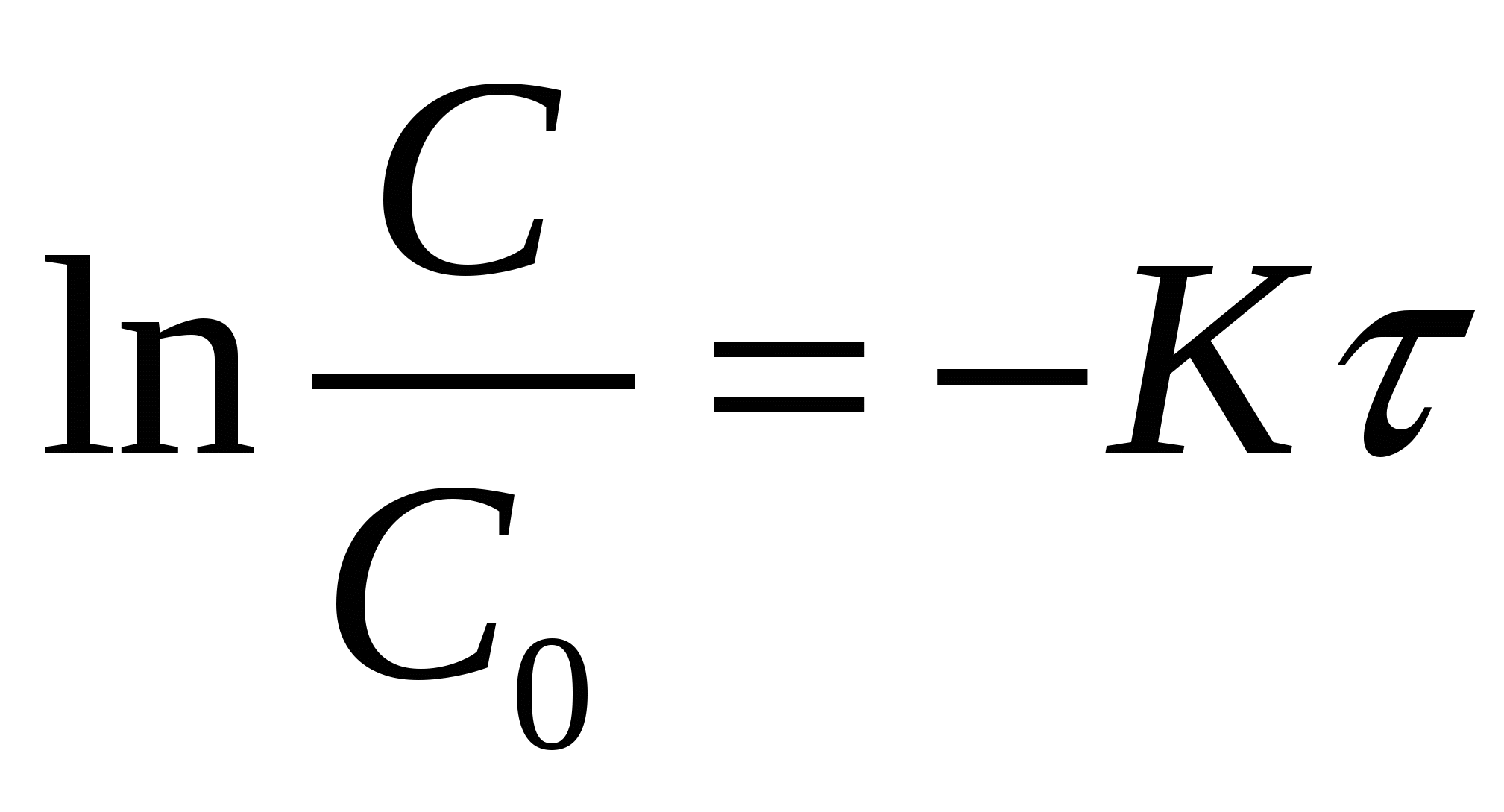 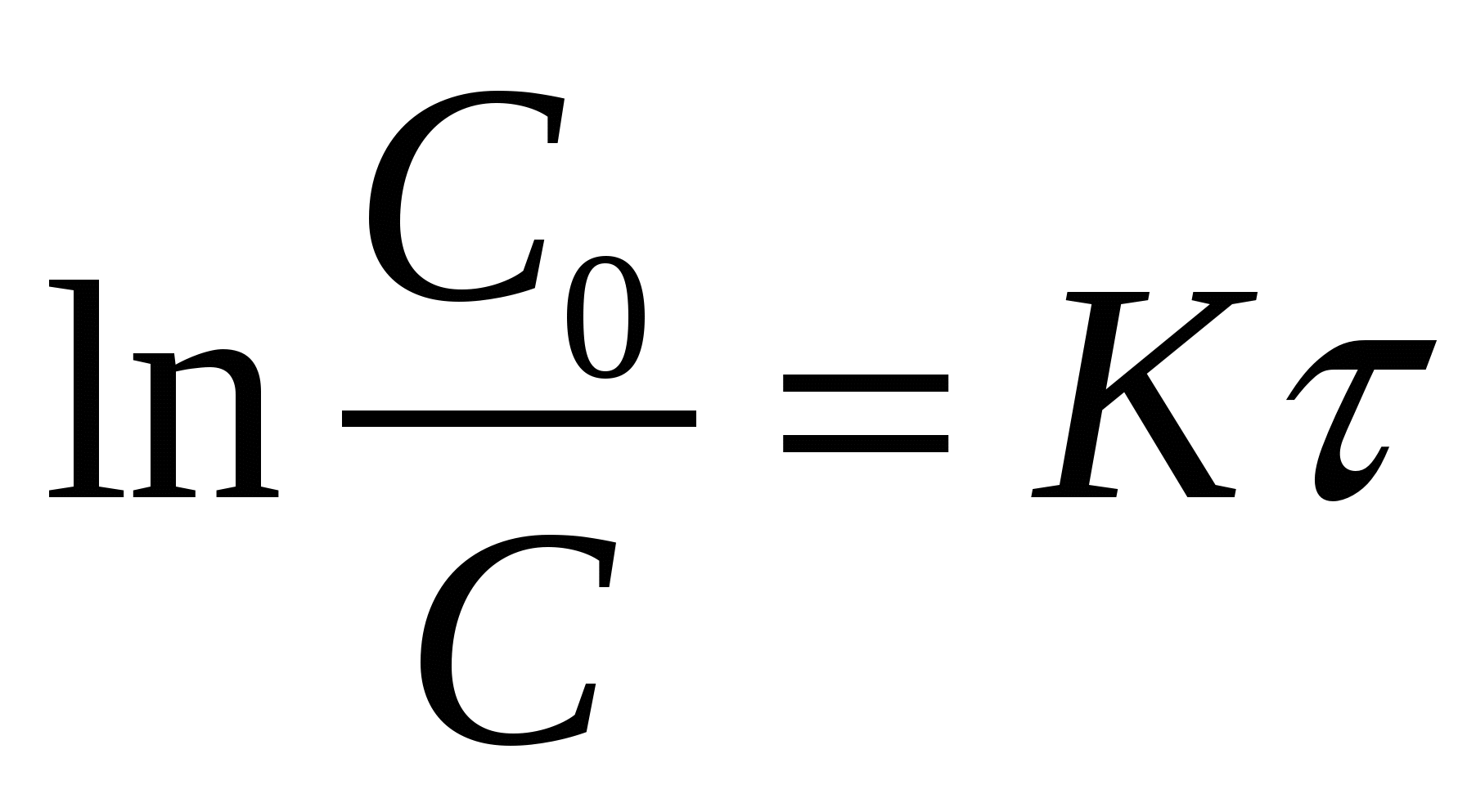 (*) (*)
 можно определить константу К одномолекулярной реакции: можно определить константу К одномолекулярной реакции:
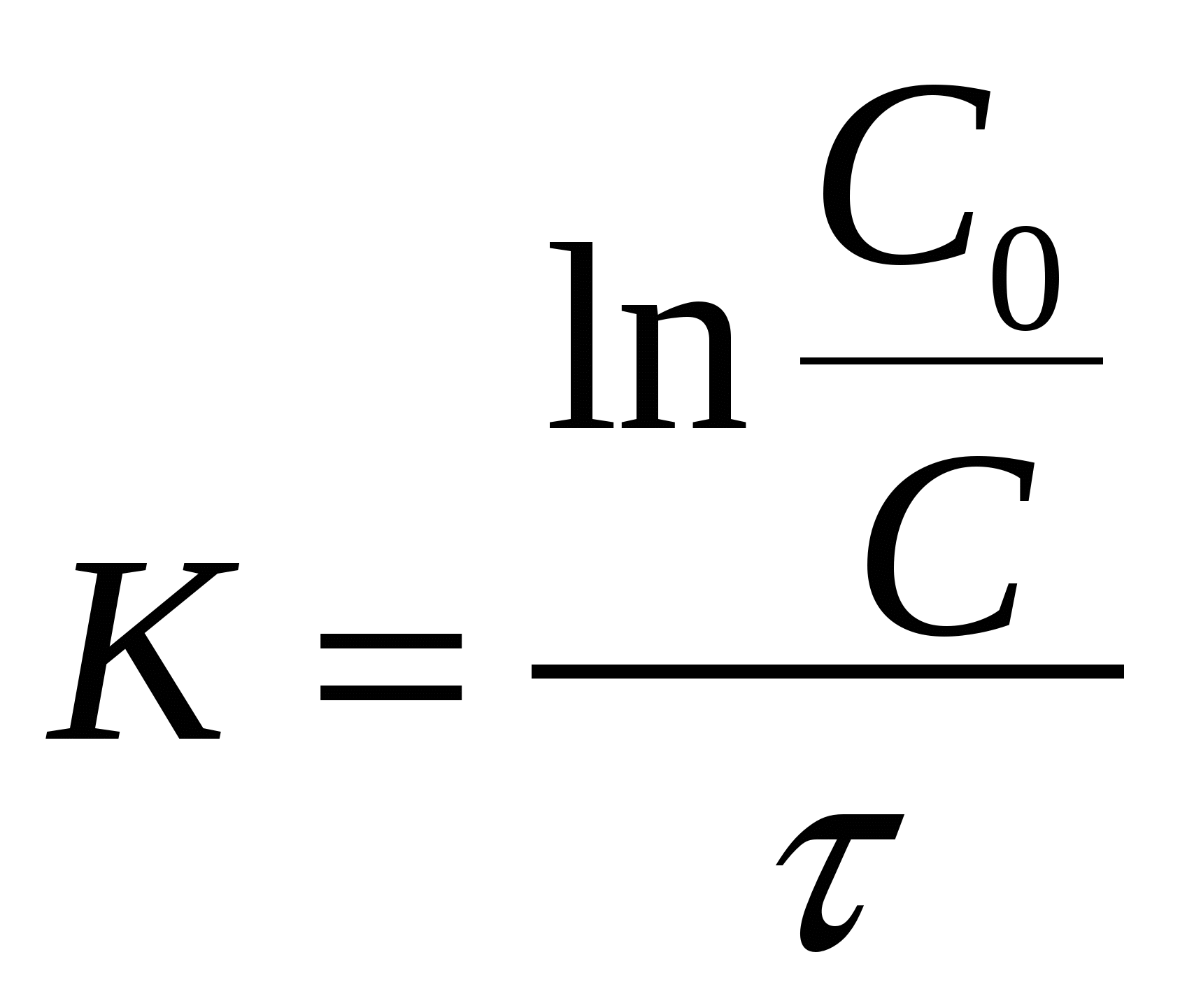 
Введем понятие периодов полураспада.
П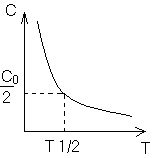 ериод полураспада. ериод полураспада.
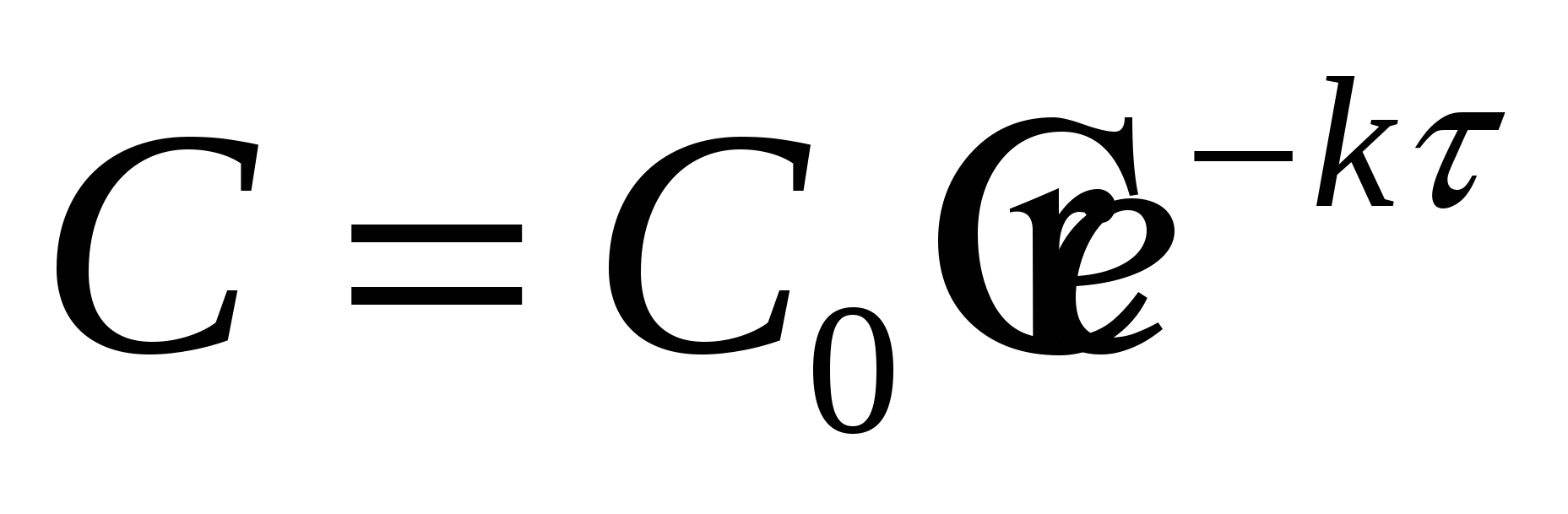 из уравнения (*) при из уравнения (*) при 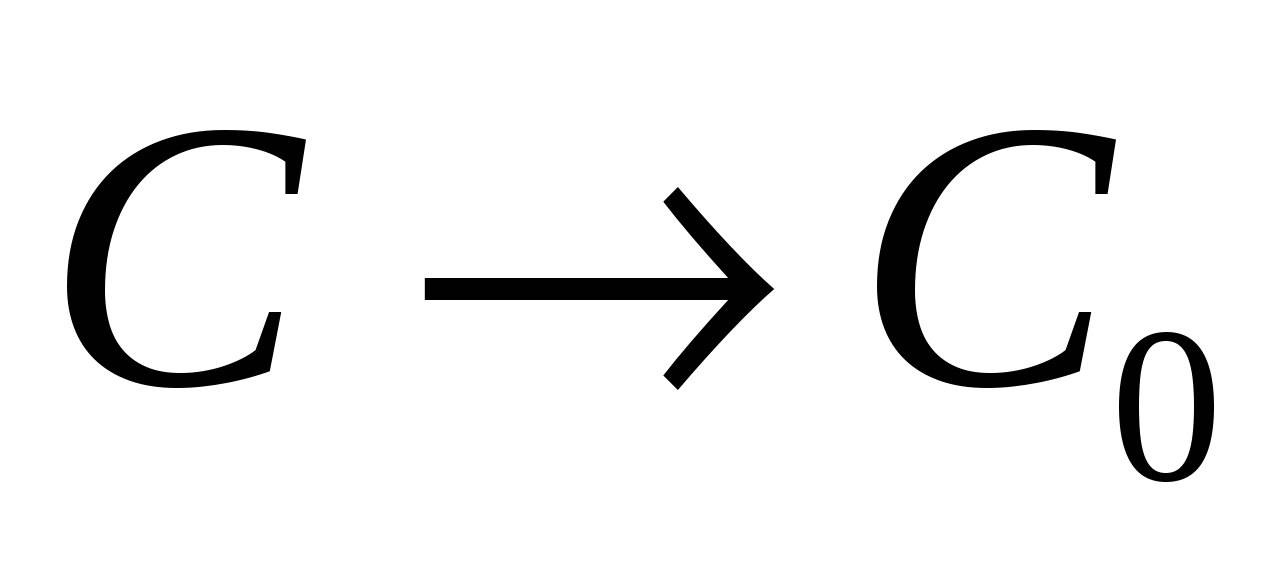
Период полураспада – время протекания реакции,
при котором концентрация веществ уменьшается в 2 раза.
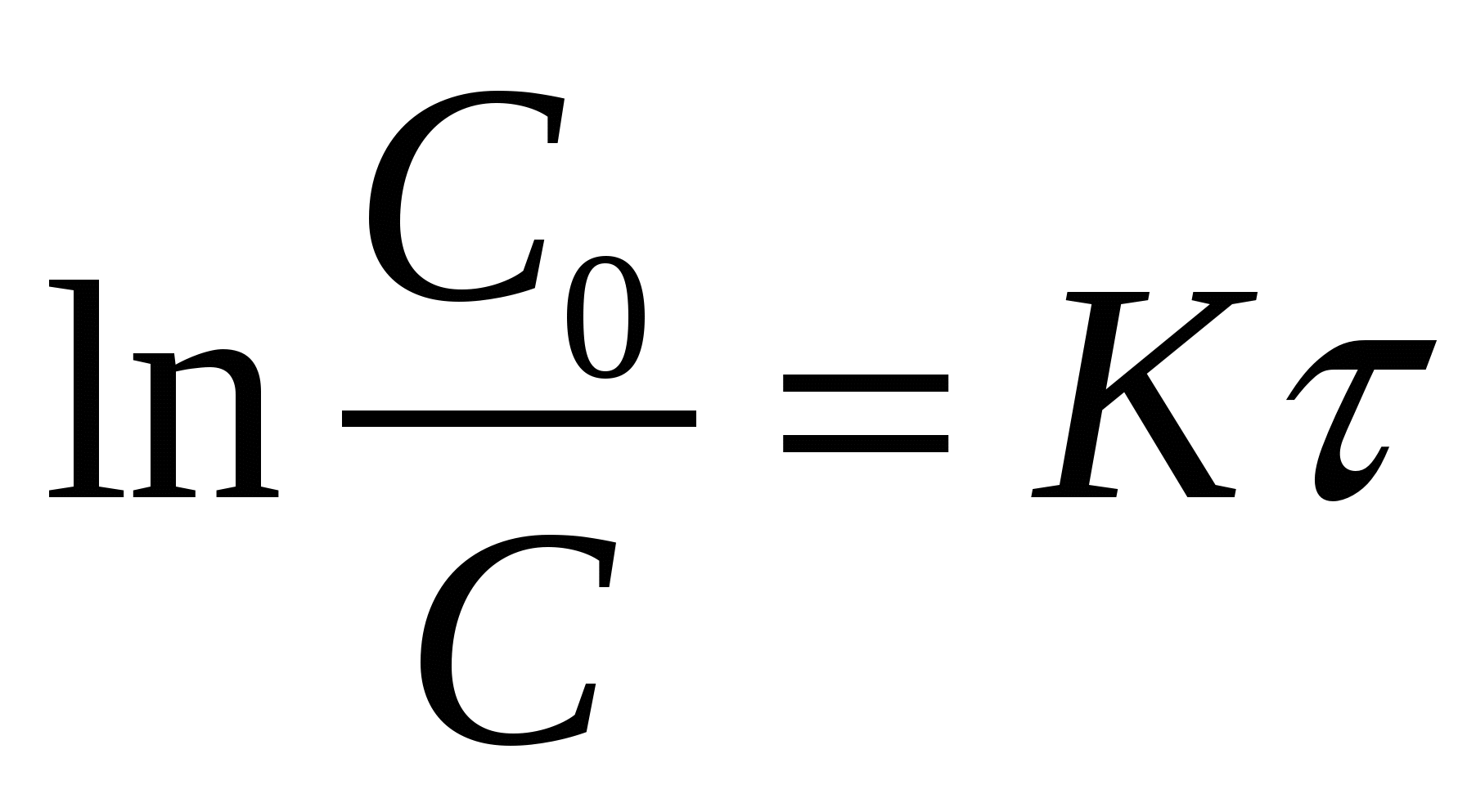  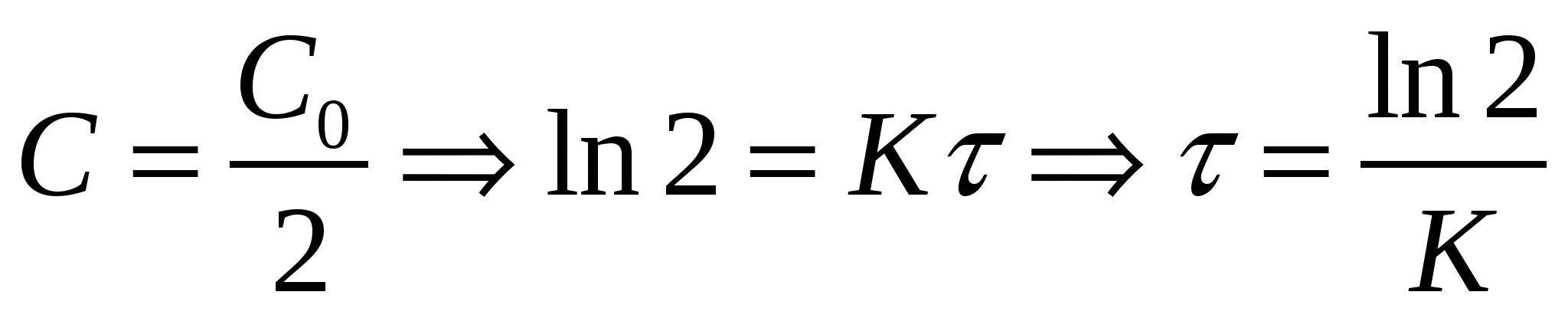 период полураспада одномолекулярной реакции. период полураспада одномолекулярной реакции.
Классификация реакций по степени сложности
изолированные
параллельные
последовательные
сопряженные
обратимые
необратимые
цепные
колебательные
* Изолированная реакция – это такая реакция в результате протекания которой получается один и тот же вполне определенный продукт
*  Параллельные реакции – могут одновременно протекать в двух и более направлениях. Параллельные реакции – могут одновременно протекать в двух и более направлениях.  обычн. нагрев обычн. нагрев
  V1 C+D VN=V1+V2 V1 C+D VN=V1+V2 
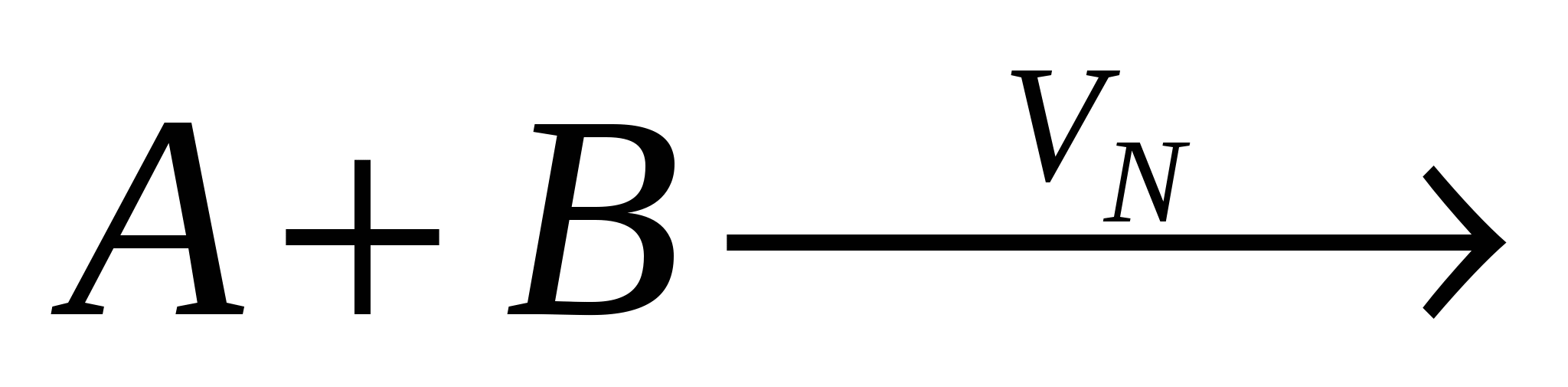  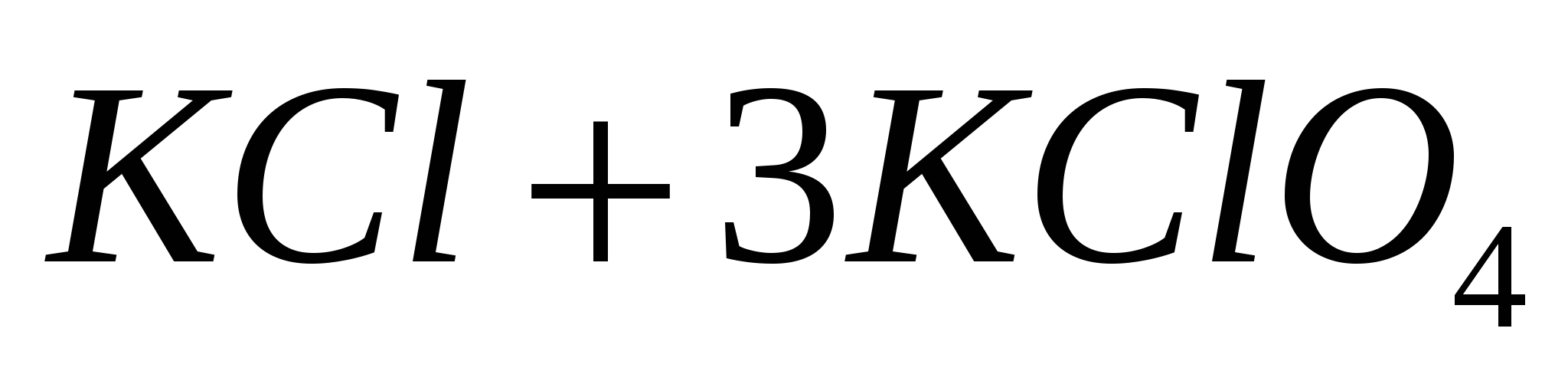 медл. Нагрев медл. Нагрев
 V2 E+F V2 E+F
* Сопряженные реакции – группа реакций, в которых одна реакция индуцирует другую
*  - последовательная реакция. Реакции идут одна за другой. - последовательная реакция. Реакции идут одна за другой.
* Обратимые, необратимые – могут протекать в одном и другом направлении.
Е сли сли 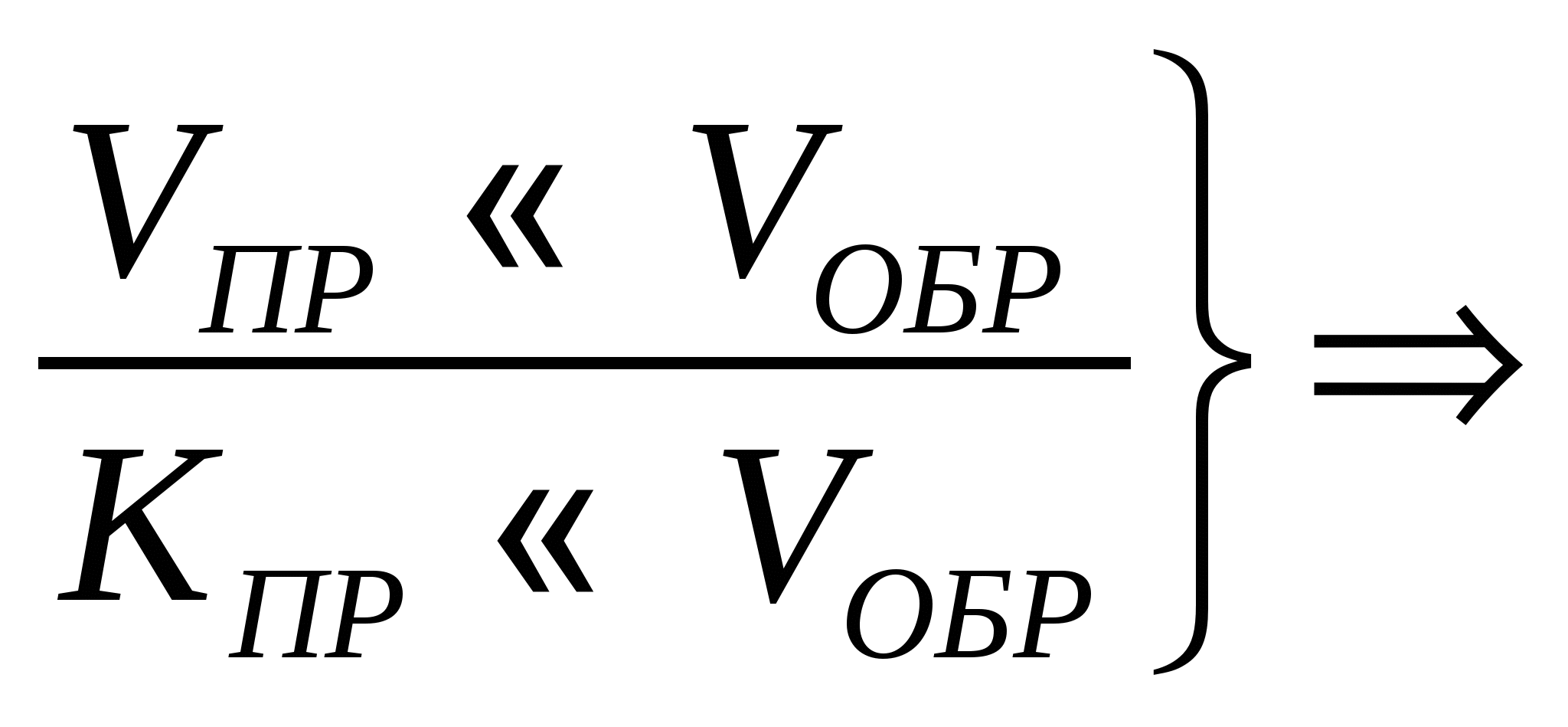 реакция необратимая реакция необратимая
Связь константы равновесия и константы скорости
КР – равновесия КС – скорости
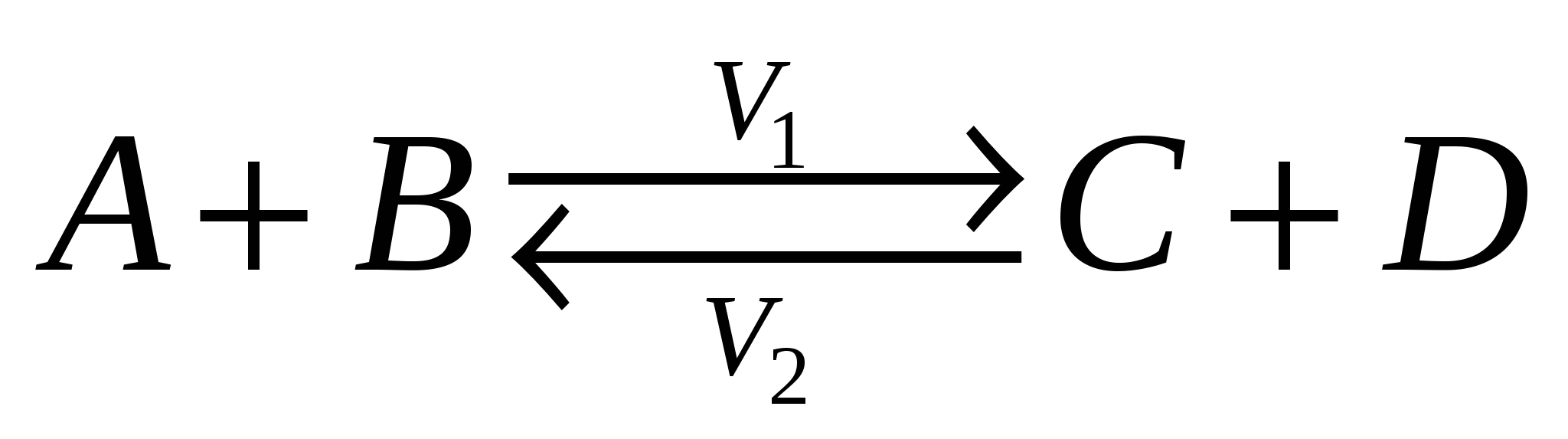 V1 – скорость прямой реакции V2 – обратной V1 – скорость прямой реакции V2 – обратной
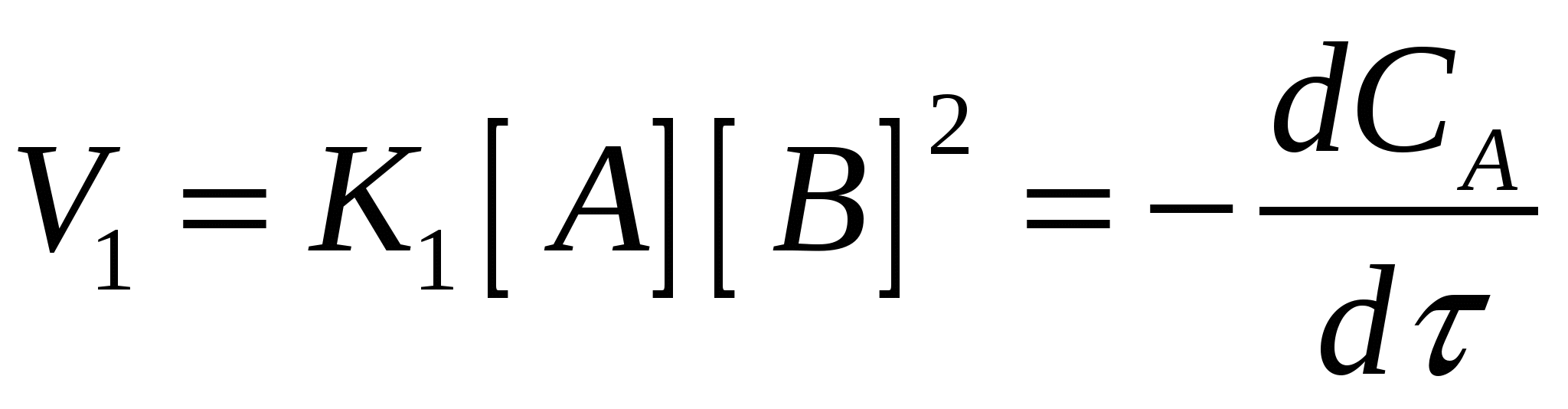 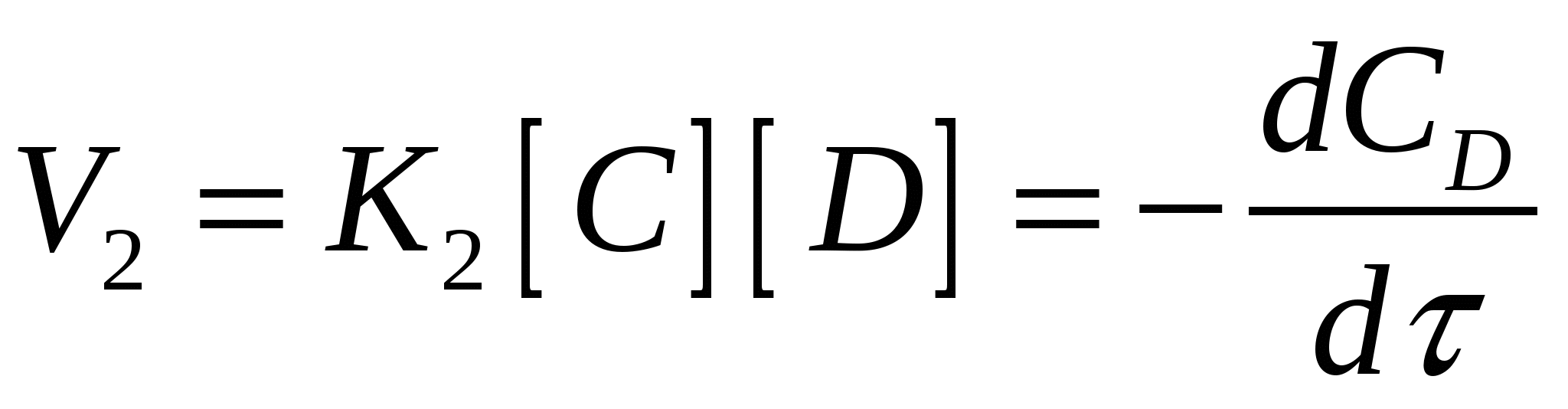
Рассмотрим случай V1=V2 (подвижное равновесие)
С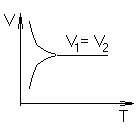 хема такого процесса хема такого процесса 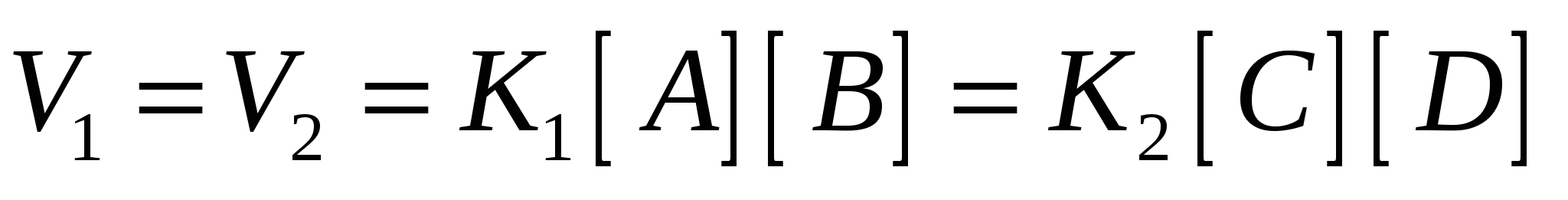
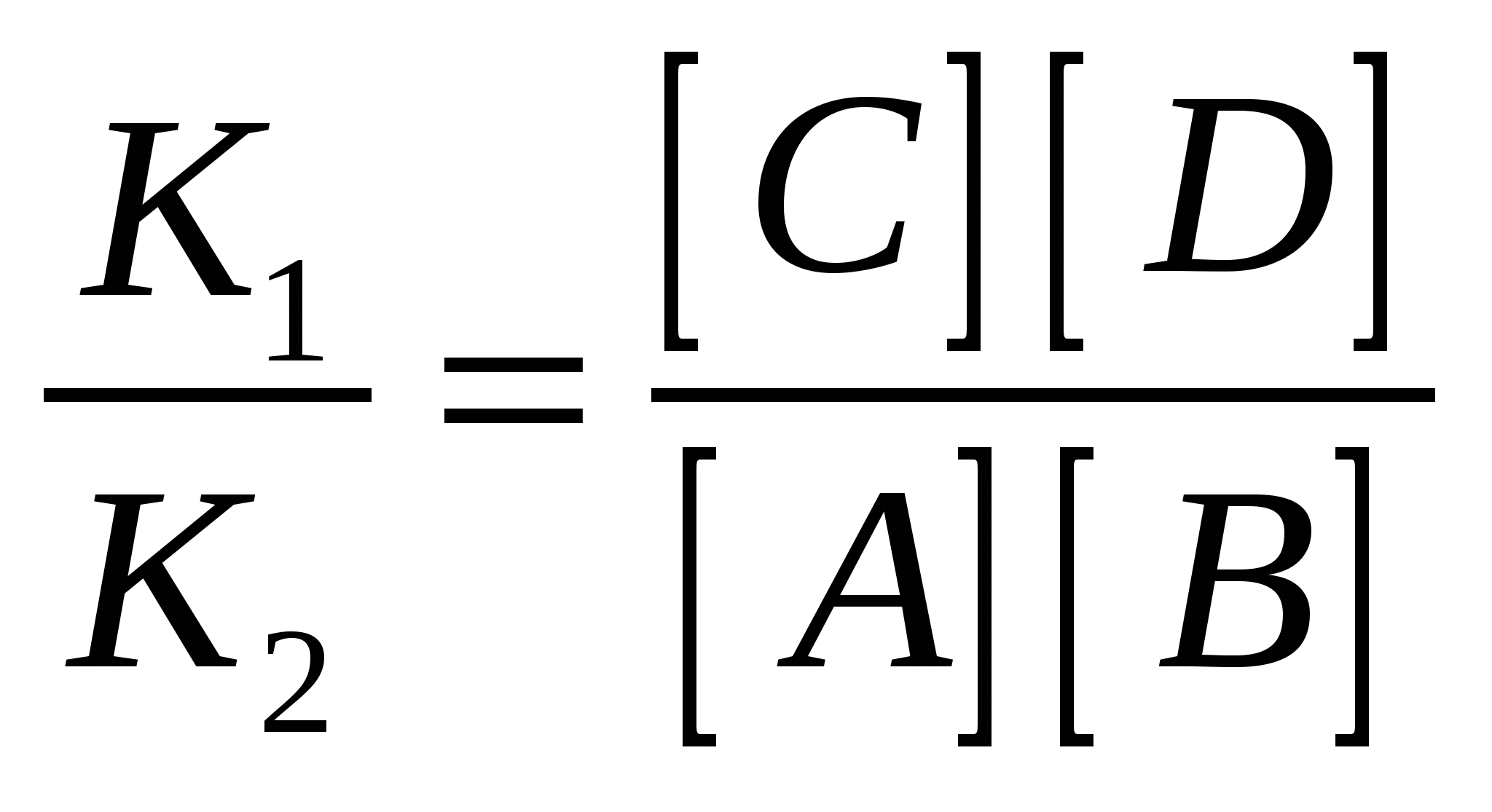 константа равновесия константа равновесия 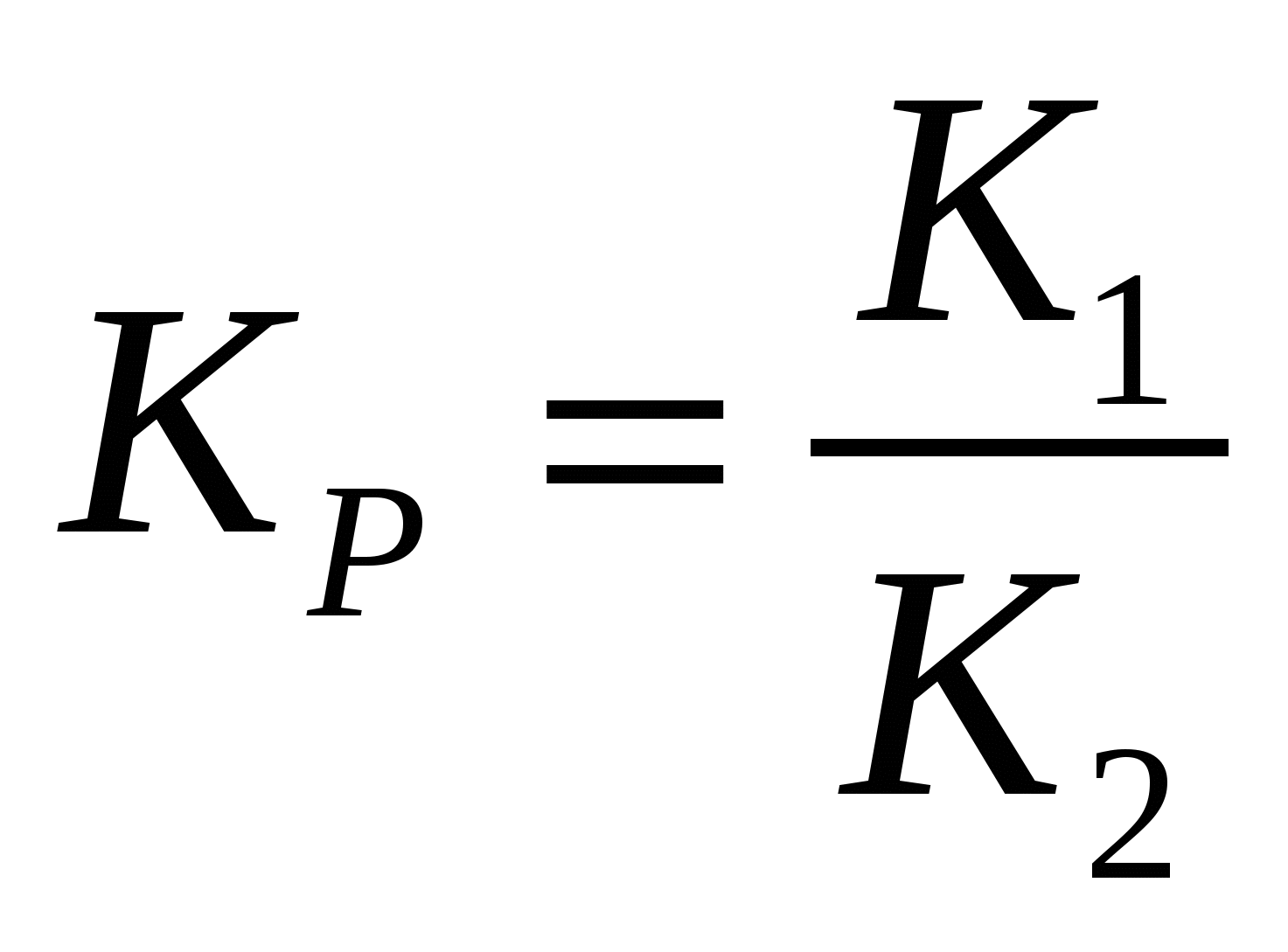
Константа равновесия химической реакции равна
отношению констант скорости прямой и обратной реакций
Зависимость скорости химической реакции от температуры.
Правило Вант-Гоффа
.
.
По этому правилу, при увеличении температуры на 10 градусов, скорость химической реакции возрастает в 2-4 раза
Температурный коэффициент: 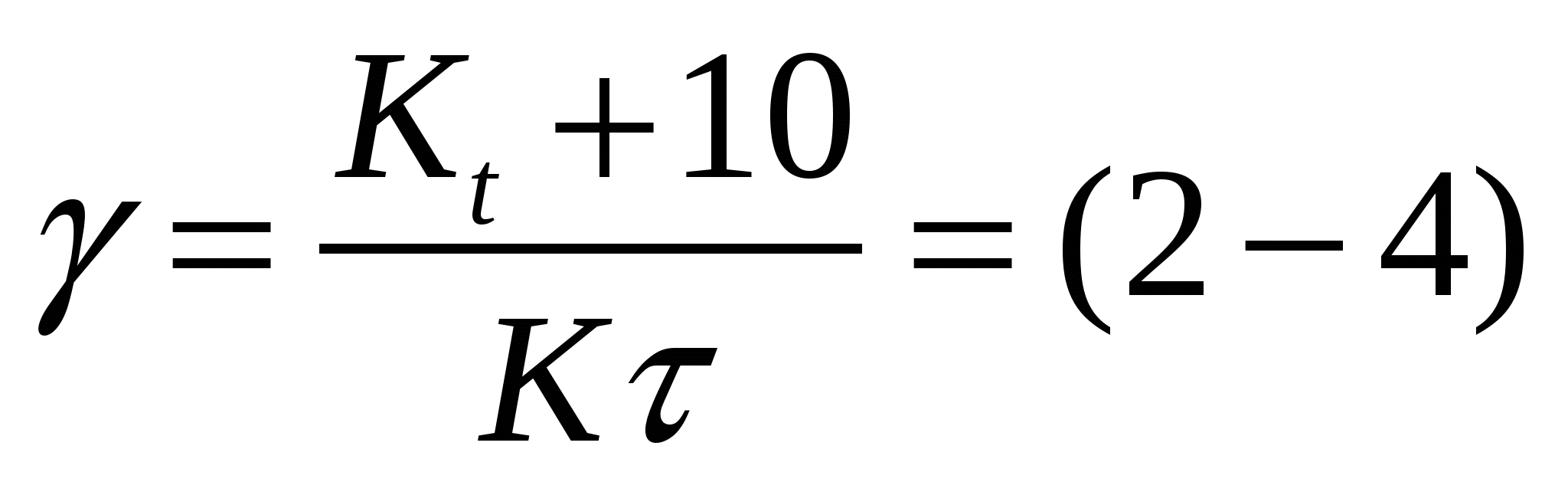 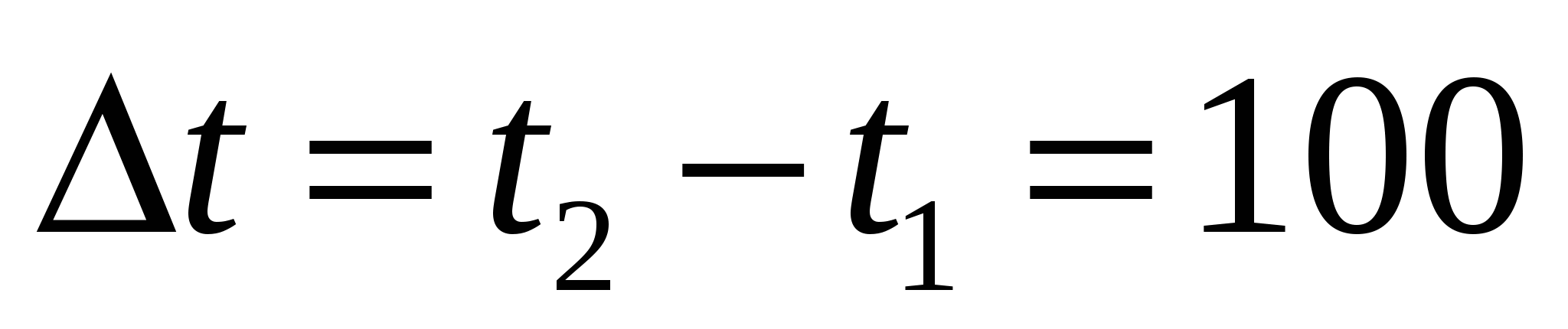
V –объем системы не меняется, тогда 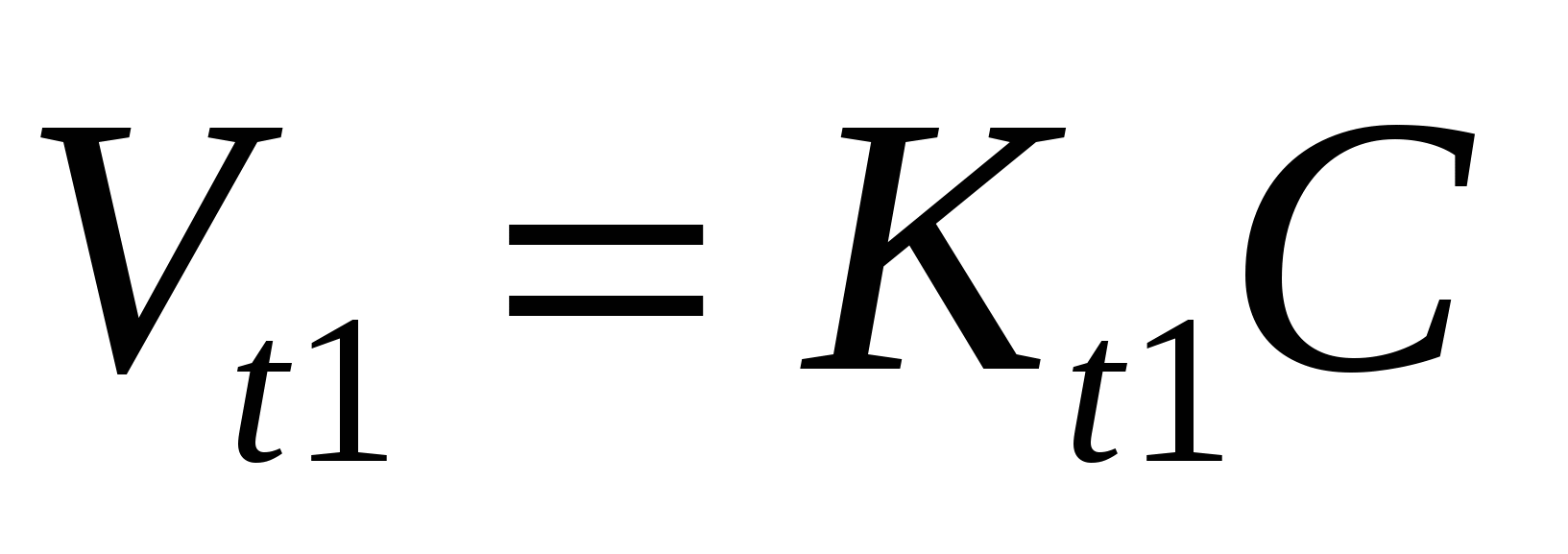 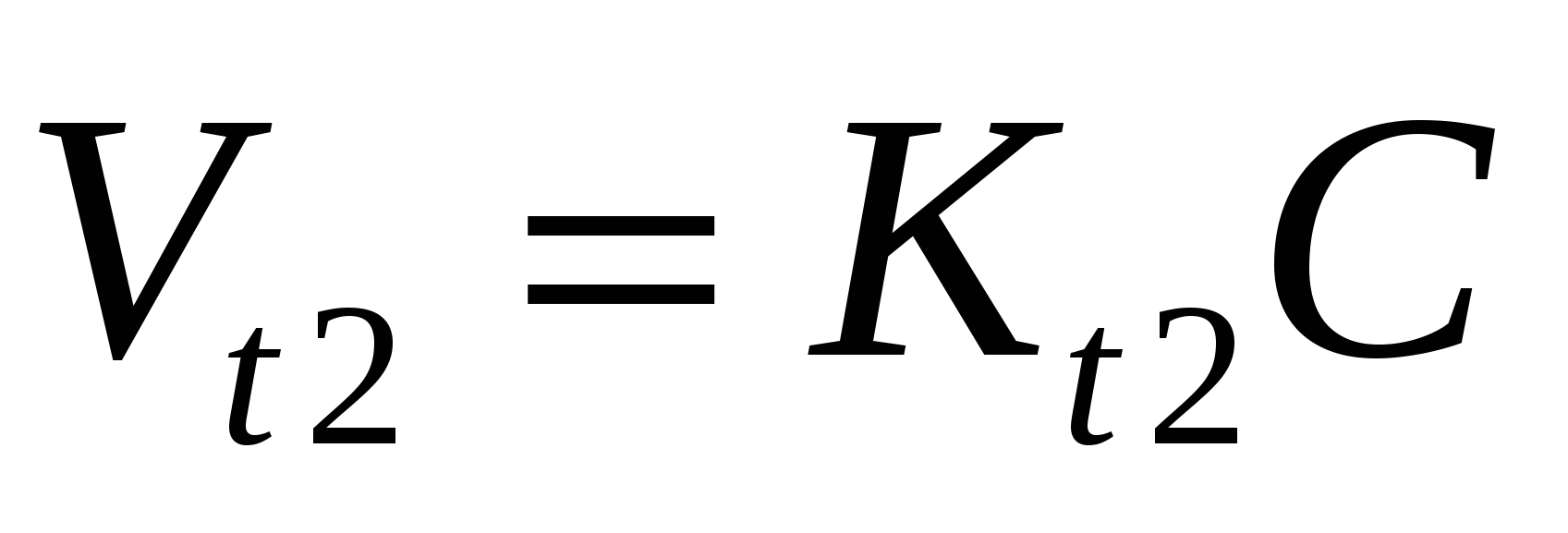
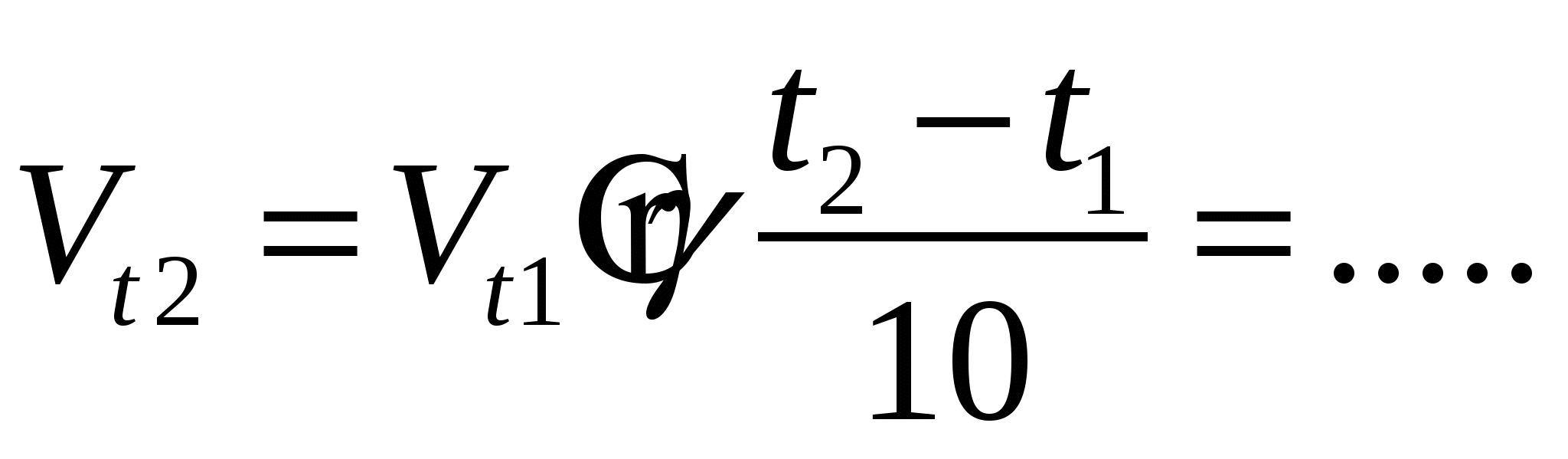
При увеличении температуры, резко возрастает число активных молекул, которые обладают избыточной энергией  скорость реакции увеличивается. скорость реакции увеличивается.
Согласно …….. уравнению ……… константа скорости записывается:
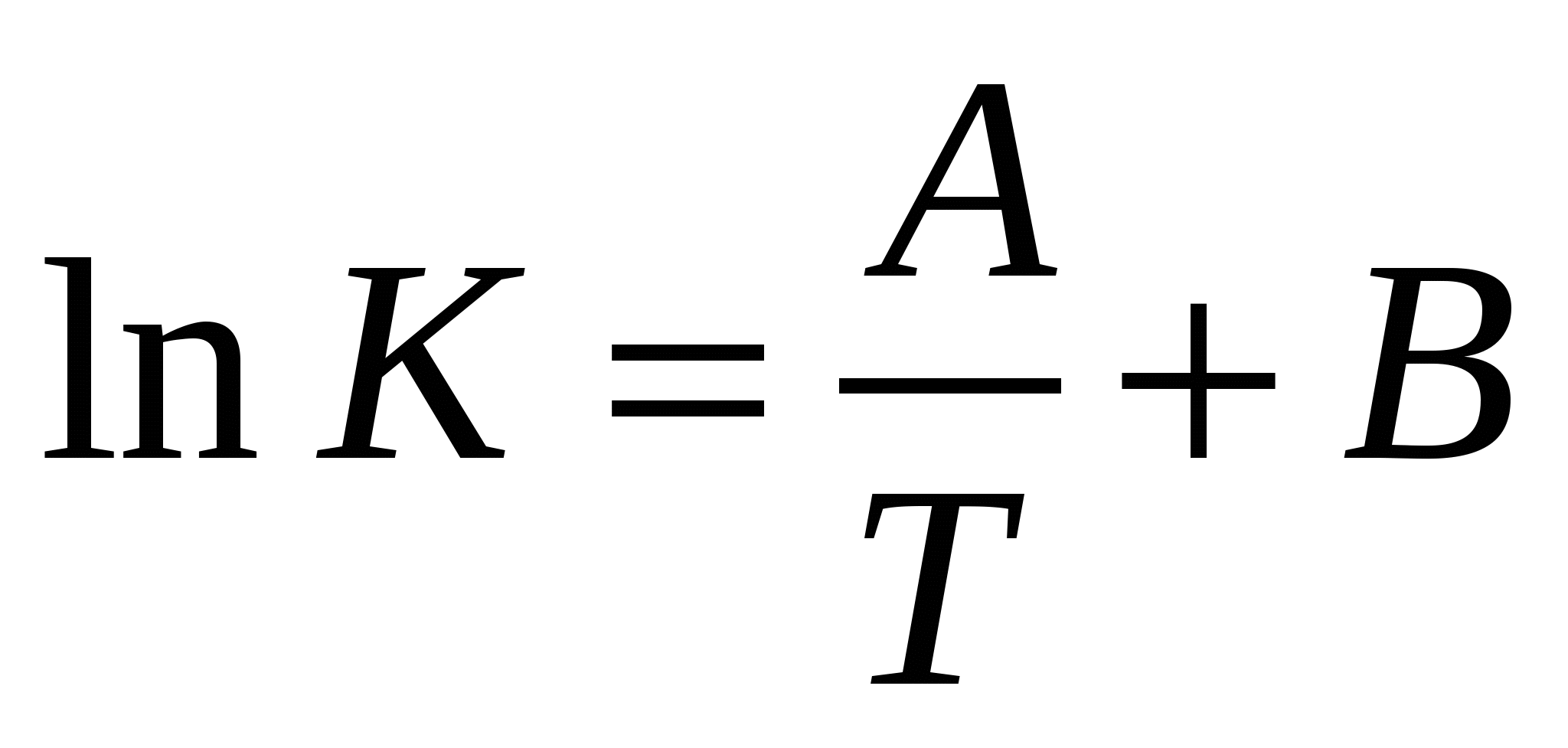 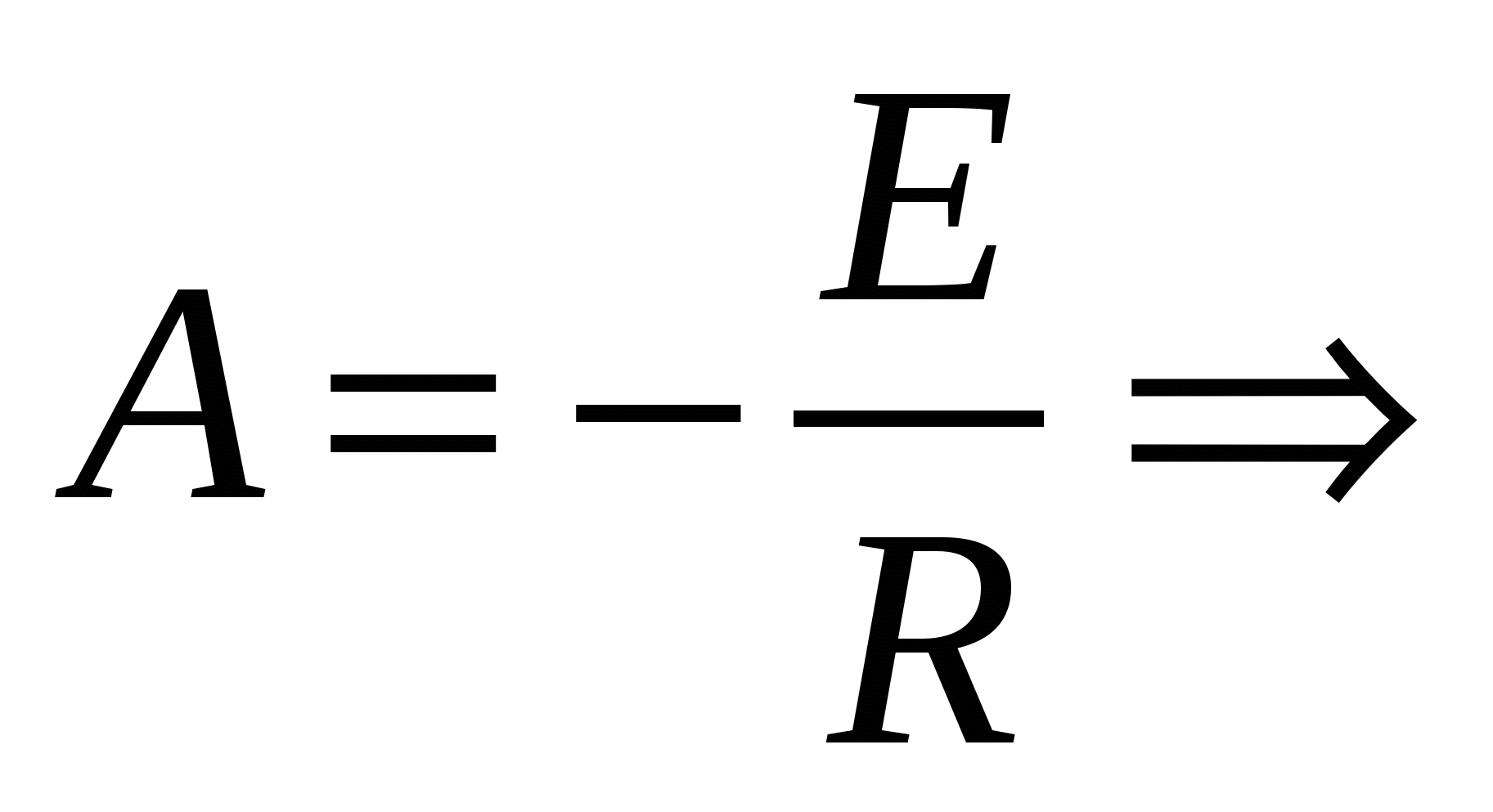 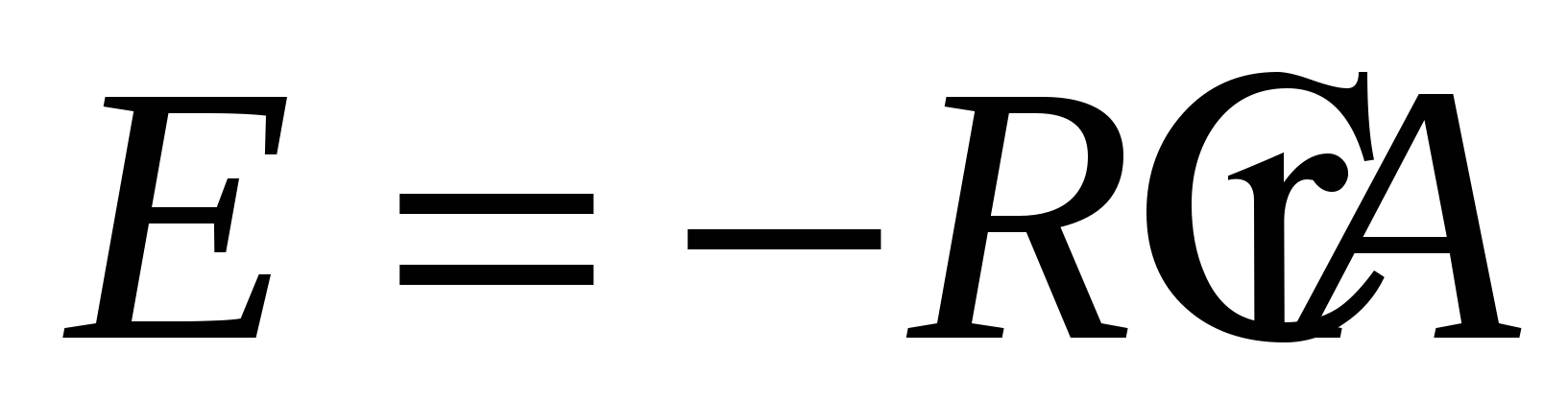
Уравнение изобары: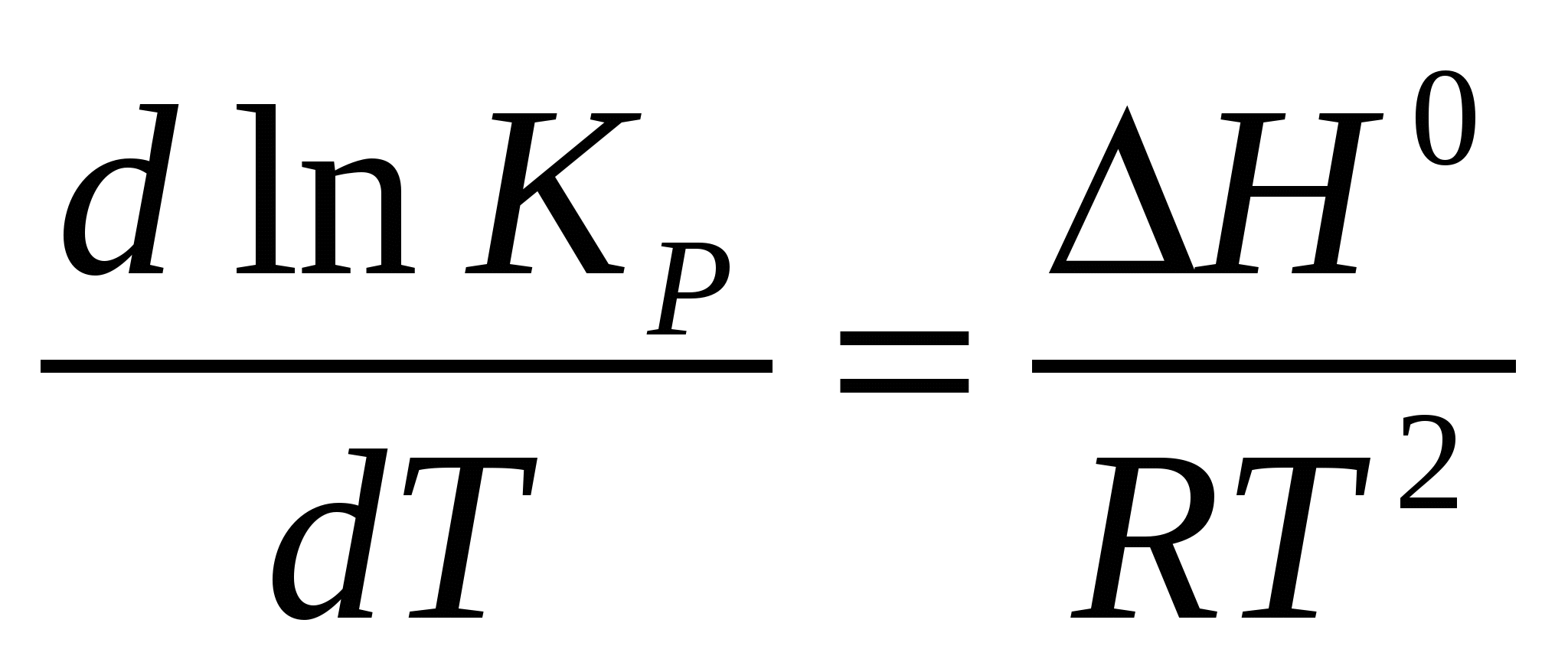 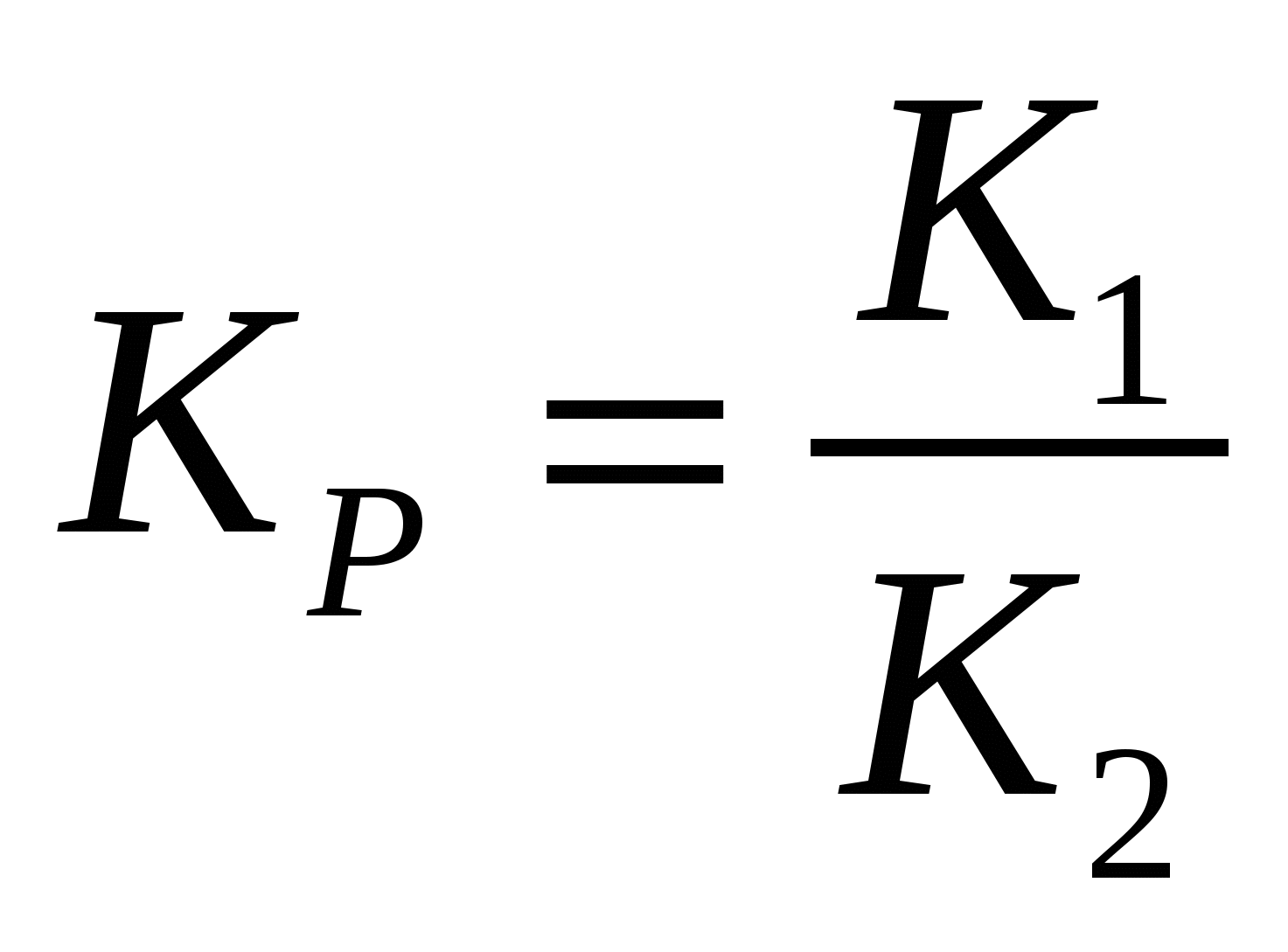
Изменение энтальпии определим как разницу энергии активации:
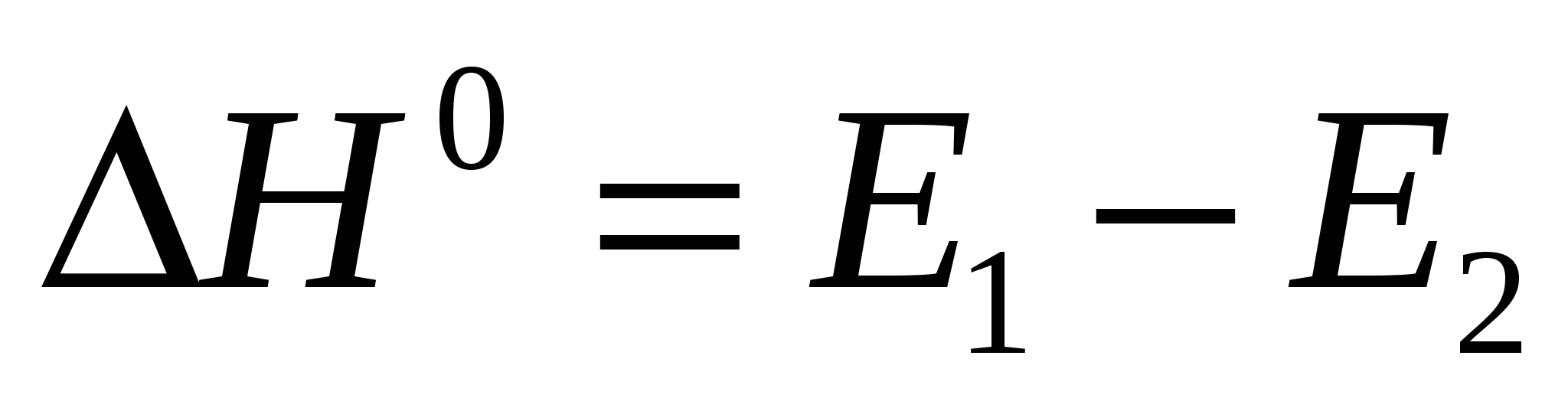 Е1 – энергия активации прямой реакции Е2 – обратной Е1 – энергия активации прямой реакции Е2 – обратной
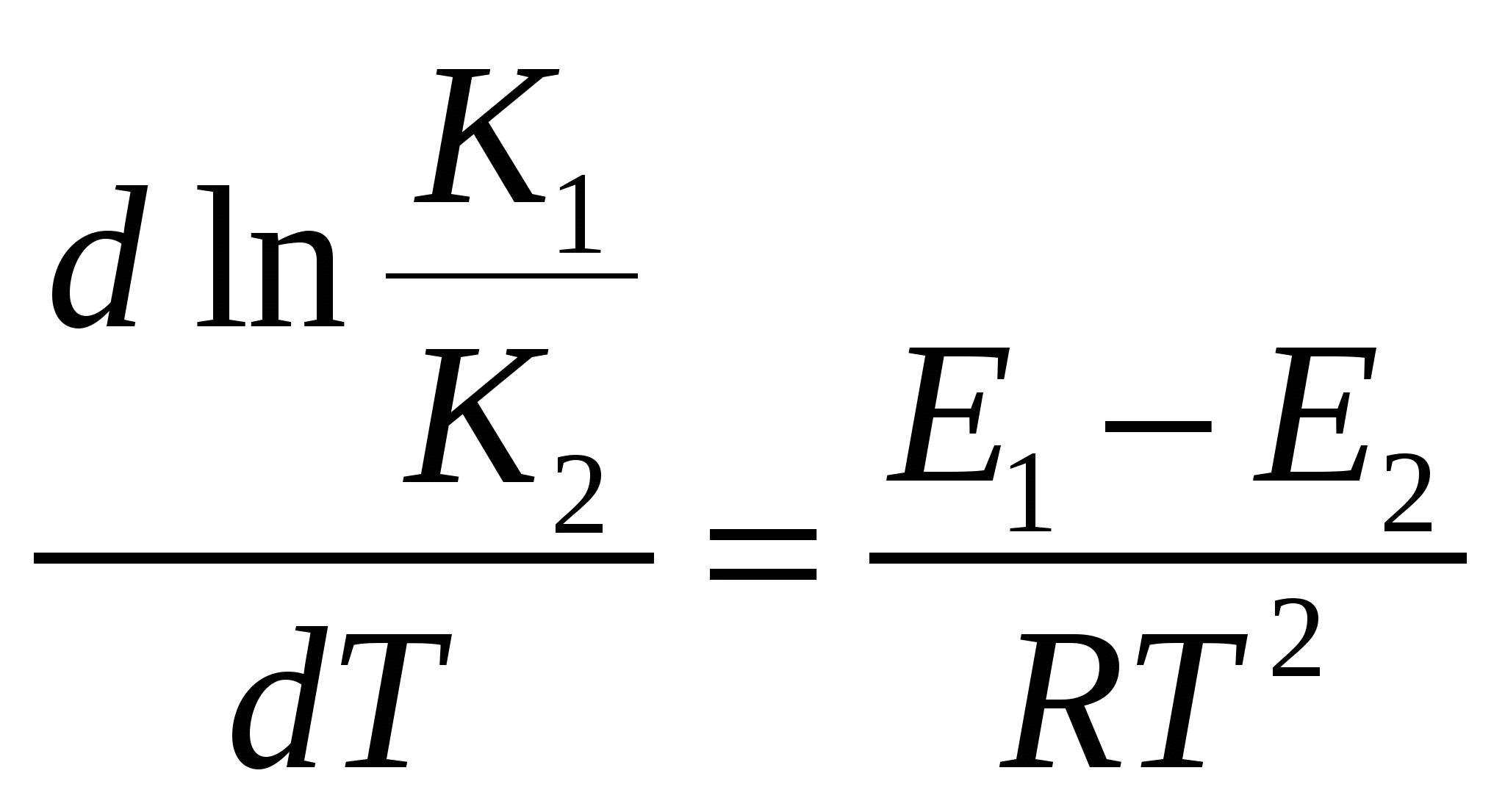 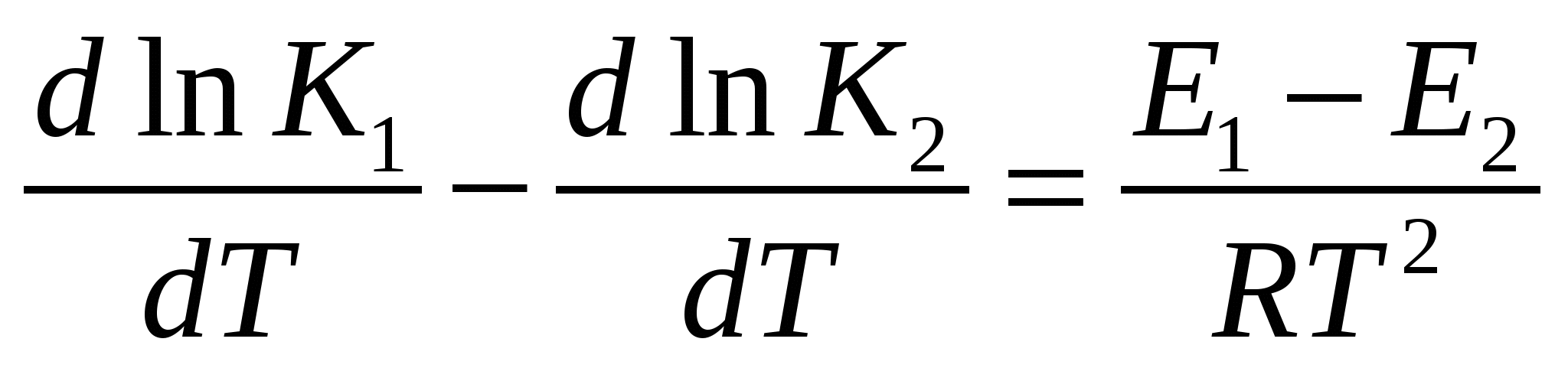 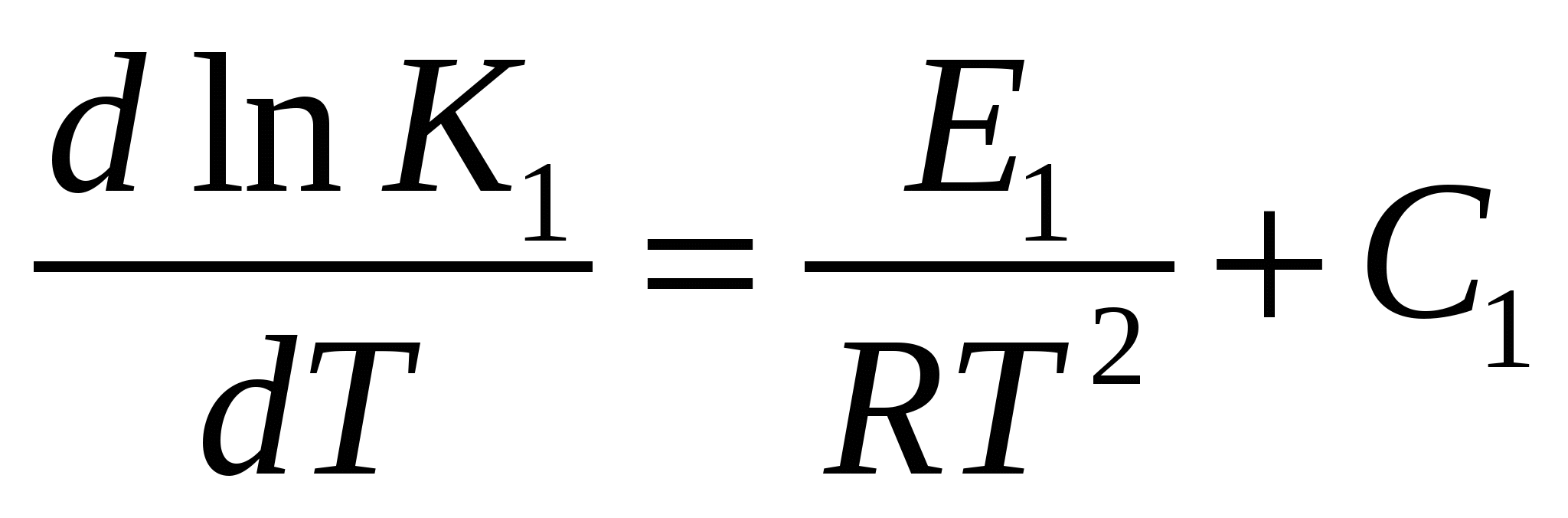 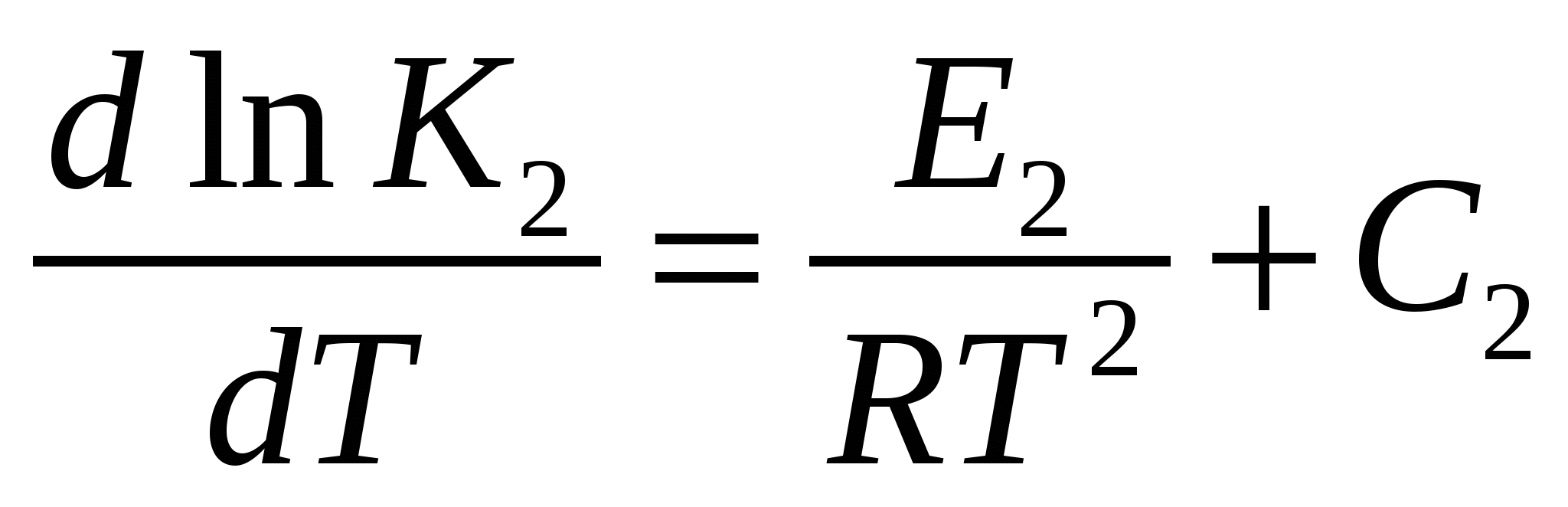
Проинтегрируем эти выражения:
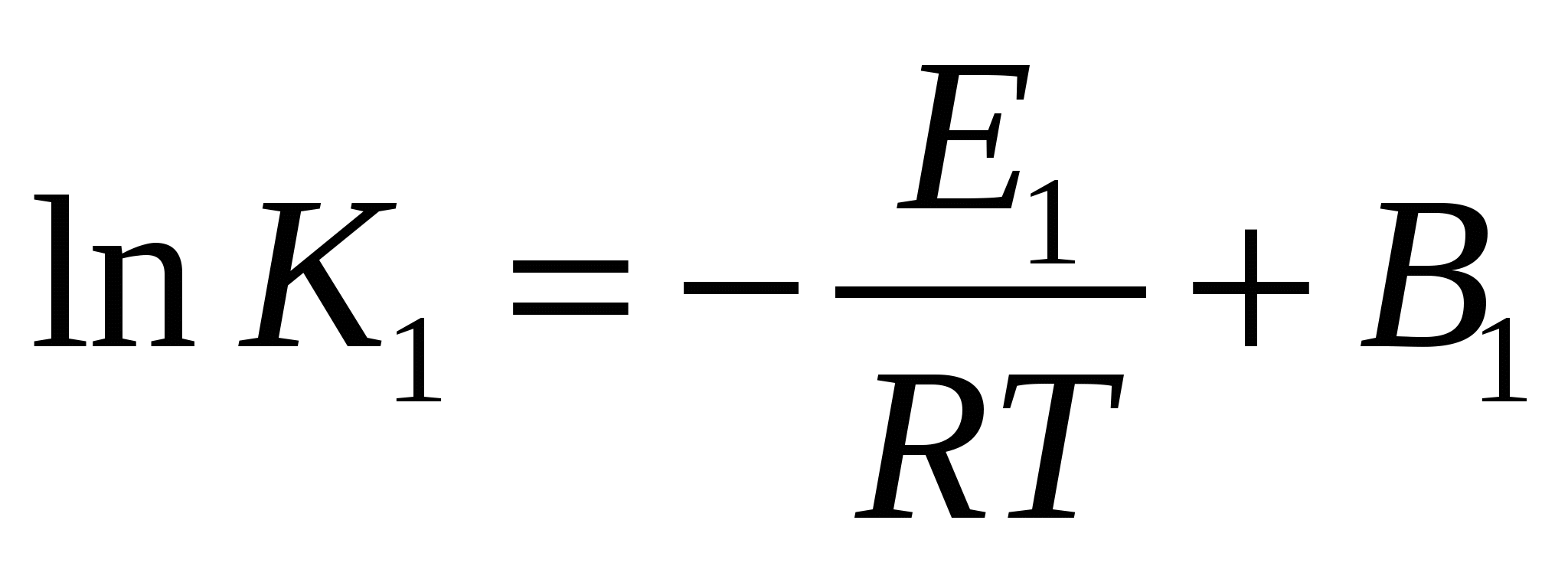 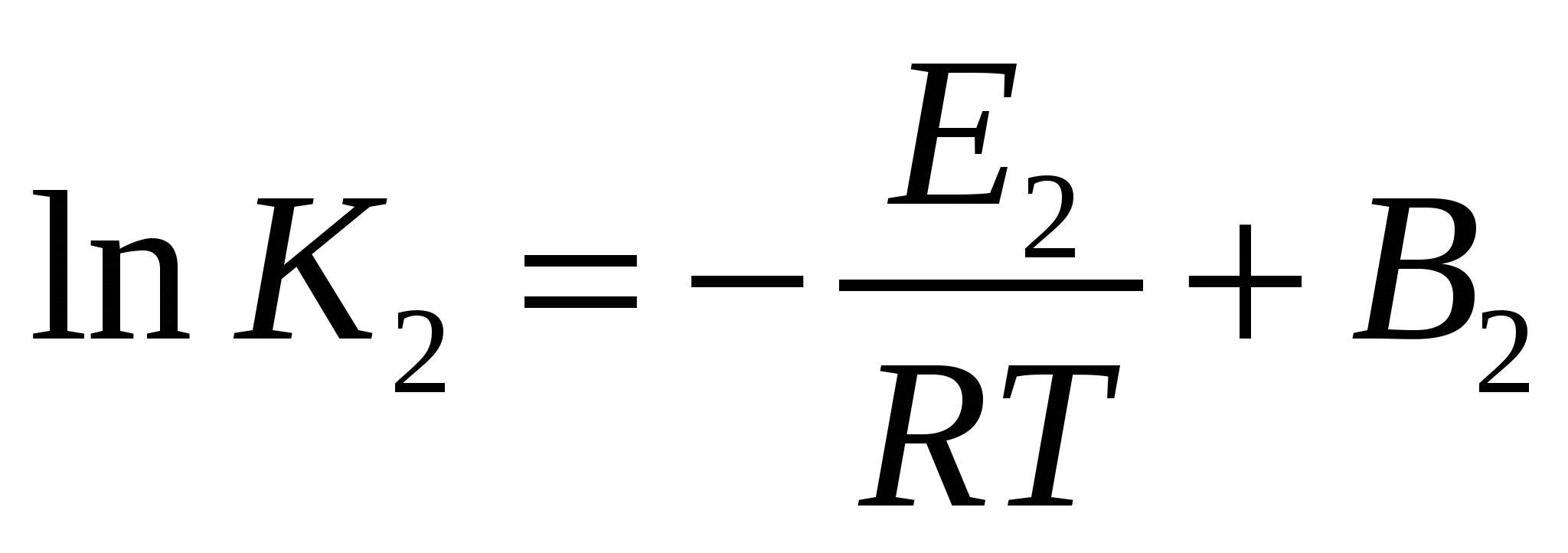
Физико-химический смысл энергии активации.
Экзотермия (выд. Q) Эндотермия (поглащ. Q)

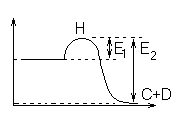 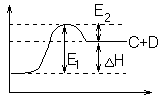
Н – энергетическая величина, которую нужно преодолеть, чтобы реакция пошла.
При переходе системы из состояния 1 в состояние 2 она преодолевает энергетический барьер. И его преодолевают только те молекулы, которые обладают достаточной энергией активации.
Зависимость константы скорости от обратной 
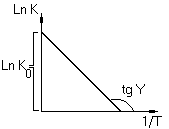 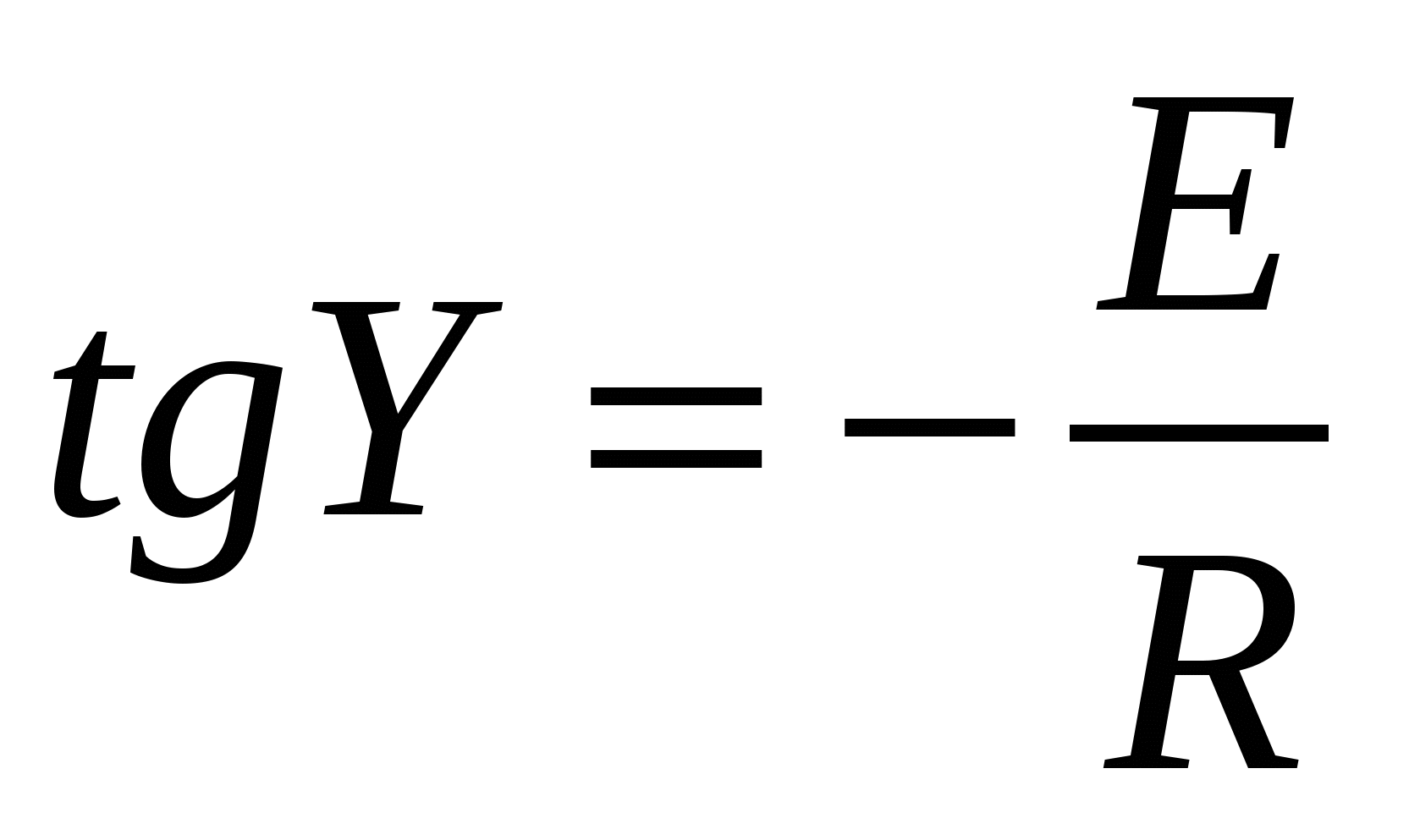
графическое изображение энергии активации
|
|
|
 Скачать 10.13 Mb.
Скачать 10.13 Mb.



 Скорость
Скорость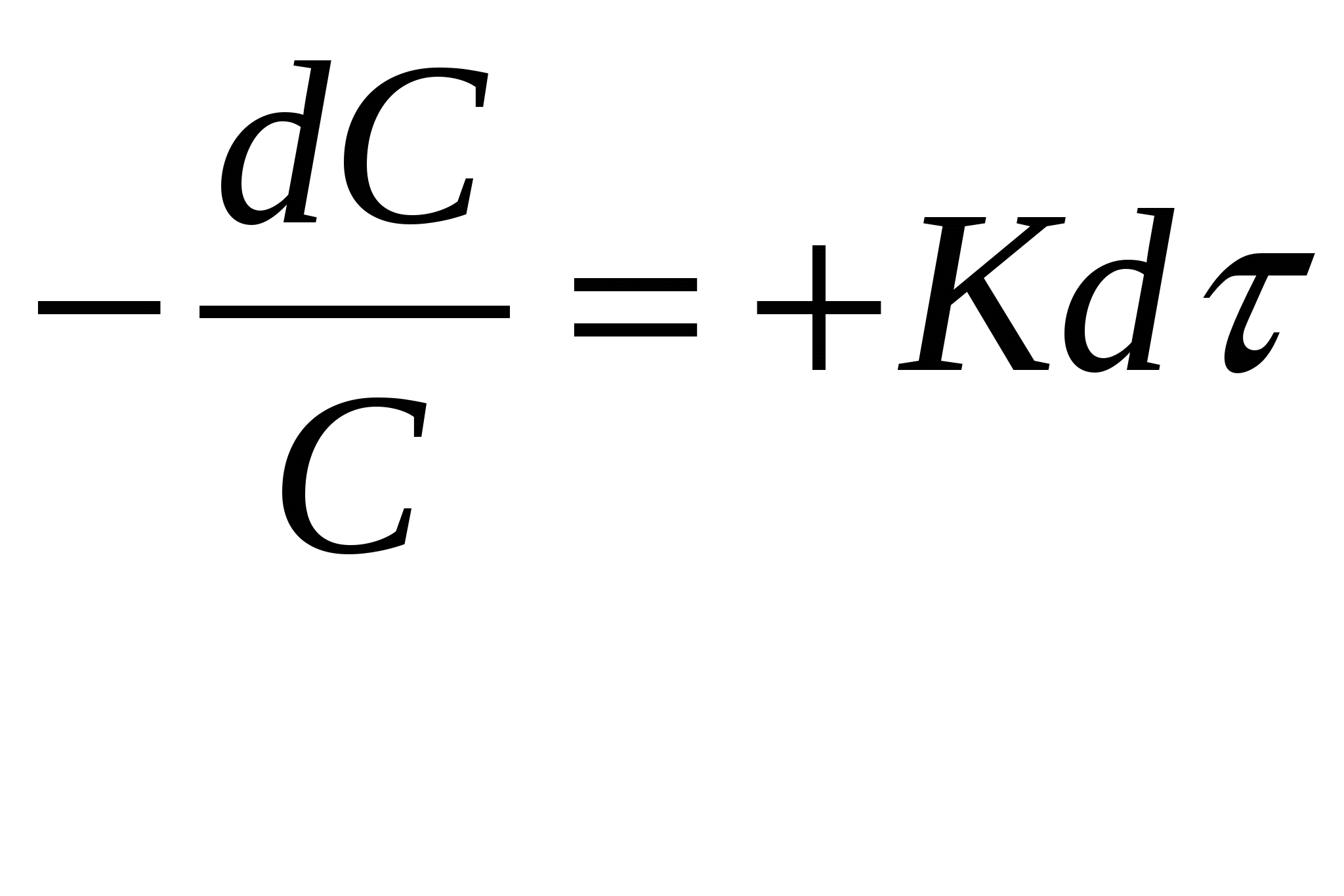
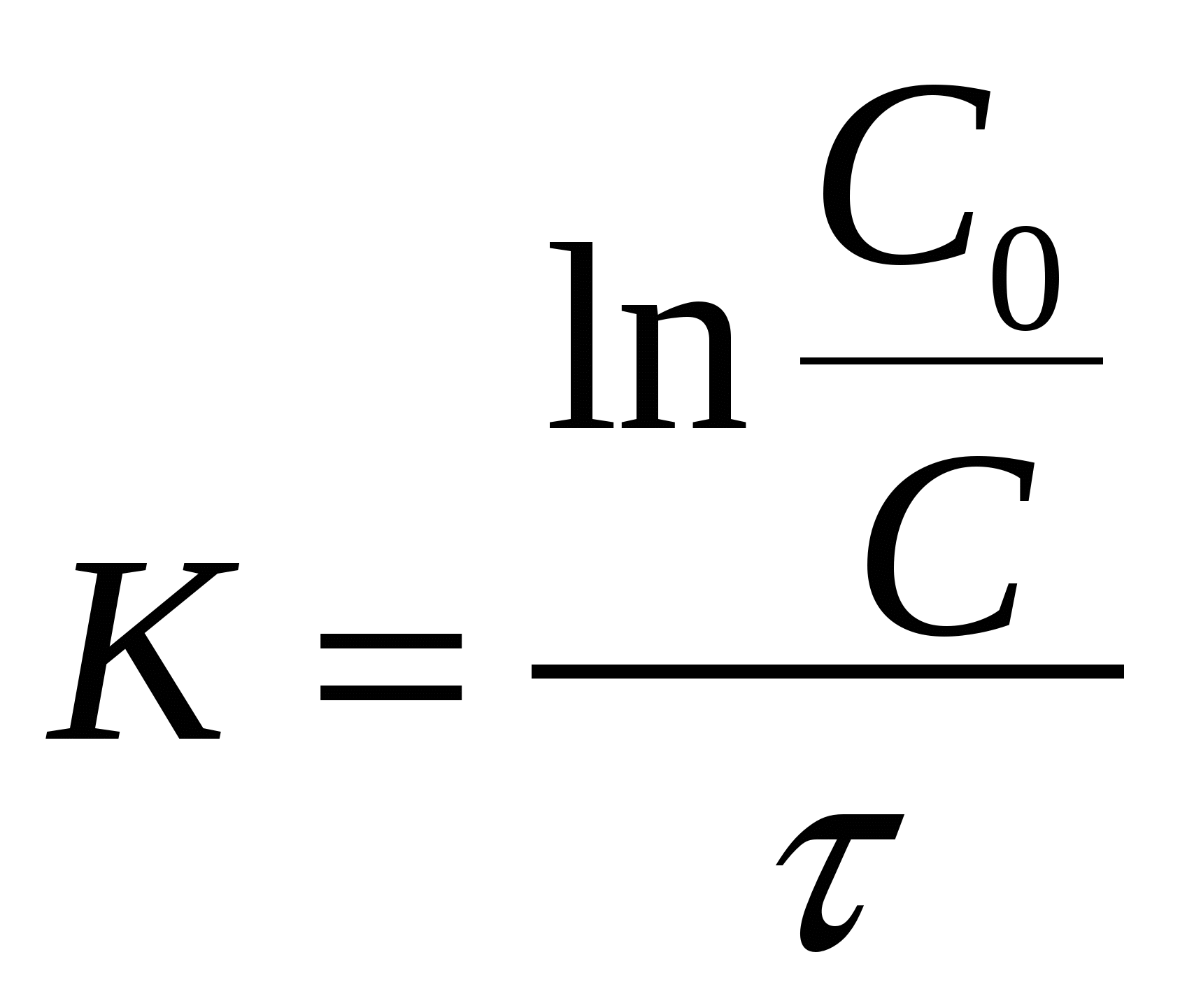
 ериод полураспада.
ериод полураспада.

 Параллельные реакции – могут одновременно протекать в двух и более направлениях.
Параллельные реакции – могут одновременно протекать в двух и более направлениях.  V1 C+D VN=V1+V2
V1 C+D VN=V1+V2  сли
сли 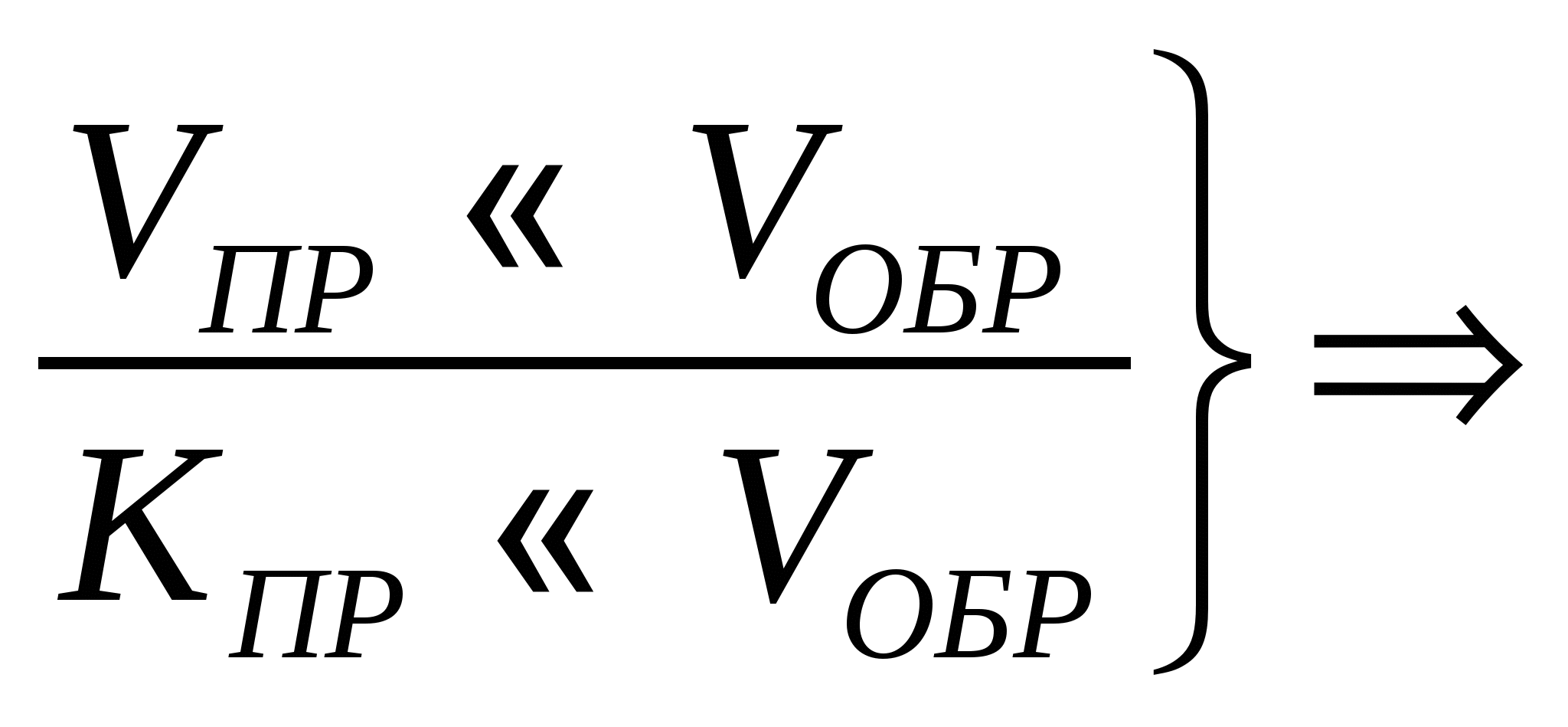 реакция необратимая
реакция необратимая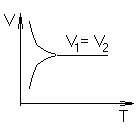 хема такого процесса
хема такого процесса