|
|
Лекции по химии. Лекция 1. Литература Карпин. Курс химии. Общая химия. Соколовская, изд. Мгу 1989г
Сигма и П – связь
На примере этилена
С2Н4
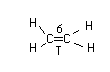
 - связь, которая действует по кратчайшему рассоянию и связывает центры взаимодействия атомов. - связь, которая действует по кратчайшему рассоянию и связывает центры взаимодействия атомов.
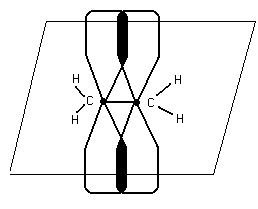 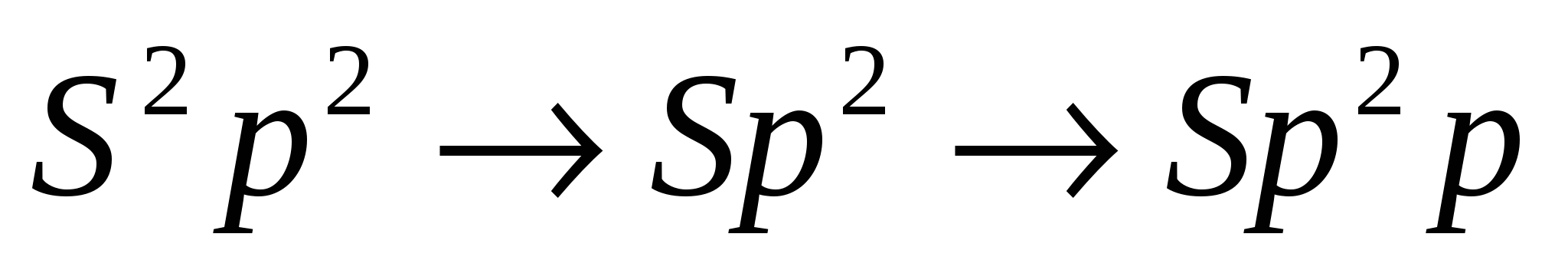
П – связь расположена в плоскости,
перпендикулярной плоскости б
б- более прочная, в отличии от П
Лекция №3
Свойства воды.
Необходимо различать полярность связи и полярность молекул. Если молекула двухатомна, то наличие полярных связей приводит к полярной молекуле. Если связи полярны, а молекула нет, то такие связи построены симметрично.
Мс=0=1.7D
0=C=0
МCl2=0
Молекулы воды.
Благодаря полярной связи в воде появляются ……. за счёт водородной связи, в данном случае водород ведёт себя подобно двухвалентному элементу.
(H2O), х = 1 – 3.
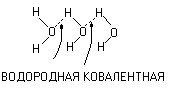
 3 молекулы воды 3 молекулы воды
Максимальная 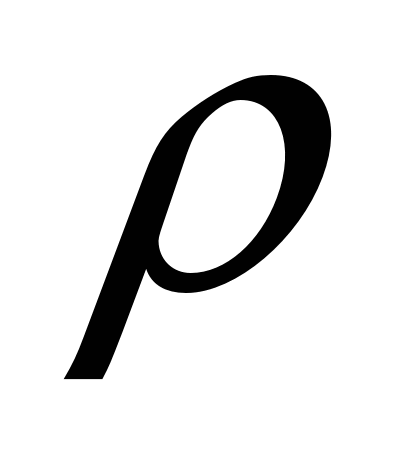 воды при +40С. воды при +40С.
Высокая теплоёмкость – другое атомное свойство.
Донорно-акцепторная связь и комплексное соединение.
 соединения первого порядка(валентно насыщенные соединения) NaCl, H2O, NH3, CuSO4,KY. соединения первого порядка(валентно насыщенные соединения) NaCl, H2O, NH3, CuSO4,KY.
Соединения высшего порядка – соединения второго порядка за счёт проявления донорно-акцепторной связи.
Пример: NH3+HCl  NH4Cl NH4Cl
СuSO4+4NH3  [Cu(NH3)4]SO4 [Cu(NH3)4]SO4
Донорно-акцепторная связь – разновидность ковалентной связи.
Как строятся комплексные соединения и их названия.
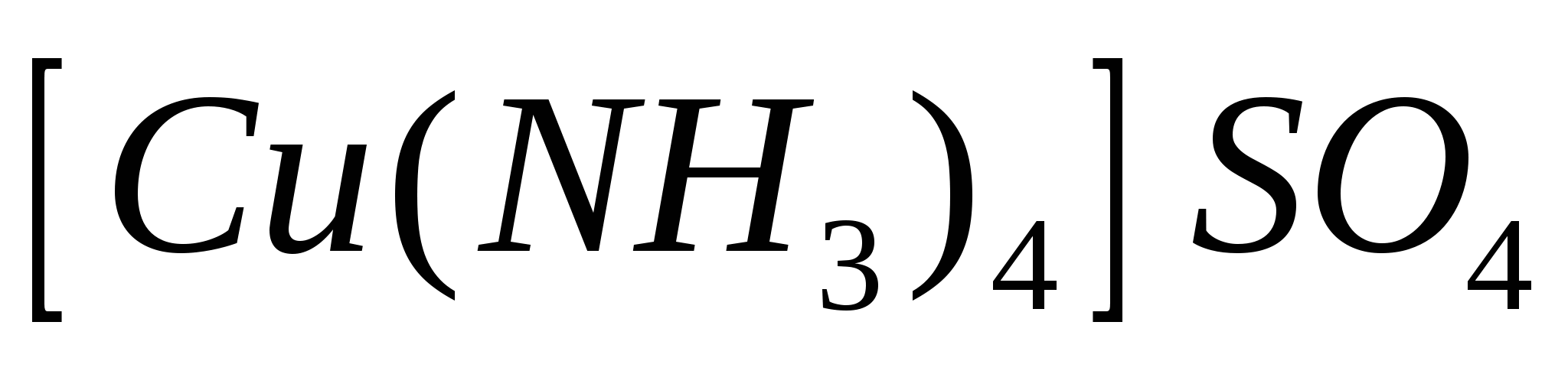 - тетроамиачный сульфат. - тетроамиачный сульфат.
Внутри квадратных скобок внутренняя сфера. Медь в данном случае ивляется ионообразователем. В круглых скобках находиться лиганды.
Число лиганд – корниционное число, оно показывает кокое кол-во лиганд связано с комплексообразователем. Корниционное число 1-9,12.
Внутри сферы связь донорно акцепторная, а вне скобок может быть и ковалентная и ионная связь.
Межмолекулярное взаимодействие.
Проявление сил отталкивания – малая сжимаемость жидкости.
Соотношение сил когезии и адгезии и сил теплового движения молекул определяет агрегатное состояние вещества.
Силы столкновения: проявляют себя на очень малых расстояниях и обычно убывают с увеличением расстояния. Их можно определить в качестве исходного коэффициента. 

Индукционные.
Когда одна молекула – ярко выраженный диполь, а другая - полярная молекула. Полярная молекула индуцирует дипольный момент в неполярной молекуле.
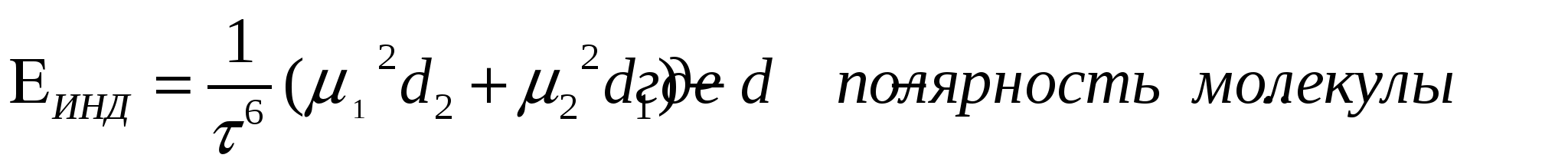 
Дисперсионное притяжение.
Если молекулы непарные, то могут возникать диполи.
 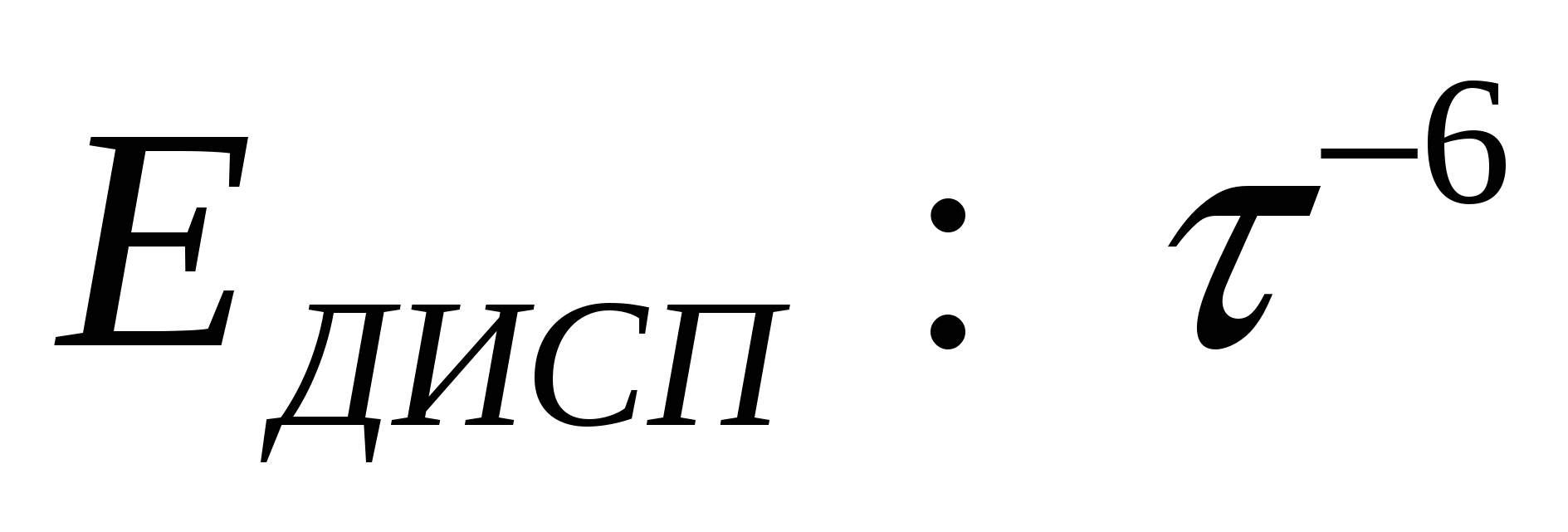 - определяется потенциалом ионизации - определяется потенциалом ионизации
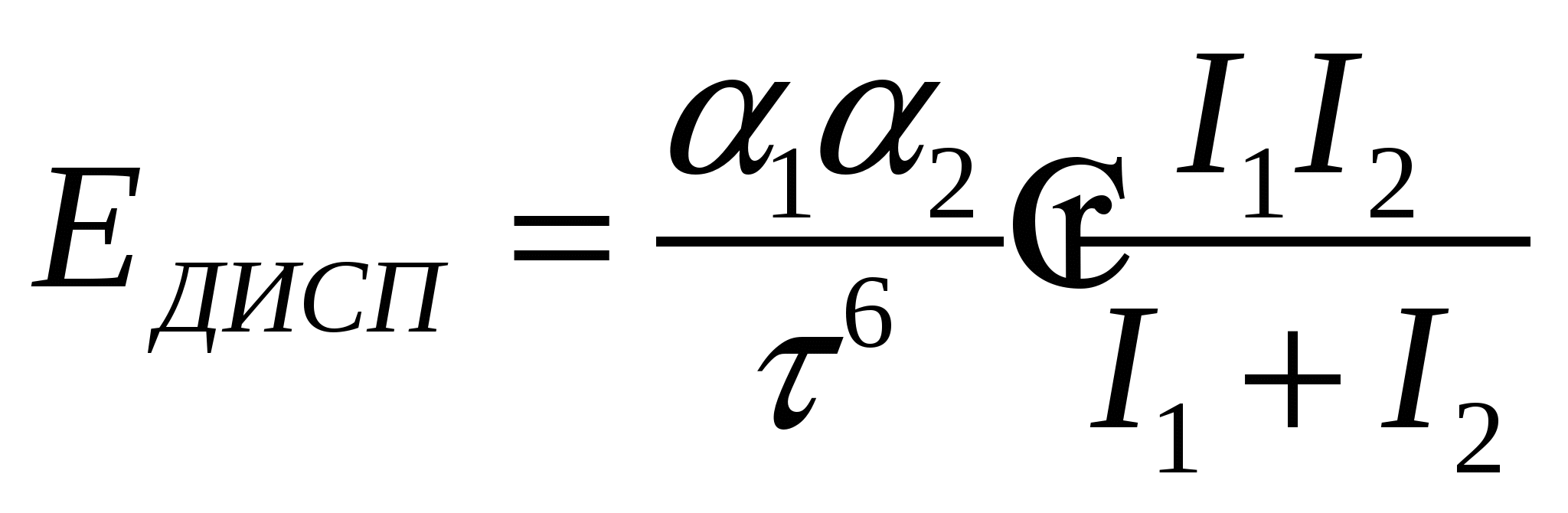
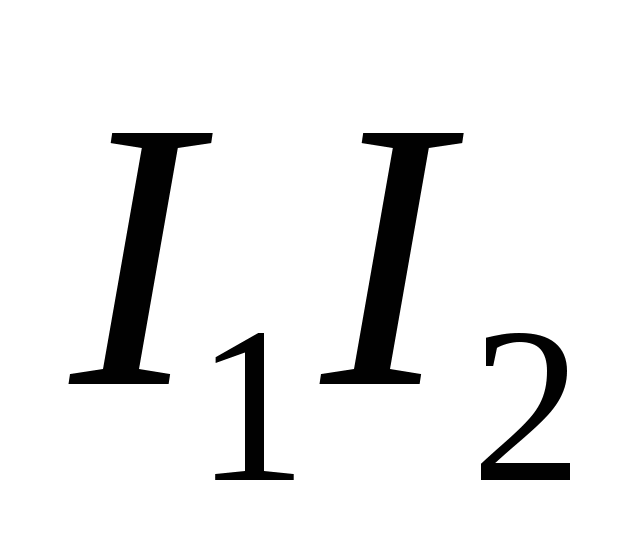 - потенциал ионизации соответствующих атомов - потенциал ионизации соответствующих атомов
При сближении изменяется напряжённость диполей, происходит почти симметрично. Силы дисперсионного взаимодействия аддитивны.
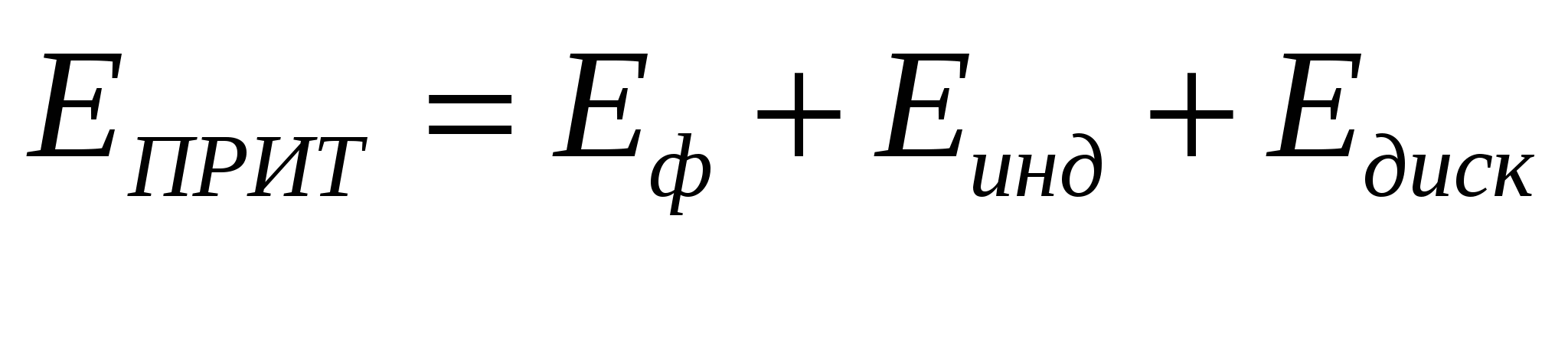
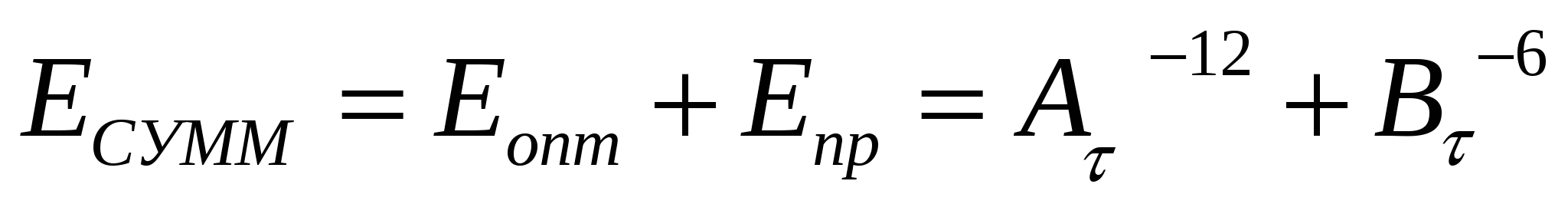 
Твёрдые тела. Электролиты теории твёрдого состояния.
Четыре агрегатных состояния вещества. Истинно твёрдое состояние – кристаллическое состояние.
Диаграмма:
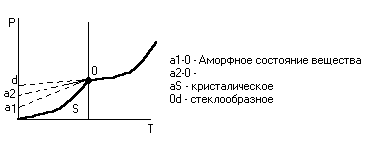
Зависимость давления насыщенного пара над твёрдыми веществами
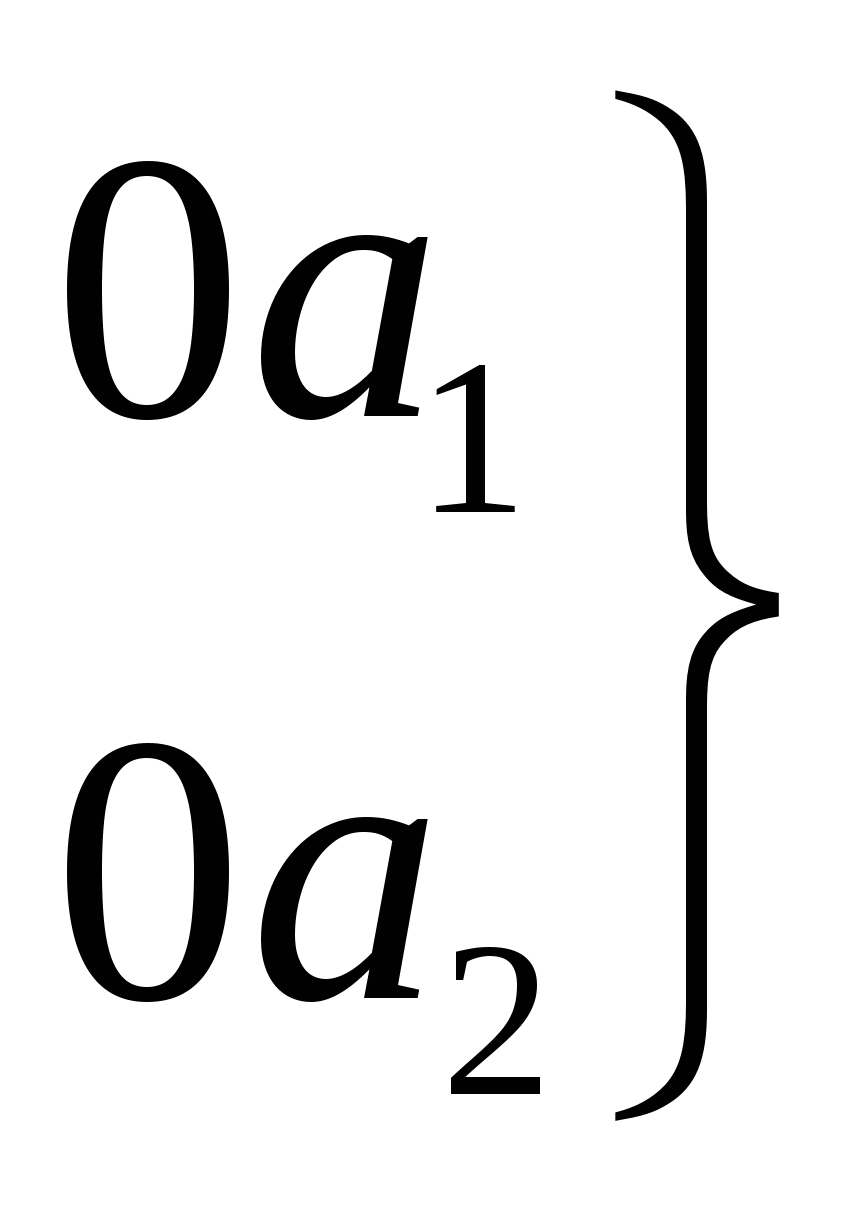 давление насыщенного пара над аморфным. давление насыщенного пара над аморфным.
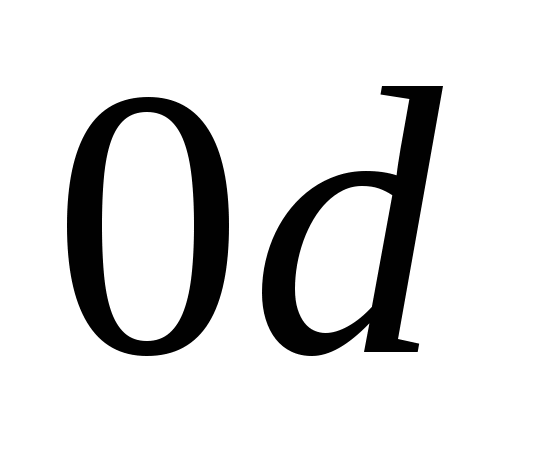 - давление насыщенного пара над стеклообразным. - давление насыщенного пара над стеклообразным.
Аморфное – в нём имеются остатки кристаллической структуры.
Давление пара над одним и тем же веществом может быть различным, чем более дисперицировано вещество, тем лучше давление пара на него.
Состояния углерода:
Кристаллическое – алмаз, графит.
Стеклообразное – кокс.
Аморфное – сажа.
Кристаллом называют твёрдое тело, которое ограничено в силу упорядоченности плоскими границами.
Поликристаллическое тело – совокупность сросшихся кристаллов.
Наиболее характерным признаком кристаллов (моно и поли) – наличие температуры плавления.
Для стеклообразного тела изменяется температурный интервал различения.
Одно из основных свойств кристаллов: анизотропия (зависимость одних и тех же свойств в различных направлениях).
Скалярное свойство – теплоёмкость.
Поликристаллы изотропны, а монокристаллы анизотропны.
Ме – кваризотропные вещества.
Кристаллы различных веществ отличаются друг от друга внешней формой (габитусом). Габитус одних и тех же веществ может показаться различным, при этом может показаться различным число граней, форма и т.д., а углы всегда постоянны (закон постоянства междугранных углов ).
Т.е. во всех кристаллах данного вещества при одинаковых условиях давления и углы постоянны.
Классификация кристаллов.
Симметрия внешней формы.
Симметрия внутренней структуры.
1. Для классификации по внешней форме нужно найти симметрию под симметричной фигурой понимается фигура, которая может совпасть сама с собой в результате симметричных преобразований.
Симметричные преобразования – операция симметричного совпадения точки или части фигуры с другой точкой или частью фигуры.
Элемент симметрии – воображаемые геометрические элементы, с помощью которых проводятся операции симметрии.
Элементы симметрии: оси, плоскость, центры (простые элементы симметрии)
Зеркальные поверхности, инверсионные оси (сложные).
Оси: бывают 1,2,3,4 и 6 порядка.
Рассмотрим на примере кубика:
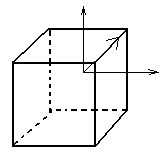 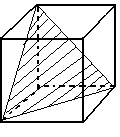 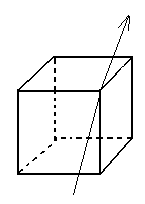
3 оси 4-го порядка 4 оси 3-го порядка
6 осей 2-го порядка
Всего тринадцать осей родного порядка, девять плоскостей симметрии.
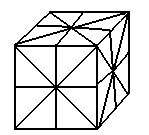
Центр симметрии совпадает с центром тяжести.
В пирамиде нет центра симметрии. В сочетании элементов
симметрии в природе неслучайно  32 вида симметрии . 32 вида симметрии .  32 класса кристаллов 32 класса кристаллов
Кристаллы делятся на 7 групп(по сходным углам), т.е. классифицируются по сходным углам
Элементарные ячейки кубической симметрии.
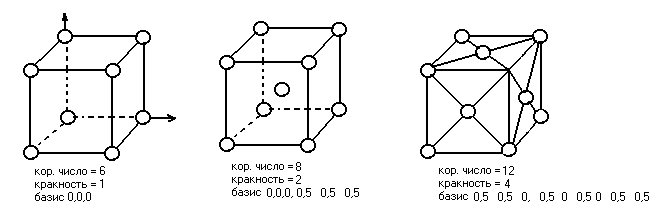
Характерные элементы ячеек.
Кореонационное число (число ближних частиц)
Кратность (число частиц приходящих на данный объем).
Базис координат некоторых исходных точек, зная которые, можно построить его фигуру.
Период идентичности – кратчайшее расстояние между двумя идентичными точками.
Структура кристалла характеризуется формой, размером элементарной ячейки.
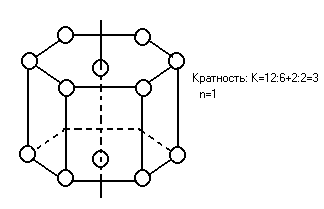
Плотность упаковки частиц кристалла.
Рассмотрим плотность упаковки элементарной ячейки.
Диаметр шара равен периоду идентификации.
2.В объемоцентрическом кубе заполняется 68%.
Границентрический куб 74%.
Гексогональная плотнейшая упаковка с 74%.
|
|
|
 Скачать 10.13 Mb.
Скачать 10.13 Mb.






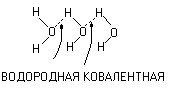
 3 молекулы воды
3 молекулы воды




