Лекции по химии. Лекция 1. Литература Карпин. Курс химии. Общая химия. Соколовская, изд. Мгу 1989г
 Скачать 10.13 Mb. Скачать 10.13 Mb.
|
ЛЕКЦИЯ№10Электролитическая диссоциация водыВторой закон Рауля: повышение температуры кипения и температуры замерзания пропорционально молярной концентрации раствора. Растворы электролитов. Электролитическая диссоциация воды Ионное произведение воды. Водородный показатель. 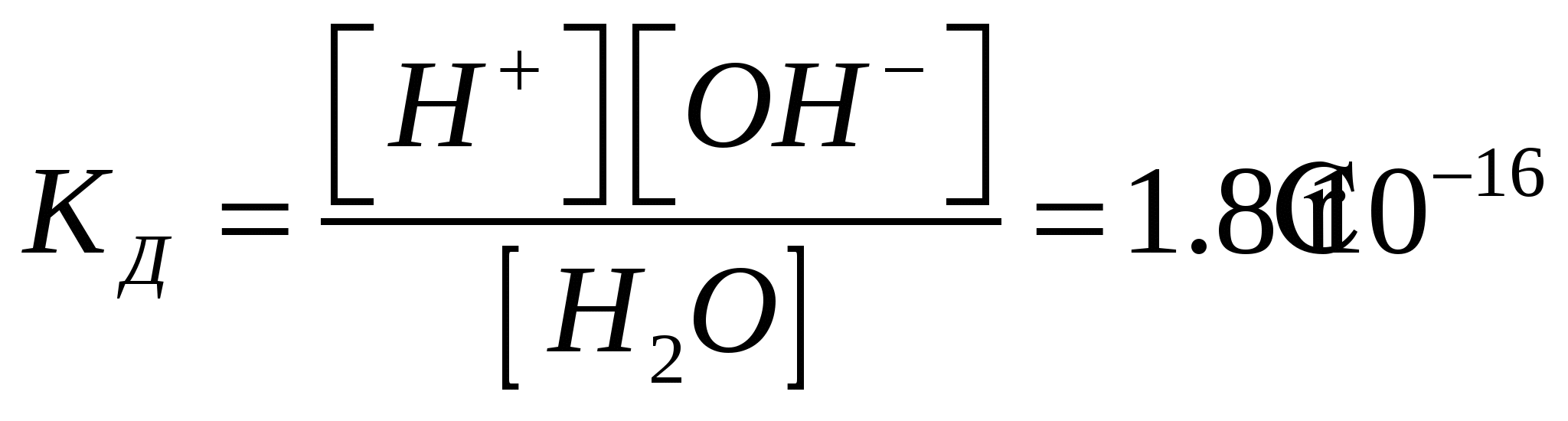 при t=220С при t=220С Диссоциация воды – эндотермический процесс
Условие электронейтральности раствора Электронейтральность Степень диссоциации 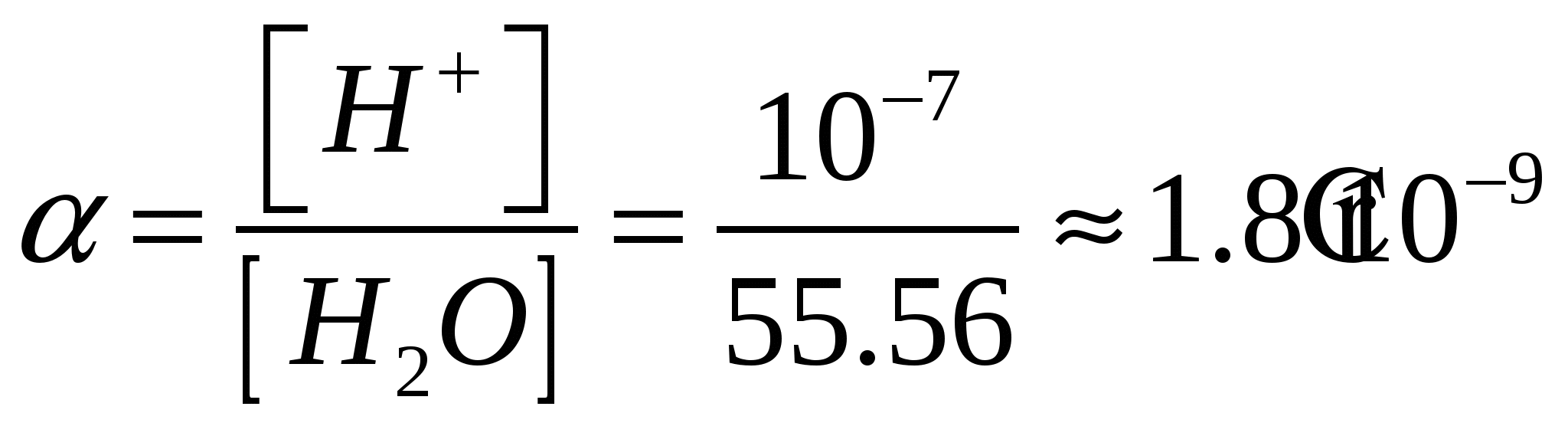 Кислая среда: РН - растворы РН Сок лимона: РН=-2,5, апельсин. сок: РН=-2,8, Сухое вино: РН=-5, молоко:РН=-5,9 Физико-химический анализДает наиболее полную характеристику системы. Химический анализ говорит о химическом составе системы и ничего не говорит о количестве фаз и характере их взаимодействия в системе. Правило фазКомпоненты системы – химические вещества, которые могут существовать в изолированном виде и определять состав системы. Число степеней свободы – вариабельность системы; число независимых друг от друга факторов равновесия (число факторов, которые можно менять произвольно, не нарушая состояния системы) Независимые компоненты – наименьшее число которых достаточно для образования всех фаз системы. Правило фаз ГибсаС=К-Ф+П С – число степеней свободы, П – число независимых переменныхФ – фазы, К – число компонентов Пример: Максимальное число фаз ? поваренная соль в воде; Фmax=Cmin Cmin=0 C=R-A+2 Фmax=2+2=4 Фаза 1 – раствор, Фаза 2 – осадок соли, Фаза 3 – водяной пар, Фаза 4 – лед Диаграмма P,t - воды 0 – тройная точка воды 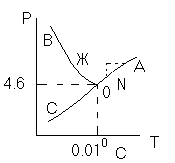 0А – равновесие (жидкость - пар) 0В – Жидкость - лед 0С – пар-лед (испарение) Число степеней свободы: С=К-Ф+2; С=3-Ф (1 компонент) Если мы увеличим Р, то увеличим Т, N – останется на кривой 0 – точка конвариантного равновесия Классификация диаграмм. Составляется по признаку образования фаз в твердом состоянии. Термографический анализ Диаграмма состояния (плавкости) – частный случай диаграммы состояния. Диаграммы плавкости строятся: Тплав, состав При построении таких диаграмм строятся кривые охлаждения / нагревания Это и есть термографический анализ ( построение кривых 1) Если система не испытывает фазовых переходов на заданном интервале температур, то 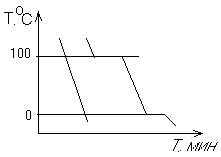 2) Если вещество испытывает фазовые переходы на заданном интервале температур (пример: охлаждение пара) Изгибы на кривых охлаждения появляются за счет выделения, поглащения тепла при фазовых переходах. Вынужденная эфтетика 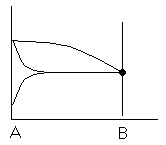 Диаграмма плавкости дистетического типаДистетика – (с греческого) тугоплавкийЛЕКЦИЯ №11Наличие дистетики говорит об устойчивости химического соединения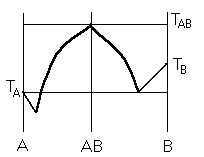 Наличие максимумов говорит о конгруэнтном Наличие максимумов говорит о конгруэнтномплавлении. (состав твердой и жидкой фазы в точке плавления совпадают) Чем круче максимум, тем устойчивее химич. соед. 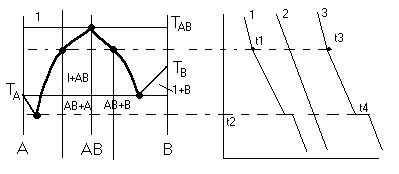 Особенность дистетической Особенность дистетическойдиаграммы: при охлажден. всегда получается твердая фаза Диаграмма с неустойчивым химическим соединением (со скрытым максиммом) 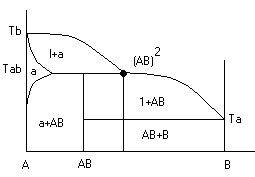 Инконгурентное плавление, когда при Tав Инконгурентное плавление, когда при TавПолучается жидкая фаза (АВ) и твердая С перитектиком диаграмма. 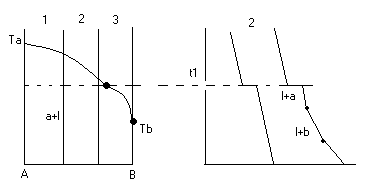 Изгибы на кривых охлаждения появляются за счет выделения поглощенного тепла при фазовых переходах. Основы электрохимии. Электрохимия – область физической химии, которая занимается изучением химических процессов, сопровождающихся появлением электрического тока, либо вызванных электрическим током. Окислительно-восстановительные реакции – сопровождаются перемещением или смещением электронов. Для появления электрического тока, нужно окислительно-восстановительную реакцию пространственно разделить. Электрод – проводник первого рода, погруженный в раствор электролита, в условиях прохождения через него электрического тока. 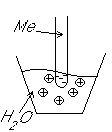 Частично металлы растворяются: ионы металлов частично Частично металлы растворяются: ионы металлов частично переходят в воду. Отрицательные заряды не дают катионам уйти далеко в воду, следовательно, образуется двойной электрический слой. 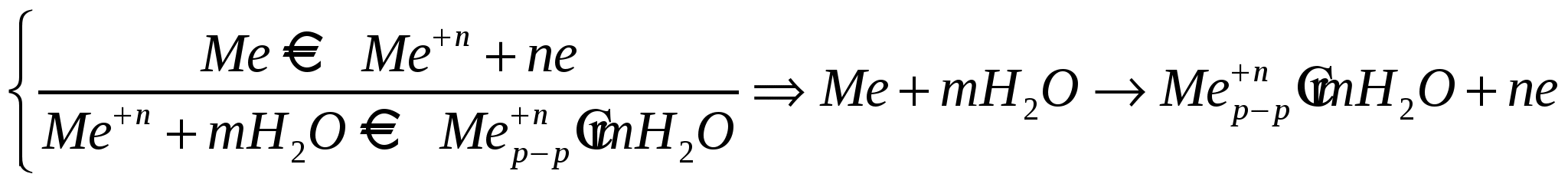 реакции внутри металла и на поверхности электрода Любой металл погруженный в воду имеет в себе отрицательный заряд, величина этого заряда определяется свойствами металла. Металлы в растворе собственной соли. |

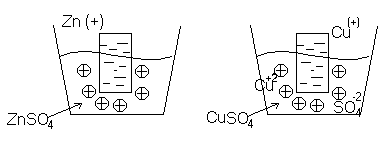 Количество ионов, которые
Количество ионов, которые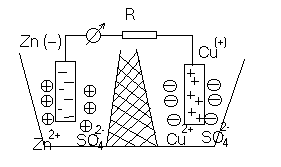 Избыточные электроны перейдут с электрода
Избыточные электроны перейдут с электрода 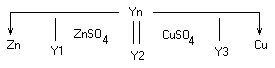
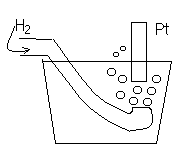
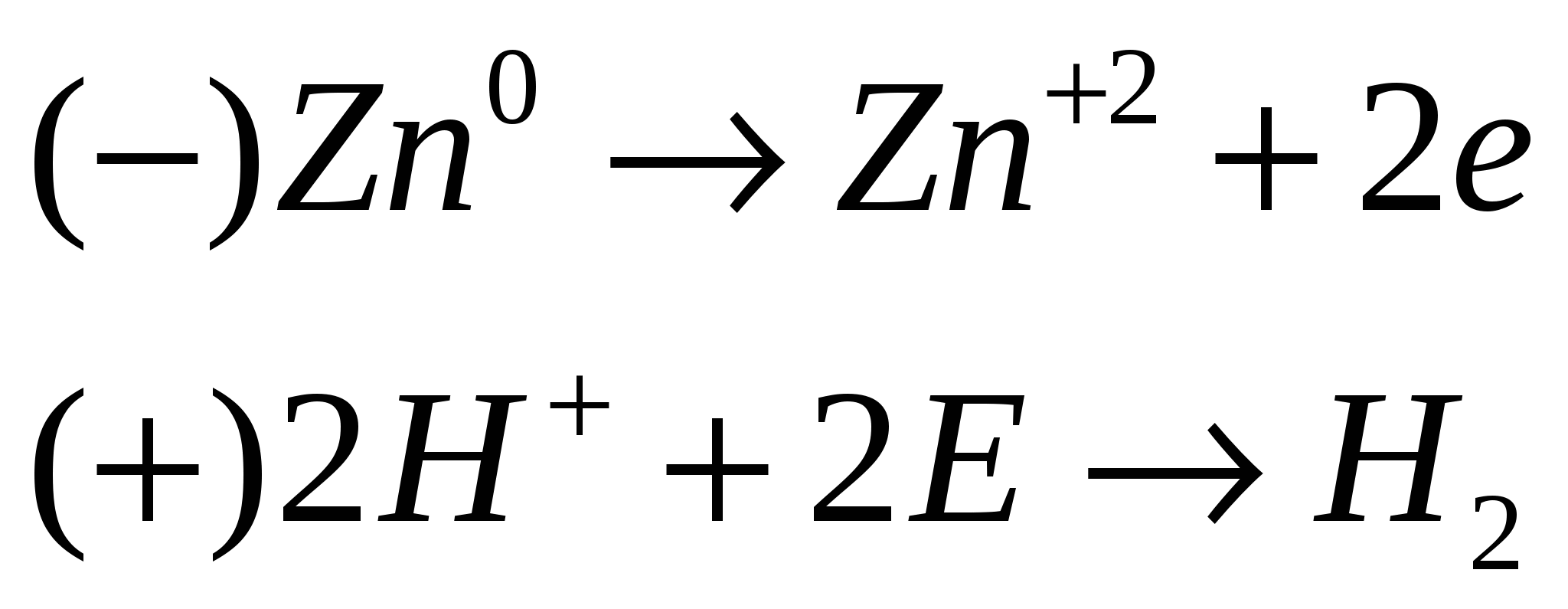
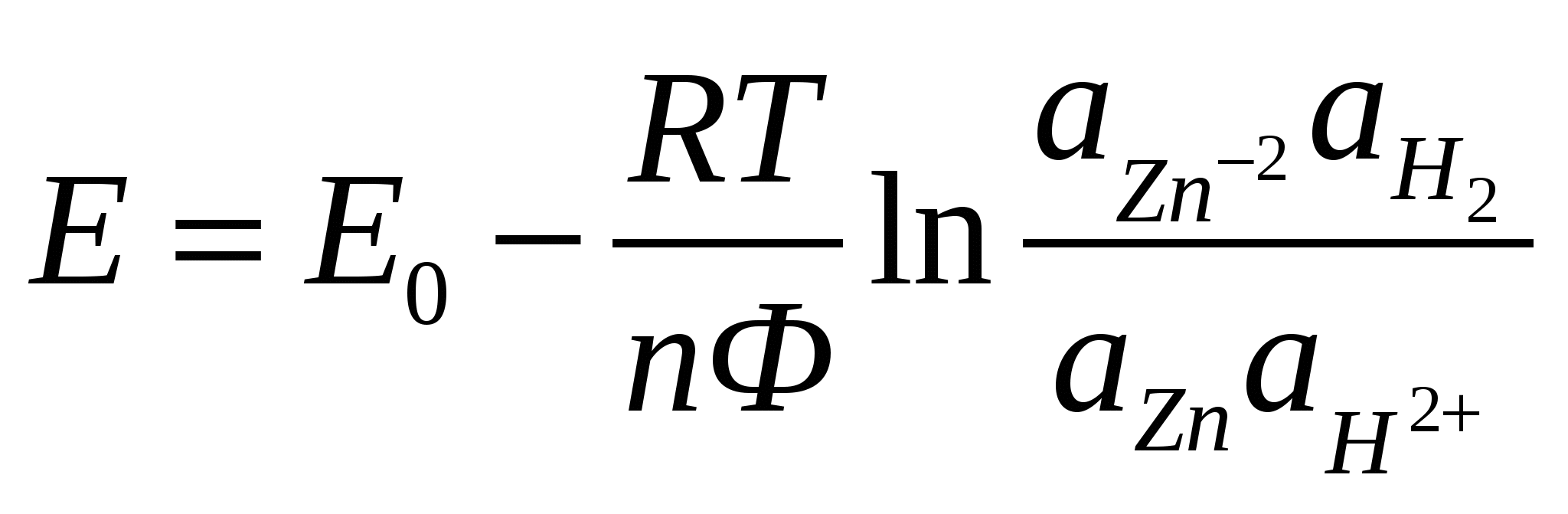 а– активность
а– активность