ЛЕКЦИЯ 14. Лекция 14 Электрокинетические свойства коллоидных систем. Электрофорез, электроосмос. Строение коллидных частиц лиофобных золей, электрокинетический потенциал.
 Скачать 0.76 Mb. Скачать 0.76 Mb.
|
Правила коагуляции:1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию. Минимальная концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции Ck. Иногда вместо порога коагуляции используют величину VK, называемую коагулирующей способностью. Это объем золя, который коагулирует под действием 1 моля электролита: т.е. чем меньше порог коагуляции, тем больше коагулирующая способность электролита. 2. Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого совпадает по знаку с зарядом противоиона мицеллы лиофобного золя. Этот ион называют ионом–коагулянтом. 3. Коагулирующая способность иона–коагулянта тем больше, чем больше заряд иона. Количественно эта закономерность описывается эмпирическим правилом Щульце – Гарди: где - постоянная для данной системы величина; Z – заряд иона – коагулянта; Правило устанавливает, что коагулирующие силы иона тем больше, чем больше его валентность. Экспериментально установлено, что ионы с высшей валентностью имеют значение порога коагуляции ниже, чем ионы с низшей. Следовательно, для коагуляции лучше брать ионы с высшей степенью окисления. Если валентность ионов одинакова, то коагулирующая способность зависит от размеров и степени гидратации ионов. Чем больше радиус иона, тем больше его коагулирующая способность. По этому правилу составлены лиотропные ряды. Органические ионы-коагулянты, как правило, лучше коагулируют гидрозоли, чем неорганические, т.к. они легко поляризуются и адсорбируются. С точки зрения двойного электрического слоя (ДЭС) считается, что коагуляция идет в том случае, когда -потенциал > 30 мВ. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Причина с одной стороны, в большой поляризуемости ионов наибольшего радиуса, следовательно, в их способности притягиваться поверхностью, состоящей из ионов и полярных молекул. С другой стороны, чем больше радиус иона, тем меньше, при одной и той же величине заряда, гидратация иона. Гидратная же оболочка уменьшает электрическое взаимодействие. Коагулирующая способность органических ионов больше по сравнению с неорганическими ионами. Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке: При увеличении концентрации иона–коагулянта – потенциал мицеллы золя уменьшается по абсолютной величине. Коагуляция может начинаться уже тогда, когда – потенциал снижается до 0,025 – 0, 040 В (а не до нуля). При коагуляции золя электролитами различают концентрационную и нейтрализационную коагуляцию. Концентрационная коагуляцияимеет место, когда она происходит под действием индифферентного электролита вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения -потенциала. Рассмотрим концентрационную коагуляцию золя хлорида серебра, стабилизированного нитратом серебра, при введении в золь нитрата калия. Формула мицеллы имеет вид: На рис. 3.1.2.1 показан график изменения потенциала в ДЭС мицеллы хлорида серебра. Кривая 1 относится к исходной мицелле, кривая 2 – после добавления KNO3 в количестве, вызывающем коагуляцию. При добавлении KNO3 диффузный слой противоионов сжимается, формула мицеллы приобретает вид: 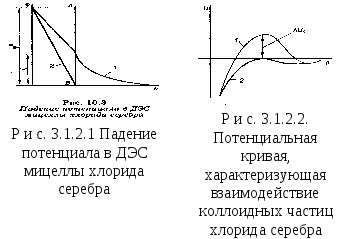 На рис. 3.1.2.2 представлены потенциальные кривые, характеризующие взаимодействие частиц в этом золе. -потенциал исходной коллоидной частицы положительный, это создаёт потенциальный барьер коагуляции ∆Uк=0 (кривая 2 рис. 3.1.2.2). Поэтому ничто не мешает коллоидным частицам сблизиться на такое расстояние, где преобладают силы притяжения – происходит коагуляция. Так как в данном случае причиной коагуляции является увеличение концентрации противоионов, она называется концентрационной коагуляцией. Для этого случая теория дает формулу где - порог коагуляции; С – константа, слабо зависящая от асимметрии электролита, т.е. отношение числа зарядов катиона и аниона; А – константа; е – заряд электрона; - диэлектрическая проницаемость; Z – заряд коагулирующего иона; Т – температура. Из уравнения следует, что значение порогов коагуляции для одно-, двух-, трех-, четырех- зарядных ионов должны соотноситься 1 к (1/2)6 к (1/3)6 к (1/4)6 и т.д., т.е. обосновывается ранее представленное эмпирическое правило Шульце – Гарди. Нейтрализационная коагуляцияпроисходит при добавлении к золю неиндифферентного электролита. При этом потенциалопределяющие ионы связываются в малорастворимое соединение, что приводит к уменьшению абсолютных величин термодинамического потенциала, а следовательно, и -потенциала вплоть до нуля. Если взять в качестве исходного только что рассмотренный золь хлорида серебра, то для нейтрализации потенциалопределяющих ионов Ag+ в золь необходимо ввести, например, хлорид калия. После добавления определённого количества этого неиндифферентного электролита мицелла будет иметь вид: В системе не будет ионов, способных адсорбироваться на поверхности частицы AgCl, и поверхность станет электронейтральной. При столкновении таких частиц происходит коагуляция. Так как причиной коагуляции в данном случае является нейтрализация потенциалопределяющих ионов, такую коагуляцию называют нейтрализационной коагуляцией. Необходимо отметить, что для полной нейтрализационной коагуляции неиндифферентный электролит должен быть добавлен в строго эквивалентном количестве. |
