печень биохимия. Лекция по печени биохимия 2006. Лекция 30 Тема Биохимия печени и метаболизм ксенобиотиков Факультеты лечебнопрофилактический, медикопрофилактический, педиатрический
 Скачать 256.5 Kb. Скачать 256.5 Kb.
|
|
ГОУВПО УГМА Федерального агентства по здравоохранению и социальному развитию кафедра биохимии Утверждаю Зав. каф. проф., д.м.н. Мещанинов В.Н. _____‘’_____________2008 г ЛЕКЦИЯ № 30 Тема: Биохимия печени и метаболизм ксенобиотиковФакультеты: лечебно-профилактический, медико-профилактический, педиатрический. 2 курс. Печень – самая крупная железа организма Масса печени у взрослого мужчины равна 1800г, у женщины - 1400г. (20-60г на 1кг веса тела). Относительная масса печени у новорожденного составляет 4,5-5,0% от массы тела, у взрослых она уменьшается в 2 раза до 2,5%. Масса печени и ее состав подвержены значительным колебаниям, как в норме, так и при патологии. переделать Строение печени Печень состоит из паренхиматозной и окружающей ее соединительной ткани. Структурными единицами печени являются печеночные дольки. Существует три модели печеночных долек: классическая печеночная долька, портальная печеночная долька, печеночный ацинус. 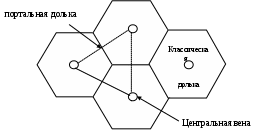 Классическая долька имеет форму усеченной шестигранной призмы, диаметром 1-1,5мм и высотой 1,5-2мм. В печени около 500 тыс. печеночных долек. Долька состоит из печеночных пластинок, имеющих радиальное направление в виде балок, и образованных гепатоцитами. В центре дольки находится центральная вена. С периферии в печеночную дольку проникают кровеносные капилляры, которые являются продолжением междольковых вен (из системы воротной вены) и междольковых артерий, проходящих в междольковых соединительнотканных прослойках. Внутри дольки венозная и артериальная капиллярные сети объединяются в синусоиды, которые располагаются между балками печеночных клеток и имеют с ними тесный контакт. Внутридольковые капилляры печени отличаются от капилляров других органов большим диаметром, стенка их очень плотно прилегает к поверхности гепатоцитов. Выходящие из капиллярной сети сосуды впадают в центральную вену дольки, по которой кровь оттекает в междольковые собирательные вены. Последние в дальнейшем формируют печеночные вены, впадающие в нижнюю полую вену. На поверхности отдельных гепатоцитов находятся борозды, которые вместе с подобными бороздами соседних гепатоцитов образуют тончайшие каналы (диаметром около 1 мкм). Эти каналы являются желчными капиллярами - желчными проточками. Собственной стенки желчные капилляры не имеют, они слепо заканчиваются в центральных отделах дольки, а на периферии образуют междольковые желчные проточки. Последние переходят в сегментарные, секторальные, долевые (правый и левый печеночный) протоки и, наконец, в общий печеночный проток. Междольковые артерии, вены и междольковые желчные проточки, лежащие параллельно друг другу в прослойках междольковой соединительной ткани, образуют триады печени. Современные представления о структурно-функциональной единице печени основаны на выделении смежных участков: из трех соседних печеночных долек - портальная долька или двух соседних печеночных долек - ацинус. Портальная долька имеет треугольную форму, в ее центре лежит печеночная триада. Ацинус имеет ромбовидную форму, триада располагается в проекции тупых углов. В отличие от печеночной дольки в портальной дольке и в ацинусе кровоснабжение осуществляется от центральных участков дольки к периферическим. 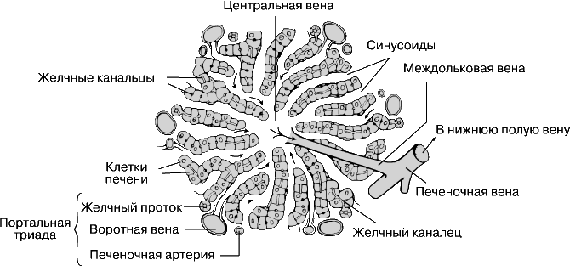 Гепатоциты - основные клетки печени, они составляют 60% всех клеточных элементов печени. Это крупные клетки, полигональной формы с шаровидным ядром в центре (20% клеток - двуядерные). Для них характерно содержание полиплоидных ядер (различного размера). Цитоплазма гепатоцитов содержит все органеллы - ЭПР, митохондрии, лизосомы, пероксисомы, пластинчатый комплекс. Также есть разнообразные включения - гликоген, жир, различные пигменты - липофусцин и др. Гепатоциты в дольке располагаются двумя рядами радиально, образуя друг с другом многочисленные анастомозы (связаны между собой десмосомами). Печеночную дольку подразделяют на три примерно одинаковые части: центральную (вокруг центральной вены), промежуточную и перипортальную (вокруг портальных трактов). Портальные тракты, представленные прослойками соединительной ткани, содержат триады, которые образованы терминальными ветвями афферентных кровеносных сосудов (воротная вена и печеночная артерия) и желчными протоками, отводящими желчь из печеночных долек. В портальных трактах расположены лимфатические сосуды и нервные волокна. Внутридольковый синусоидный капилляр на большем протяжении не имеет базальной мембраны, его стенка образована: эндотелиальными клетками (50%), клетками Купфера (звездчатые ретикулоэндотелиоциты) (20-25%), перисинусоидными липоцитами (клетки ИТО), ямочными (pit) клетками (5%). Клетки Купфера находятся между эндотелиоцитами, их поверхность образует многочисленные псевдоподии. Относятся к макрофагической системе организма, они захватывают и переваривают бактерии, обломки эритроцитов, могут выходить в просвет синусоидных капилляров, набухать, выполняя роль сфинктеров синусоидных капилляров. Ведут свое происхождение от стволовой клетки моноцитарного ряда (костномозгового происхождения). Липоциты – клетки небольшого размера, располагаются между соседними гепатоцитами, способны накапливать в цитоплазме ТГ и жирорастворимые витамины. Липоциты способны к синтезу межклеточного матрикса, их количество может резко увеличиваться при ряде хронических заболеваний. Pit-клетки (от англ. Рябой) - эндокринные клетки. Они прикрепляются отростками к эндотелию, контактируют с клетками Купфера и гепатоцитами. Их цитоплазма содержит много секреторных гранул различного цвета. Обладают противоопухолевой активностью, сходны с Т-киллерами. Между дольками имеется соединительная ткань, в ней проходят ветви: печеночной артерии, воротной вены, лимфатического сосуда, желчного протока, которые вместе составляют тетраду, а без лимфатического сосуда – триаду. Желчный капилляр не имеет своей собственной стенки, представляет собой расширенную межклеточную щель, которая образована цитолеммой смежный гепатоцитов с многочисленными микроворсинками. Соприкасающиеся поверхности образуют замыкательные пластинки. В норме они очень прочные и желчь не может проникать в окружающее пространство. В норме междольковая соединительная ткань развита слабо. Портальная печеночная долька - это сегменты 3 близлежащий долек. В ее центре - триада печени, а по острым углам - центральные вены. Кровоток здесь от центра к периферии. Ацинус печени - метаболическая единица. Его образуют сегменты двух соседних классических долек, расположенных между близлежащими центральными венами. Имеет ромбовидную форму, у острых углов находятся центральные вены, у тупых углов – триады. Строма. Снаружи печень покрыта капсулой, от которой отходят перегородки. Капсула образована плотной волокнистой соединительной тканью, покрытой серозной оболочкой. Внутри строма печени представлена рыхлой соединительной тканью (межсегментарная и междольковая соединительная ткань). Развитие печени Печень развивается из 3 зачатков - кишечной эктодермы, мезенхимы и неврального зачатка. Образование начинается в конце 3 недели эмбриогенеза. Появляется выпячивание в вентральной стенке 12 перстной кишки зародыша – печеночная бухта. Из нее происходит развитие печени и желчного пузыря. До рождения в печени происходит гемопоэз. Развитие междольковых соединений заканчивается к 4-5 годам. Формирование структуры печеночных долек завершается к 8-10 годам. Особенности кровоснабжения печени Через печень протекает около 1,2л крови в минуту. Кровоснабжение печени смешанное: 30% крови поступает из печеночной артерии, 70% - из воротной вены, собирающей кровь от непарных органов брюшной полости (ЖКТ). Функции печени: Метаболическая. В печени активно происходит метаболизм всех основных групп органических соединений. Она синтезирует заменимые АК, белки, углеводы, липиды, нуклеиновые кислоты, витамины, ферменты как для себя, так и для других органов и тканей. Например, печень синтезирует большинство органических компонентов плазмы крови. Фильтрационная. Печень удаляет из крови продукты метаболизма, ксенобиотики, излишки органических веществ. В связи с особенностями кровоснабжения, печень работает как первичный регулятор содержания в крови веществ, поступающих в организм с пищей. Прерывистый прием пищи вызывает заметные колебания ассимилированных веществ в портальном круге кровообращения и, благодаря печени, незначительные – в общем круге кровообращения. Детоксикационнная. Обезвреживает ксенобионтики и токсичные метаболиты (аммиак, биллирубин). Запасающая. Запасает глюкозу в виде гликогена, жирорастворимые витамины (А, Д, Е, К), микроэлементы (железо, медь, марганец, никель). Регуляторная. Синтезирует (ангиотензиноген, кальдидиол) и разрушает БАВ (все гормоны, гормоноподобные вещества). Транспортная. Печень синтезирует транспортные формы водонерастворимых веществ: ЛПОНП, ЛПВП, белки плазмы крови (альбумины, транскортин, транстиретин, трансферин, церрулоплазмин и т.д). Защитная. Клетки Купфера фагоцитируют различные микроорганизмы. Фибриноген, протромбин участвуют в свертывании крови, предотвращая ее потерю. Пищеварительная. Секретирует желчь, необходимую для переваривания и всасывания липидов. Выделительная. С желчью из организма продукты метаболизма (билирубин, 17-кетостероиды, холестерин) и ксенобиотики. Кроветворная. У эмбрионов в печени образуются форменные элементы крови, у взрослых компоненты плазмы крови: белки, липиды, углеводы и т.д. В результате, печень интегрирует все виды обмена веществ и поддерживает в организме гомеостаз белков, липидов, углеводов, нуклеиновых кислот, водно-солевой, кислотно-основной, участвует в кроветворении. ХИМИЧЕСКИЙ СОСТАВ ПЕЧЕНИ В печени содержится воды в норме 70%, при отеках до 80%, при жировой дистрофии 55%. Более половины сухого остатка печени это белки, из них 90% глобулины. Печень богата различными ферментами: аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), γ-глутаминтрансферазы (ГГТФ) или γ-глутамилтранспептидазы (ГГТП), глутаматдегидрогеназы (ГлДГ), ЛДГ. В печени содержится в норме 5% липидов (от сырой массы), при ожирении их количество возрастает до 20%, а при жировом перерождении - до 50%. В печени содержится в норме от 2 до 8% гликогена, при паренхиматозных заболеваниях его количество снижается, при некоторых гликогененозах может превышать 20%.
ОСОБЕННОСТИ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА В ПЕЧЕНИ В печени энергетический обмен невысокий и преимущественно анаэробный. Это связано со смешанным кровоснабжением печени и высоким содержанием свободных жирных кислот, которые разобщают окислительное фосфорилирование. Преобладание анаэробных процессов подтверждает наличие в печени изоформ ЛДГ 4 и 5. Основными путями потребления АТФ являются синтетические процессы и активная секреция компонентов желчи. Наиболее активные обменные процессы, требующие наибольшего расхода энергии, протекают в печеночных клетках первых зон ацинусов. Именно эти клетки характеризуются максимальной активностью основных окислительных энзимов цикла Кребса и максимальной активностью АТФ-азы. РОЛЬ ПЕЧЕНИ В УГЛЕВОДНОМ ОБМЕНЕ Печень играет ведущую роль в обмене углеводов: гексоз и пентоз. 1. Основная роль печени в углеводном обмене - поддержание гомеостаза глюкозы в крови. Она достигается благодаря наличию в печени инсулиннезависимых ГЛЮТ-2, специфических ферментов глюкокиназы и глюкозо-6ф-фосфотазы, реакций синтеза и распада гликогена, гликолиза, глюконеогенеза, ПФШ, синтеза ЖК и ТГ. При избытке глюкозы в крови она переносится ГЛЮТ-2 в гепатоцит, где неограниченно фосфорилируется глюкокиназой в глюкозо-6ф. Далее избыток глюкозо-6ф идет на синтез гликогена, жирных кислот, ТГ, ХС. Потребление глюкозы стимулируется инсулином. При дефиците глюкозы в крови в печени активируется гликогенолиз и глюконеогенез (из АК, лактата, глицерина), в которых образуется глюкозо-6ф. Под действием глюкозо-6ф-фосфотазы глюкозо-6ф превращается в глюкозу, которая выходит в кровь. Секреция глюкозы стимулируется глюкагоном, адреналином, глюкокортикоидами. 2. Печень удаляет из крови излишки фруктозы и галактозы. Для метаболизма фруктозы в печени содержится специфические ферменты: фруктокиназа, альдолаза В и триозокиназа. Они обеспечивают включение фруктозы в реакции гликолиза и глюконеогенеза: Фруктоза → фруктозо-1ф → ГА + ДАФ, ГА → ФГА, ДАФ → ФГА, ФГА → гликолиз, глюконеогенез. Для метаболизма галактозы в печени содержится специфические ферменты: галактокиназа, галактозо-1ф-уридилтрансфераза, эпимераза. Они обеспечивают превращение галактозы в глюкозу-6ф: галактоза → галактоза-1ф → УДФ-галактоза → УДФ-глюкоза → глюкозо-1ф → глюкозо-6ф. 3. Печень синтезирует глюкуроновую кислоту. Глюкуроновая кислота необходима для конъюгации плохо растворимых веществ (фенолы, билирубин и др) и образование гетерополисахаридов (гиалуроновая кислота, гепарин и др.). 4. Печень синтезирует пентозофосфаты. В ПФП печени синтезируются пентозофосфаты, необходимые для образования нуклеотидов. 5. Печень синтезирует гепарин. Оценка углеводного обмена в печени Приобретенные (гепатит, цирроз, жировое перерождение) и наследственные заболевания печени (гликогенозы I, III, IV, VI, IX типа, агликогенозы, галактоземия, фруктоземия) могут вызывать нарушения углеводного обмена. Для оценки участия печени в углеводном обмене проводят нагрузочные пробы. Галактозная проба (наиболее ценна, особенно у детей) В норме концентрация галактозы в плазме крови 0,1-0,94 мкмоль/л. В организм вводят галактозу натощак перорально (40г /200мл воды) или внутривенно (1 мл 25% раствора/кг массы тела). Определяют концентрацию галактозы в крови и в моче. У здоровых людей концентрация галактозы нормализуется в крови через 2 часа. Мочу собирают через 2, 4, 10, 24 часа. В первой порции должно быть не более 6г/л галактозы, во второй не более 1,5г/л. В остальных пробах галактоза должна отсутствовать. При остром гепатите галактозы в первой порции мочи 30-50г/, во второй 15-20г/л, в остальных нет. При хроническом гепатите галактозы в первой порции мочи 8-15г/л, во второй - 6-8г/л, в третьей - 4-5г/л, в четвертой - 0-2г/л. При галактоземии во всех пробах мочи галактозы много. Фруктозная проба В норме концентрация фруктозы в плазме крови 55,5-333 мкмоль/л. В организм вводят фруктозу натощак перорально (0,3-0,5г/кг). Определяют концентрацию фруктозы в крови натощак, и после нагрузки через каждые 20 минут в течение 2-3 часов. В норме максимум повышения фруктозы (до 25-30мг%) наступает через 20-40 минут, а затем резко снижается. При фруктоземии во всех пробах фруктозы много в крови и моче. Лактозная проба В норме концентрация лактата в плазме венозной крови 0,5-2,2ммоль/л. После нагрузки лактатом его концентрация в крови зависит от скорости его утилизации в реакциях глюконеогенеза печени. Увеличение концентрации лактата наблюдается при остром гепатите, циррозе. Глюкозотолерантный тест (сахарная нагрузка, сахарные кривые) 1 способ. В организм вводят глюкозу с пищей (1,5-2,0 г/кг массы). Определяют концентрацию глюкозы в крови натощак, и после нагрузки через 30, 60, 90, 120, 180 минут. Оценивают время достижения максимума, максимум, и время возвращения к норме уровня глюкозы в крови. Рассчитывают коэффициент Бодуэна = (максимальная концентрация глюкозы - уровень глюкозы натощак) * 100 / уровень глюкозы натощак. В норме коэффициент равен 50, превышение 80 говорит о серьезной патологии. 2 способ. В организм вводят глюкозу внутривенно (20% раствор 0,33г/ кг массы). Определяют концентрацию глюкозы в крови натощак, и после нагрузки через 10, 20, 30, 40, 50 минут. Оценивают период пулувыведения глюкозы из крови. Так как основная функция печени поддержание уровня глюкозы в крови гипергликемия печеночной природы возникает при нагрузке глюкозой только при тяжелых поражениях печени. Глюкоза Концентрация глюкозы в плазме крови в норме 3,3-5,5ммоль/л. Гипергликемия может быть при хронических заболеваниях печени. Гипогликемия характерный симптом цирроза, гепатита и рака печени. РОЛЬ ПЕЧЕНИ В ЛИПИДНОМ ОБМЕНЕ Печень регулирует уровень липидов в крови. 1. При избытке в крови липидов, печень их захватывает и большую часть гидролизует (ЖК, ТГ и фосфолипиды) на глицерин, ЖК и ряд других веществ (серин, холин, этаноламин и т.д.).Далееглицерин, идет на синтез глюкозы, а ЖК, могут разрушаться путем β-окисления до Ацетил-КоА. 2. При недостатке в крови липидов печень синтезирует ТГ, фосфолипиды и холестерин. Избыток в крови ЖК индуцируется в печени синтез ТГ, кетоновых тел и ХС. Ведущую роль в синтезе липидов играет глюкоза, она дает для синтеза заменимых ЖК НАДФН2 и Ацетил-КоА, для синтеза ТГ – глицерофосфат, для синтеза ФЛ – глицерофосфат и серин. Для синтеза ФЛ и ТГ могут использоваться не только вновь синтезированных ЖК, но и те, которые, образовались при гидролизе других липидов. Для синтеза лецитина, кроме того, необходим либо сам холин, либо доноры метильных групп (например, метионин), с помощью которых он синтезируется. Из Ацетил-КоА, который образуется при β-окисления ЖК или из глюкозы, в печени синтезируются кетоновые тела и холестерин. Холестерина в печени образуется очень много (50-80% от общего синтеза). Синтез кетоновых тел идет только в печени, он значительно возрастает в экстремальных условиях, например, при голодании и физических нагрузках, когда существует дефицит глюкозы. В печени проходит синтез желчных кислот, кальцидиола (стадия синтеза кальцитриола). 3. Печень обеспечивает транспорт большинства липидов в крови. В печени синтезируются альбумины и другие белки, которые переносят в крови на своей поверхности свободные ЖК, жирорастворимые витамины, стероидные гормоны и т.д. В печени синтезируются ЛПВП и ЛПОНП, которые обеспечивают транспорт в крови ТГ, ФЛ, ХС и других липидов. Кроме того, ЛПВП являются источником апобелков, необходимых для обмена ХМ. 4. Печени синтезирует желчь, которая участвует в эмульгировании и всасывании липидов в кишечнике, а также в секреции из организма некоторых липидов (холестерина, желчных кислот, 17-кетостероидов). Оценка липидного обмена в печени Приобретенные (паренхиматозная и обтурационная желтуха, циррозы, гепатиты) и наследственные заболевания печени (некоторые дислипопротеинемии) могут вызывать нарушения липидного обмена. Для оценки участия печени в липидном обмене в крови определяют концентрацию липопротеинов, общих липидов, ТГ, ХС, ЭХС, коэффициент атерогенности и активность ферментов (ЛХАТ, ЛПЛ). Общие липиды Концентрация общих липидов в плазме крови в норме 4-8г. Увеличение общих липидов наблюдается при гепатите, паренхиматозной и обтурационной желтухе. Снижение общих липидов происходит при некрозе печени. Триглицериды Концентрация ТГ в плазме крови в норме 0,5-2,1 ммоль/л. Она повышается при вирусном гепатите, циррозе печени. Фосфолипиды Концентрация фосфолипидов в плазме крови в норме 2,52-2,91 ммоль/л. Повышенный уровень ФЛ наблюдается при биллиарном циррозе. Снижение ФЛ наблюдается при тяжелых формах острого гепатита, портального цирроза и жирового перерождения печени. Холестерин Концентрация ХС ммоль/л – идеальное < 5,2; допустимое – 5,2-6,5; патологическое > 6,5. Повышенный уровень холестерина наблюдается при первичном циррозе, обтурационной желтухе. Гипохолестеринемия – при синдроме мальабсорции, терминальной стадии цирроза печени, раке печени. Печень основное место образования эфиров ХС. Соотношение эфир ХС/общий ХС = 0,55-0,60. Снижение коэффициента (до 0,2-0,4) происходит при острой атрофии печени. Коэффициент атерогенности Концентрация ХС в ЛПВП в норме > 0,9 ммоль/л. Концентрация ХС в ЛПНП в норме < 4,9 ммоль/л. Коэффициент атерогенности = (ХСобщ –ХСЛПВП) / ХСЛПВП < 3 РОЛЬ ПЕЧЕНИ В ОБМЕНЕ АМИНОКИСЛОТ, БЕЛКОВ И ДРУГИХ АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ 1. Печень синтезирует заменимые аминокислоты из углеводов и ЖК. 2. Печень синтезирует тканевые и сывороточные белки: все альбумины, большинство (75-90%) α-глобулинов, 50% β-глобулинов (фибриноген, протромбин, проконвертин, проакцелерин) и немного γ-глобулинов (клетки Купфера). В печени образуется много тканевых ферментов, которые имеют диагностическое значение: ЛДГ, АСТ, АЛТ, транскетолаза, глутаматдегидрогеназа, холинэстераза, щелочная фосфотаза. Печень синтезирует ферменты плазмы крови: ЛХАТ, ЛПЛ, пептидный гормон ангиотензиноген. Печень синтезирует специфические азотсодержащие соединения: холин, креатин. 3. Печень гидролизует тканевые и сывороточные белки, пептидные гормоны до АК. 4. Печень дезаминирует аминокислоты. Образующиеся кетокислоты идут в реакции глюконеогенеза, синтеза кетоновых тел. 5. Печень в орнитиновом цикле нейтрализует аммиак с образованием мочевины. 6. Печень осуществляет катаболизм нуклеотидов до пуриновых и пиримидиновых оснований. Пурины потом превращаются в мочевую кислоту, которая затем выделяется почками. Оценка обмена азотсодержащих соединений в печени Приобретенные (гепатит, цирроз, опухоли и т.д.) и наследственные заболевания печени (фенилкетонурия, алкаптонурия, тирозинемии) могут вызывать нарушения обмена азотсодержащих соединений. Для оценки участия печени в обмене азотсодержащих соединений в плазме крови определяют концентрацию свободных АК, общего белка, белковые фракции, протромбиновый индекс, соотношение мочевина/аммиак, проводят нагрузку метионином, диспротеинемические тесты. Аммиак Концентрация аммиака в плазме крови в норме 19-43мкмоль/л. Концентрация аммиака повышается при тяжелых паренхиматозных поражениях печени, при портоковальном шунтировании. Может привести к развитию печеночной комы. Мочевина Концентрация мочевины в плазме крови в норме 4,2-8,3ммоль/л. Снижение уровня мочевины наблюдается при гепатите, циррозе, острой дистрофии, токсическом поражении печени фосфором, мышьяком и др. ядами. Аминокислоты Концентрация свободных аминокислот в плазме крови в норме 48-68мг/л. Уровень свободных аминокислот (цистеин, метионин, тирозин и глутамат) (и уровень остаточного азота в крови) повышается при тяжелых поражениях печеночной паренхимы, особенно при массивном ее распаде. Фенилаланин и его кетопроизводные повышены в крови при фенилкетонурии. Гомогентизиновая кислота накапливается в организме при алкаптонурии. Повышение тирозина в крови наблюдается при тирозинемиях. Общий белок Концентрация общего белка в плазме крови в норме 70-90г/л. Снижение общего белка происходит при циррозе, гепатите, раке печени, токсическом поражении печени. Альбумины Концентрация альбуминов в плазме крови в норме 56,5-66,5% от общего количества белка. Снижение альбуминов происходит при хронических заболеваниях печени: гепатите, циррозе, опухолях печени. α-Глобулины Концентрация α-глобулинов в плазме крови в норме 7,6-14,2% от общего количества белка. Увеличение α-глобулинов в сыворотке крови характерно для острых воспалительных процессов, т.к. в данную фракцию входят белки острой фазы (с-реактивный белок, α1-антитрипсин, α2-макроглобулин и др.). Содержание α-глобулинов может увеличиваться также при обострениях хронических заболеваний. γ-Глобулины Концентрация γ-глобулинов в плазме крови в норме 12,8-19,0% от общего количества белка. Содержание γ-глобулинов увеличено при хронических патологических состояниях, связанных с интенсификацией иммунных процессов, т.к. эта фракция состоит главным образом из иммуноглобулинов. Альбумино-глобулиновый индекс Альбумино-глобулиновый индекс в норме равен 1,5-2,0. Альбумино-глобулиновый индекс снижается при циррозе печени и нефротическом синдроме. Протромбиновый индекс Протромбиновый индекс - отношение стандартного протромбинового времени к протромбиновому времени у обследуемого пациента, выраженное в процентах. В норме он 80-110%. Так как печень синтезирует белки свертывания крови, протромбиновый индекс снижается при развитии печеночной недостаточности. Нагрузка метионином В организм вводят метионин натощак перорально (50мг/кг). Определяют концентрацию метионина и цистеина в крови и моче натощак, и после нагрузки через каждые 2 часа в течение 12 часов. В норме максимум повышения через 2 часа, нормализация через 6. При печеночной недостаточности максимум превышает норму в 8-10 раз, время циркуляции 10-12 часов. Диспротеинемические тесты (тимоловая проба, сулемовая проба, проба Вельтмана) Тимоловая проба (ТП) - осадочная проба, которая фиксирует дис- и парапротеинемию по изменению соотношения альбуминов и β, γ- глобулинов, липопротеидов, фосфолипидов и по появлению в сыворотке крови высокомолекулярных аномальных белков. Принцип метода: При взаимодействии сыворотки крови с тимоло-вероналовым буфером появляется помутнение вследствие образования глобулин-холестерин-липопротеид-тимол-фосфолипидного комплекса. Его интенсивность связана с количеством и % соотношением отдельных фракций. Проба не специфична, дает положительный (+) ответ при острых и хронических воспалительных процессах протекающих в различных органах и тканях (печень, почки, легкие, соединительная ткань и т.д.). В норме ТП (-) = 0-5 ед. S-H. ТП (+) - при острых вирусных и хронических токсических гепатитах, деком-пенсированном циррозе, раке и его метастазах в печень, при печеночной желтухе. ТП (-) при надпеченочной и подпеченочной желтухе (без цитолиза). РОЛЬ ПЕЧЕНИ В ВОДНО-МИНЕРАЛЬНОМ ОБМЕНЕ Печень синтезирует белки плазмы крови, которые создают в крови онкотическое давление. Печень синтезирует гормон ангиотензиноген, который превращается в ангиотензин и повышает осмотическое и артериальное давление, объем циркулирующей жидкости. РОЛЬ ПЕЧЕНИ В ПИЩЕВАРЕНИИ (БИОСИНТЕЗ И ЦИРКУЛЯЦИЯ ЖЕЛЧНЫХ КИСЛОТ). Печень синтезирует желчь, которая накапливается в желчном пузыре. Жёлчь это вязкая жёлто-зелёная жидкость, имеет рН=7,3-8.0, содержит Н2О – 87-97%, органические вещества (желчные кислоты – 310 ммоль/л (10,3-91,4 г/л), жирные кислоты – 1,4-3,2 г/л, пигменты желчные – 3,2 ммоль/л (5,3-9,8 г/л), холестерин – 25 ммоль/л (0,6-2,6) г/л, фосфолипиды – 8 ммоль/л) и минеральные компоненты (натрий 130-145 ммоль/л, хлор 75-100 ммоль/л, НСО3- 10-28 ммоль/л, калий 5-9 ммоль/л). В процессе пищеварения желчь поступает через желчевыводящий проток в двенадцатиперстную кишку где обеспечивает процесс эмульгирования липидов. Рециклирование компоненты желчи В тонкой кишке вместе с продуктами гидролиза липидов всасываются компоненты желчи - соли жёлчных кислот, фосфолипиды, холестерин. Наиболее активно соли жёлчных кислот всасываются в подвздошной кишке. Жёлчные кислоты далее попадают через воротную вену в печень, из печени вновь секретируются в жёлчный пузырь и далее опять участвуют в эмульгировании липидов. Этот путь жёлчных кислот называют «энтерогепатическая циркуляция». Каждая молекула жёлчных кислот за сутки проходит 5— 8 циклов, и около 5% жёлчных кислот выделяется с фекалиями. Нарушения переваривания и всасывания жиров. Стеаторея При нарушении образования или выделения желчи нарушается переваривание и всасывание липидов. Липиды в повышенном количестве выделяются с калом - возникает стеаторея (жирный стул). В норме в фекалиях липидов не более 5%. При стеаторее нарушается всасывание жирорастворимых витаминов (A, D, Е, К) и незаменимых жирных кислот (витамин F), поэтому развиваются гиповитаминозы жирорастворимых витаминов. Избыток липидов связывает вещества нелипидной природы (белки, углеводы, водорастворимые витамины), и препятствует их перевариванию и всасыванию. Возникают гиповитаминозы по водорастворимым витаминам, белковое и углеводное голодание. Непереваренные белки подвергаются гниению в толстой кишке. РОЛЬ ПЕЧЕНИ В ПИГМЕНТНОМ ОБМЕНЕ В норме в организме взрослого человека разрушается 1-2*1011 эритроцитов в сутки. Их катаболизм происходит главным образом в ретикулоэндотелиальных клетках селезенки, лимфатических узлов, костного мозга и печени. При старении у эритроцитов в гликокаликсе снижается содержание сиаловых кислот. Измененный гликокаликс связывается с рецепторами клеток РЭС, после чего они фагоцитируют эритроциты. Эритроцит переваривается под действием лизосомальных ферментов. Гемоглобин диссоциирует на гемы и глобины. Глобины гидролизуются на аминокислоты. Аналогичная реакция идет с миоглобинами и цитохромами. Катаболизм гема 1. Гем индуцирует синтез гемоксигеназы. Гемоксигеназа, локализованная на мембране ЭПР, расщепляет связь между двумя пиррольными кольцами гема, в результате образуется биливердин. Освободившееся железо связывается ферретином и снова используется организмом. 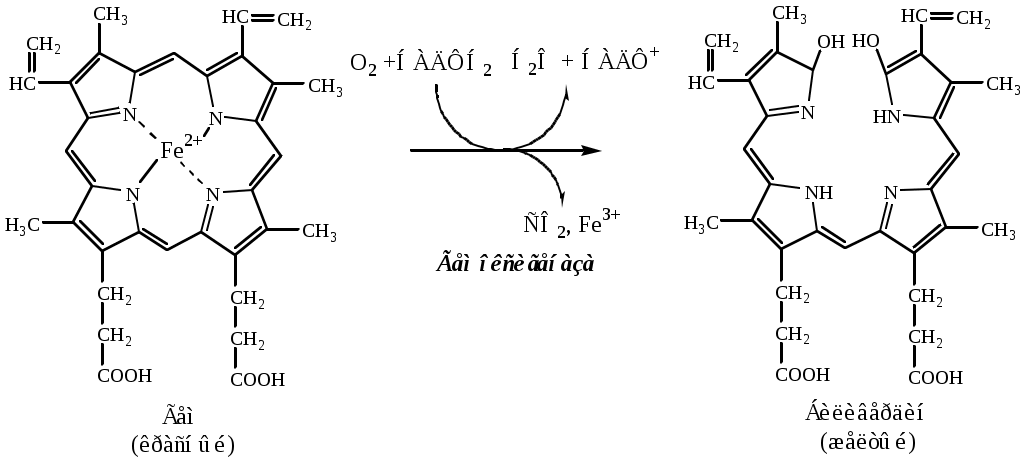 2. Биливердинредуктаза восстанавливает биливердин до билирубина. В сутки образуется 250-350 мг билирубина. 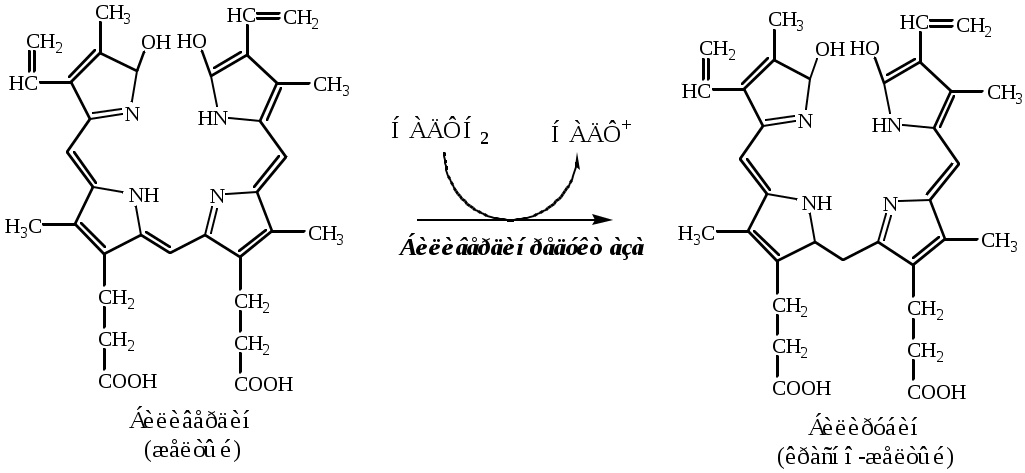 3. Образованный в клетках РЭС билирубин плохо растворим в воде, он транспортируется в печень с участием альбуминов (1 альбумин несет до 3 молекул билирубина). Этот билирубин называется неконъюгированным. 4. В печени альбумин передает билирубины на мембрану гепатоцита. Из мембраны цитоплазматические белки лигандины и протеины Z переносят билирубины в цитоплазму гепатоцита. 5. В гладком ЭПР УДФ-глюкоронилтрансфераза конъюгирует билирубин до диглюкоронида. Донором глюкуроновой кислоты является УДФ-глюкоронид. Полученный билирубин называется конъюгиронным. Индукторами УДФ-глюкоронилтрансферазы служат некоторые лекарства и ксенобиотики. 6. Билирубиндиглюкоронид активно секретируется из гепатоцита в желчь. Процесс самый медленный, он лимитирует весь обмен билирубина. Транспорт билирубиндиглюкоронида индуцируют некоторые лекарства и ксенобиотики. 7. В кишечнике бактериальные β-глюкуронидазы гидролизуют билирубиндиглюкоронид на глюкуроновые кислоты и билирубин. 8. Бактерии восстанавливают билирубин до бесцветных уробилиногенов (мезобилиноген, стеркобилиноген, стеркобелин). 9. В подвздошной и толстой кишках небольшая часть уробилиногенов снова всасывается и попадает с кровью в печень, а большая часть окисляется бактериями до коричневого уробилина и выводиться с калом из организма. 10. Основная часть уробилиногенов попавшая в печень выделяется с желчью в кишечник, окисляется бактериями до коричневого уробилина и выводиться с калом из организма. Часть уробилиногенов проходит печень, поступает с кровью в почки и выделяется с мочой в форме уробилина. Желтухи Концентрация общего билирубина в плазме крови в норме 1,7-17 мкмоль/л. 75% от общего билирубина приходиться на неконъюгированный билирубин (непрямой, водонерастворим, реагирует с диазореактивом только после осаждения альбуминов спиртом) и 25% на конъюгированный билирубин (прямой, водорастворим, дает с диазореактивом розовое окрашивание). При высокой концентрации конъюгированного билирубина он ковалентно связывается с альбумином и не определяется диазореактивом. Причинами гипербилирубинемии является повышенное образование билирубина и (или) нарушение его метаболизма. Избыток билирубина (выше 50 мкмоль/л) диффундирует в ткани, окрашивая их в желтый цвет – возникает желтуха. Выделяют 3 вида желтух: гемолитическая, печеночная и абтурационная (механическая). 1. Гемолитическая желтуха Печень может выделять в 3-4 раза больше билирубина, чем его образуется в норме (6,25г/сут). Когда чрезмерное образование билирубина (до 45г/сут) при усиленном гемолизе эритроцитов превышает способности печени к его выведению, развивается гемолитическая желтуха. Концентрация неконъюгированного билирубина в крови значительно повышена (103-171мкмоль/л). В печени образуется много конъюгированного билирубина, который в кишечнике дает много уробилинов, интенсивно окрашивающих кал и мочу в коричневый цвет. Неконьюгированный билирубин токсичен. Он легко растворяется в мембранах, разобщает окислительное фосфорилирование в митохондриях, нарушает синтез белков, пропускает калий через клеточную мембрану, снижая мембранный потенциал. Наиболее чувствительным к билирубину является ЦНС (неврологические симптомы). Разновидностью гемолитической желтухи является желтуха новорожденных. Она возникает, когда после рождения на фоне печеночной недоразвитости (низкая активность УДФ-глюкоронилтрансферазы, мало УДФ-глюкуроната) происходит усиленный гемолиз фетального гемоглобина. УДФ-глюкоронилтрансферазу индуцируют фенобарбиталом. Если уровень неконъюгированного билирубина превысит 340мкмоль/л, развивается билирубиновая энцефалопатия. 2. Печеночная желтуха Возникает при повреждении гепатоцитов и желчных капилляров (при острых вирусных инфекциях, хронических и токсических гепатитах). Поражение и некроз гепатоцитов вызывает в печени торможение конъюгирования билирубина, в результате в основном образуется моноглюкоронид. Также тормозиться активная секреция глюкоронидов в желчь. В результате подавления секреции и повреждения гепатоцитов конъюгированный билирубин из печени попадает в кровь. В крови наблюдается повышение общего, неконъюгированного и конъюгированного билирубина. Водорастворимый конъюгированный билирубин попадает в мочу, за счет чего она приобретает интенсивную окраску. Так как в кишечник поступает меньше билирубина, а из него образуется меньше уробилинов, кал становиться гипохоличным. 3. Абтурационная (механическая) желтуха Развивается при нарушении желчевыделения, например, из-за закупорки желчных протоков камнями, отеками, опухолями поджелудочной железы, желчного пузыря, печени, двенадцатиперстной кишки. При полной закупорке конъюгированный билирубин не поступает в кишечник и уробилиногены не образуются, кал становиться бесцветным. Конъюгированный билирубин из печени диффундирует в кровь и далее поступает в мочу, за счет чего она приобретает насыщенный оранжево-коричневый цвет. В крови наблюдается высокий уровень конъюгированного билирубина. На практике «чистых» желтух мало, наблюдаются, как правило, различные сочетания. Гемолитическая желтуха провоцирует развитие паренхиматозной. Паренхиматозная желтуха вызывает элементы механической желтухи. 4. Наследственные желтухи Вызывают генетические нарушения белков и ферментов, ответственных за обмен билирубина. При отсутствии УДФ-глюкоронилтрансферазы дети умирают в раннем возрасте от билирубиновой энцефалопатии. При низкой активности УДФ-глюкоронилтрансферазы желтуху лечат фенобарбиталом. Дифференциальная диагностика желтух
РОЛЬ ПЕЧЕНИ В ОБЕЗВРЕЖИВАНИИ КСЕНОБИОТИКОВ Доделать из Северина Печень играет главную роль в обезвреживании токсических веществ, которые образуются в организме (аммиак, билирубин) и ксенобиотиков, которые поступают из внешней среды (продукты гниения аминокислот, лекарства, тяжелые металлы). Ксенобиотики – это чужеродные вещества, которые попадают в организм из внешней среды и не могут использоваться организмом в качестве строительного материала или источника энергии. По отношению к организму они могут быть безвредными или токсичными. Поступление ксенобиотиков Ксенобиотики попадают в организм с вдыхаемым воздухом, пищей и через кожу. Реакции обезвреживания ксенобиотиков в печени Значительная часть ксенобиотиков, попавших в организм, подвергаются в печени реакциям детоксикации. Обезвреживание большинства ксенобиотиков происходит в 2 фазы, в результате которых ксенобиотик увеличивает свою водорастворимость и теряет токсичность. В обезвреживании ксенобиотиков участвует большое количество низкоспецифичных ферментов. 1. Фаза. Микросомальное окисление В монооксигеназных реакциях гладкого ЭПР (микросомальное окисление) окисляются преимущественно гидрофобные ксенобиотики. Микросомальные ферменты осуществляют С-, N-гидроксилирование, О-, N-, S-дезалкилирование, сульфоокисление и эпоксидирование. RH →ROH, R-NH2 → R=O + NH3, R-S-R → R-SO-R В результате этих реакций у ксенобиотика увеличивается водорастворимость. 2. Фаза. Реакции конъюгации Водорастворимые ксенобиотики, попавшие в организм или образовавшиеся при микросомальном окислении, конъюгируют с эндогенными субстратами: глюкуроновой, серной кислотой, глицином, глутатионом. Все реакции конъюгации катализируют трансферазы: УДФ-глюкоронилтрансфераза в ЭПР  Глутатионтрансфераза Инактивирую ксенобиотики, стероидные гормоны, протагландины, билирубин, желчные кислоты, продукты ПОЛ.  Сульфотрансфераза Цитоплазматические сульфотрансферазы сульфируют фенолы, спирты, аминокислоты.  Глицинтрансфераза  Ацетилтрансфераза Ацетилтрансферазы переносят ацетил с Ацетил-КоА на группы –SO2NH2 ксенобиотиков (например сульфаниламиды). Метилтрансфераза Мембранные и цитоплазматические метилтрансферазы с участием SAM метилируют: –Р=О, -NH2, –SH группы ксенобиотиков. В результате конъюгации у ксенобиотика возрастает растворимость в воде и снижается токсичность. Выведение ксенобиотиков Конъюгированные водорастворимые ксенобиотики выделяется из организма преимущественно с мочой и калом, и немногие с потом. Летучие ксенобиотики выделяются из организма с выдыхаемым воздухом, гидрофобные - с калом и кожным салом, некоторые гидрофобные ксенобиотики связываются с липидами и белками и накапливаются в различных органах и тканях. СИНДРОМЫ ПОРАЖЕНИЯ ПЕЧЕНИ Выделяют несколько синдромов поражения печени: цитолитический, холестатический, мезенхимально-воспалительный, печеночной недостаточности, портокавального шунтирования. Цитолитический синдром Возникает в результате дистрофии и некрозе гепатоцитов с повреждением и повышением проницаемости клеточных мембран. Функциональные возможности печени, в зависимости от выраженности процесса, могут быть в пределах нормы или снижены. Характеризуется повышением в плазме крови активности индикаторных ферментов — АсАТ, АлАТ, глутаматдегидрогеназы (ГлДГ), ЛДГ и ее изоферментов — ЛДГ4 и ЛДГ3; специфических печеночных ферментов: гамма-глутаминтрансферазы (ГГТФ), гамма-глутамилтранспептидазы (ГГТП), фруктозо-1-фосфатальдолазы, сорбитдегидрогеназы, , а также концентрации ферритина, сывороточного железа, витамина В12 и билирубина главным образом за счет повышения прямой фракции. Холестатический синдром Возникает при нарушении оттока желчи. Нарушаются функции печени, связанные с эмульгированием липидов, секрецией билирубина, холестерина, ксенобиотиков и т.д. Другие функциональные возможности печени, в зависимости от выраженности процесса, могут быть в пределах нормы или снижены. Холестатический синдром сопровождается повышением уровня в сыворотке крови ЩФ, ЛАП, ГГТФ, холестерина, липопротеинов, конъюгированной фракции билирубина, желчных кислот, фосфолипидов, снижается экскреция бромсульфалеина и радиофармакологических препаратов. Может приводить к желтухе. Определяется с помощью ретроградной холангиографии и УЗИ желчных путей, определением щелочной фосфатазы (ЩФ), 5-нуклеотидазы, гамма-глутамилтрансферазы (ГГТФ), холеглицина и билирубина. Синдром печеночной недостаточности Причиной являются выраженные дистрофические изменения гепатоцитов и/или значительное уменьшение функционирующей паренхимы печени вследствие ее некротических изменений. Характеризуется снижением одной, нескольких или всех функций печени ниже уровня, необходимого для нормальной жизнедеятельности. Проявляется уменьшением содержания в сыворотке крови общего белка и особенно альбумина, трансферрина, холестерина, II, V, VII факторов свертывания крови (снижается протромбиновый индекс), холинэстеразы, ЛПВП, повышением билирубина за счет неконъюгированной фракции. Синдром печеночной недостаточности отражают также нагрузочные пробы: бромсульфалеиновая, индоциановая, антипириновая, галактозная, кофеиновая пробы. Мезенхимально-воспалительный синдром Наблюдается активация и пролиферация лимфоидных и ретикулогистиоцитарных клеток, усиление фиброгенеза, формирование активных септ с некрозами гепатоцитов, внутрипеченочная миграция лейкоцитов, васкулиты. Характеризуется гипергаммаглобулинемией, повышением показателей белково-осадочных проб, увеличением СОЭ, появлением в крови продуктов деградации соединительной ткани (С-реактивный белок, серомукоид и др.). Наблюдаются изменения показателей клеточных и гуморальных иммунных реакций: появляются антитела к субклеточным фракциям гепатоцита, ревматоидный фактор, антимитохондриальные и антиядерные антитела, изменения количества и функциональной активности Т- и В-лимфоцитов, а также повышение уровня иммуноглобулинов. Диагностируется при проведении тимоловой, сулемовой проб, определении гамма-глобулина и иммуноглобулинов сыворотки крови. Синдром портокавального шунтирования Возникает при развитии в печени анастомозов. Часть крови из воротной вены проходит в центральный кровоток мимо печени, в результате чего в крови наблюдаются высокий уровень аммиака, заметные колебания уровня глюкозы. | ||||||||||||||||||||||||||||||||||||||||||||||||
